名校
1 . I、钙和铜合金可用作电解制钙的阴极电极材料,CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成电石(CaC2),电石与水反应生成Ca(OH)2和一种4原子气体分子。
(1)写出电石与水反应的化学方程式___________ ;反应制得的气体中通常会含有硫化氢等杂质气体,可用___________ 吸收。
(2)CaCO3中阴离子的空间构型为___________ 。
(3)该气体分子中σ键与π键的数目之比为___________ 。
(4)写出2种与 互为等电子体的分子的化学式
互为等电子体的分子的化学式___________ 。
(5)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为___________ 、___________ 。

Ⅱ.自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝贵的生命。1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(6)氟气可以用于制取情性强于 的保护气
的保护气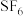 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂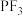 ,
,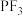 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。
① 分子的空间结构为
分子的空间结构为___________ 。
②S、P、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(7)工业上电解 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石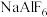 降低
降低 的熔点。
的熔点。 、
、 、F的电负性由小到大的顺序为
、F的电负性由小到大的顺序为___________ ,工业上不用电解 制取铝的原因为
制取铝的原因为___________ 。
(1)写出电石与水反应的化学方程式
(2)CaCO3中阴离子的空间构型为
(3)该气体分子中σ键与π键的数目之比为
(4)写出2种与
 互为等电子体的分子的化学式
互为等电子体的分子的化学式(5)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为

Ⅱ.自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝贵的生命。1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(6)氟气可以用于制取情性强于
 的保护气
的保护气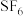 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂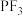 ,
,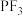 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。①
 分子的空间结构为
分子的空间结构为②S、P、
 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(7)工业上电解
 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石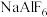 降低
降低 的熔点。
的熔点。 、
、 、F的电负性由小到大的顺序为
、F的电负性由小到大的顺序为 制取铝的原因为
制取铝的原因为
您最近一年使用:0次
2 . 回答下列问题:
(1)下列分子中若有手性原子,请用“*”标出其手性碳原子___________ 。
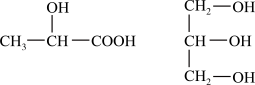
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4___________ H2SO3;HClO3___________ HClO4;
(3)NaBrO、NaBrO2、NaBrO3、NaBrO4四种钠盐中,Br的杂化方式均为___________ ;
(4)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________ ;H2O比H2S更稳定,这是由于___________ 。
(5)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为___________ ,该功能陶瓷的化学式为___________ 。
(1)下列分子中若有手性原子,请用“*”标出其手性碳原子
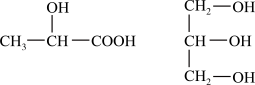
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(3)NaBrO、NaBrO2、NaBrO3、NaBrO4四种钠盐中,Br的杂化方式均为
(4)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
(5)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为

您最近一年使用:0次
2013·辽宁·二模
3 . 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5 ℃,沸点为117 ℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式:_________________________ 。
(2)CH3COCH3分子中含有________ 个π键,含有________ 个σ键。
(3)固态氯化铬酰属于________ 晶体,丙酮中碳原子的杂化方式为_____________ ,二硫化碳属于________ (填“极性”或“非极性”)分子。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有____________ 键。
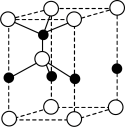
(5)金属铬的晶胞如图所示,一个晶胞中含有________ 个铬原子。

信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5 ℃,沸点为117 ℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式:
(2)CH3COCH3分子中含有
(3)固态氯化铬酰属于
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有
(5)金属铬的晶胞如图所示,一个晶胞中含有

您最近一年使用:0次
2013-09-02更新
|
873次组卷
|
3卷引用:2017届广东省清远市第三中学高三下学期第一次模拟考试理综化学试卷



