名校
解题方法
1 . 回答下列问题。
(1)基态B原子核外电子有___________ 种运动状态。
(2)基态铜原子的电子排布式是___________ ;高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+ 的电子排布式为[Ar]___________ 。
(3)Fe4[Fe(CN)6]3是较早发现的CN- 配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为___________ 。
(4)[B(OH)4]-中氧原子的杂化轨道类型为___________ ,[B(OH)4]-的空间构型为___________ 。
(5)基态氧原子的价层电子排布式不能表示为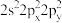 ,因为这违背了
,因为这违背了___________ (填选项)。
A.泡利原理 B.洪特规则 C.能量最低原理
(1)基态B原子核外电子有
(2)基态铜原子的电子排布式是
(3)Fe4[Fe(CN)6]3是较早发现的CN- 配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为
(4)[B(OH)4]-中氧原子的杂化轨道类型为
(5)基态氧原子的价层电子排布式不能表示为
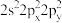 ,因为这违背了
,因为这违背了A.泡利原理 B.洪特规则 C.能量最低原理
您最近一年使用:0次
名校
解题方法
2 . 氯吡苯脲是一种常用的膨大剂,其结构简式如图,它是经国家批准使用的植物生长调节剂。
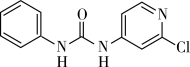
(1)氯元素基态原子核外电子的未成对电子数为_______ 。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为_______ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:

反应过程中,每生成1mol氯吡苯脲,断裂_______ 个 键,断裂
键,断裂_______ 个 键。
键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______
②NH3分子的空间结构是_______ ,H2O中心原子的杂化类型是_______

(1)氯元素基态原子核外电子的未成对电子数为
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:

反应过程中,每生成1mol氯吡苯脲,断裂
 键,断裂
键,断裂 键。
键。(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②NH3分子的空间结构是
您最近一年使用:0次
名校
解题方法
3 . 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)钛铁合金具有吸氢特性,工业在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景,基态Ti原子核外有____ 个运动状态不同的电子,在基态Fe2+中,电子占据的能量最高的轨道为___ 。
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs),硫化镉(CdS)薄膜电池等。镉Cd周期表位于第五周期与Zn同族,则Cd的价电子排布式为:____ ,第一电离能:Ca____ As(填“大于”或“小于”或“等于”;H2S分子的VSEPR模型为____ 。
(3)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。NF3的沸点比NH3更低,原因是____ 。
(4)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图所示,分子中碳原子轨道的杂化类型为____ ;1个C60分子中σ键的数目为____ 个。
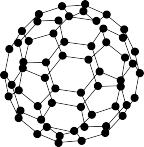
(1)钛铁合金具有吸氢特性,工业在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景,基态Ti原子核外有
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs),硫化镉(CdS)薄膜电池等。镉Cd周期表位于第五周期与Zn同族,则Cd的价电子排布式为:
(3)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。NF3的沸点比NH3更低,原因是
(4)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图所示,分子中碳原子轨道的杂化类型为

您最近一年使用:0次
4 .  有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
(1)基态Co原子的价层电子排布图为_______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_______ ;C、N、O、F的第一电离能由大到小的顺序为_______ 。
(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
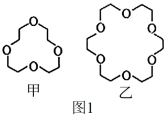
冠醚中O原子的杂化形式为_______ ;H、C、O的电负性由小到大的顺序为_______ 。
(4) 的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。

①每个晶胞中由K和F共同形成的正四面体空隙有_______ 个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于_______ 位置。
 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:(1)基态Co原子的价层电子排布图为
(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。

冠醚中O原子的杂化形式为
(4)
 的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
①每个晶胞中由K和F共同形成的正四面体空隙有
②晶胞的另一种表示中,Co处于各顶角位置,则K处于
您最近一年使用:0次
名校
5 . 【化学——物质结构与性质】
离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:

碳原子价层电子的轨道表达式为_____ ;基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_____ 形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_____ 。NH3比PH3的沸点高,原因是______ .
(3)氮元素的第一电离能比同周期相邻元素都大的原因是_____ 。
(4)已知分子中的大 键可用符号
键可用符号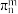 表示,其中n代表参与形成大
表示,其中n代表参与形成大 键的原子数,m代表参与形成大
键的原子数,m代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+离子中碳原子杂化方式有:
)。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+离子中碳原子杂化方式有:_____ ,其中的大 键应表示为
键应表示为_____ .
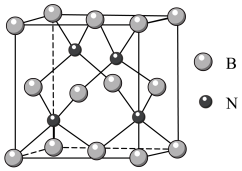
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于晶体,其中硼原子的配位数为_____ 。已知:立方氮化硼密度为dg/cm3, B原子半径为xpm,N原子半径为xpm,阿伏加 德罗常数的值为NA,则该晶胞中原子的空间利用率为______ (列出化简后的计算式)。
离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:

碳原子价层电子的轨道表达式为
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是
(3)氮元素的第一电离能比同周期相邻元素都大的原因是
(4)已知分子中的大
 键可用符号
键可用符号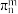 表示,其中n代表参与形成大
表示,其中n代表参与形成大 键的原子数,m代表参与形成大
键的原子数,m代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+离子中碳原子杂化方式有:
)。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+离子中碳原子杂化方式有: 键应表示为
键应表示为(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于晶体,其中硼原子的配位数为

您最近一年使用:0次
解题方法
6 . 硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________ ,VO43-的几何构型为________ .
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为_______ ,该药物中S原子的杂化方式是_______ .所含第二周期元素第一电离能按由大到小顺序的排列是___________ .
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________ .
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____ .
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______ 。图4 为该晶胞的俯视图,该晶胞的密度为________ g/cm3 (列出计算式即可)。

(1)基态钒原子的外围电子轨道表达式为
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为

您最近一年使用:0次
2018-01-24更新
|
601次组卷
|
3卷引用:广东省佛山市普通高中2018届高三教学质量检测(一)化学试题



