名校
1 . 工业制硫酸的反应之一为:2SO2(g)+O2(g) 2SO3(g),在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。
2SO3(g),在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。_______ (填“是”或“否”),25min时,v(正)_______ v(逆)(填“>”、“<”或“=”)。
(2)10min内,O2的反应速率为_______ ;平衡时SO2的转化率为_______ 。
(3)下列叙述不能 判断该反应达到平衡状态的是_______;
(4)在密闭容器里,通入amolSO2(g)、bmolO2(g)、cmolSO3(g),发生上述反应,当改变某种条件时,反应速率会减小的是_______(填字母)。
 2SO3(g),在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。
2SO3(g),在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。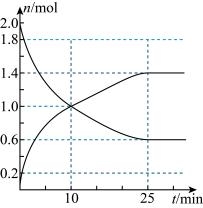
(2)10min内,O2的反应速率为
(3)下列叙述
| A.容器中压强不再改变 | B.容器中气体密度不再改变 |
| C.O2的物质的量浓度不再改变 | D.2V正(SO2)=V逆(O2) |
| A.降低温度 | B.加入催化剂 | C.缩小容器体积 | D.恒容下,充入He |
您最近一年使用:0次
名校
解题方法
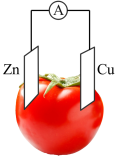
2 . 到目前为止,由化学能转变的热能或电能仍然是人类使用的主要能源。现有反应①Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑②Zn+H2SO4=ZnSO4+H2↑。试回答下列问题:
(1)两反应中属于吸热反应的是_______ (填序号,下同),能设计成原电池的是_______ 。
(2)化学课外活动小组设计的用铜-锌-稀硫酸原电池使LED灯发光的装置示意图。_______ (填“锌”或“铜”)电极方向移动。
②正极的电极方程式为_______ 。
③若反应过程中有0.2 mol电子的转移,则生成的氢气在标准状况下的体积为_______ L。
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:_______ 。(填“正极”或“负极”)
②电极b的电极反应式为_______ 。
(1)两反应中属于吸热反应的是
(2)化学课外活动小组设计的用铜-锌-稀硫酸原电池使LED灯发光的装置示意图。
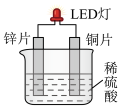
②正极的电极方程式为
③若反应过程中有0.2 mol电子的转移,则生成的氢气在标准状况下的体积为
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
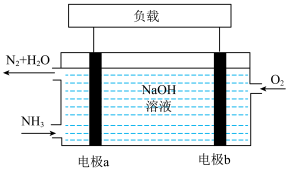
②电极b的电极反应式为
您最近一年使用:0次
3 . “神舟十五号”载人飞船成功发射,创下了我国在超低温天气成功发射载人飞船的新纪录。肼(N2H4)是火箭常用高能燃料,可与O2发生反应:
N2H4(g)+O2(g)=N2(g)+2H2O(g)。
(1)已知上述反应的能量变化如图所示:___________ (填“吸收”或“放出”)能量。
②N2H4(g)完全燃烧生成1molH2O(g)的反应中放出___________ 能量。
(2)反应N2H4(g)+O2(g)=N2(g)+2H2O(l)可设计为燃料电池,电池中用惰性电极铂(Pt),装置如图所示:___________ (填化学式),该装置工作时, 移向电极
移向电极 ___________ (填“Pt1”或“Pt2”)。
②电极Pt1为___________ (填“负极”或“正极”),发生的电极反应为 ___________ 。
N2H4(g)+O2(g)=N2(g)+2H2O(g)。
(1)已知上述反应的能量变化如图所示:
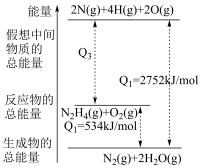
②N2H4(g)完全燃烧生成1molH2O(g)的反应中放出
(2)反应N2H4(g)+O2(g)=N2(g)+2H2O(l)可设计为燃料电池,电池中用惰性电极铂(Pt),装置如图所示:
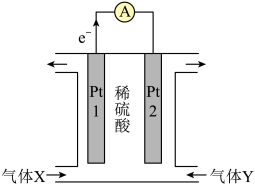
 移向电极
移向电极 ②电极Pt1为
您最近一年使用:0次
解题方法
4 . 按要求回答下列问题:
(1)下列过程中,既属于氧化还原反应,又属于放热反应的是 ___________(填字母)。
(2)一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应(反应物、产物均为气体),反应中各物质物质的量的变化如图所示。___________ 。
②在0~6s内,B的平均反应速率为___________ 。
③6s后容器内的压强与开始时压强之比为___________ 。
(3)已知CH3OCH3的结构式为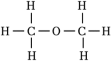 。一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g),下列选项不能作为判断该反应达到平衡状态的依据的是
。一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g),下列选项不能作为判断该反应达到平衡状态的依据的是 ___________ (填字母)。
a.密闭容器中CO的体积分数不变
b.密闭容器中总压强不变
c.密闭容器中混合气体的密度不变
d.密闭容器中混合气体的平均相对分子质量不变
e.单位时间内,断裂4molH-H键,同时生成2molH-O键
(1)下列过程中,既属于氧化还原反应,又属于放热反应的是 ___________(填字母)。
| A.甲烷的燃烧 |
| B.CO2通入灼热的炭层 |
| C.石灰石受热分解 |
| D.碘升华 |

②在0~6s内,B的平均反应速率为
③6s后容器内的压强与开始时压强之比为
(3)已知CH3OCH3的结构式为
 。一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g),下列选项不能作为判断该反应达到平衡状态的依据的是
。一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g),下列选项不能作为判断该反应达到平衡状态的依据的是 a.密闭容器中CO的体积分数不变
b.密闭容器中总压强不变
c.密闭容器中混合气体的密度不变
d.密闭容器中混合气体的平均相对分子质量不变
e.单位时间内,断裂4molH-H键,同时生成2molH-O键
您最近一年使用:0次
名校
5 . 请完成下列填空。
(1)写出下列物质的电子式: :
:________ ,
_________ 。
(2)磷能形成多种具有独特性质的物质。
①磷在元素周期表中的位置_____ 。
②磷能形成红磷、白磷、黑磷等多种单质,它们互为_____ 。
③磷的一种组成为 的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关
的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是_____ (填字母)。
A. 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐
C.均具有较强的还原性 D. 是三元弱酸
是三元弱酸
(3)实验室制氨气的原理_____ 。
(4)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将
中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将 还原,其离子方程式为
还原,其离子方程式为______ 。
(1)写出下列物质的电子式:
 :
:
(2)磷能形成多种具有独特性质的物质。
①磷在元素周期表中的位置
②磷能形成红磷、白磷、黑磷等多种单质,它们互为
③磷的一种组成为
 的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关
的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是A.
 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐C.均具有较强的还原性 D.
 是三元弱酸
是三元弱酸(3)实验室制氨气的原理
(4)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将
中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将 还原,其离子方程式为
还原,其离子方程式为
您最近一年使用:0次
名校
6 . 元素化学是化学的基石,不同的元素往往呈现不同的特性。回答下列问题:
(1)Sn为第五周期元素,与C同主族,基态Sn的价电子排布式为_______ 。
(2)已知 的熔点为1040℃,
的熔点为1040℃, 的熔点为194℃,分析其差异的原因:
的熔点为194℃,分析其差异的原因:_______ 。
(3)基态碳原子的核外电子有_______ 种不同的运动状态。
(4)检验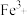 时,
时, 以S原子配位而不以N原子配位的原因是
以S原子配位而不以N原子配位的原因是_______ 。
(5)碳酰肼的结构为 ,是一种新型的环保锅炉水除氧剂。
,是一种新型的环保锅炉水除氧剂。
①碳酰肼中氮原子的杂化轨道类型为_______ 。
② 碳酰肼中含有的
碳酰肼中含有的 键数目为
键数目为_______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(6)血红素是铁卟啉化合物,是血红蛋白的组成部分,其结构如图所示,该化合物中的化学键有_______ (填字母)。 键 C.
键 C. 键 D.氢键 E.配位键
键 D.氢键 E.配位键
(1)Sn为第五周期元素,与C同主族,基态Sn的价电子排布式为
(2)已知
 的熔点为1040℃,
的熔点为1040℃, 的熔点为194℃,分析其差异的原因:
的熔点为194℃,分析其差异的原因:(3)基态碳原子的核外电子有
(4)检验
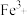 时,
时, 以S原子配位而不以N原子配位的原因是
以S原子配位而不以N原子配位的原因是(5)碳酰肼的结构为
 ,是一种新型的环保锅炉水除氧剂。
,是一种新型的环保锅炉水除氧剂。①碳酰肼中氮原子的杂化轨道类型为
②
 碳酰肼中含有的
碳酰肼中含有的 键数目为
键数目为 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(6)血红素是铁卟啉化合物,是血红蛋白的组成部分,其结构如图所示,该化合物中的化学键有

 键 C.
键 C. 键 D.氢键 E.配位键
键 D.氢键 E.配位键
您最近一年使用:0次
名校
7 . 人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中提供的信息,回答下列问题:
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_____。
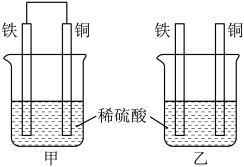
(2)将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:_____ 。
A.甲中铜片质量减少、乙中铁片质量减少 B.甲、乙均为化学能转变为电能的装置
C.乙中铜片上没有明显变化 D.甲、乙两烧杯中 均减小
均减小
②在相同时间内,两烧杯中产生气泡的速度:甲_____ 乙(填“>”、“<”或“=”)。
③请写出甲、乙中构成原电池的正极电极反应式:_____ 。电池工作时,溶液中 向
向_____ 极(填“正”或“负”)移动。当甲中溶液质量增重27g时,电极上转移电子数目为_____ 。
④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为_____ 。
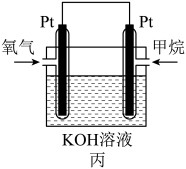
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH.通甲烷一极是电池的____ 极,电极反应为______ 。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_____。
A. 与 与 反应 反应 | B. 与 与 燃烧反应 燃烧反应 |
C.灼热的炭与 反应 反应 | D.氢氧化钠与稀盐酸反应 |
(2)将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
A.甲中铜片质量减少、乙中铁片质量减少 B.甲、乙均为化学能转变为电能的装置
C.乙中铜片上没有明显变化 D.甲、乙两烧杯中
 均减小
均减小②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出甲、乙中构成原电池的正极电极反应式:
 向
向④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH.通甲烷一极是电池的
您最近一年使用:0次
解题方法
8 . 根据所学知识,回答下列问题。
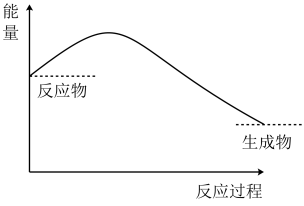
I.锌片与稀硫酸反应的能量变化特征如图所示:___________ 反应(填“吸热”或“放热”)。
(2)锌片和铜片用导线相连后,若将锌片和铜片浸泡在稀硫酸溶液中,可观察到铜片处的现象是___________ 。
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
(3)该实验目的是研究水果种类和___________ 对水果电池电流大小的影响。
(4)该实验装置中,正极的材料是___________ ,负极的电极反应式是___________ 。
(5)当有3.25gZn参与反应,转移的电子数目为___________ 。
I.锌片与稀硫酸反应的能量变化特征如图所示:
(2)锌片和铜片用导线相连后,若将锌片和铜片浸泡在稀硫酸溶液中,可观察到铜片处的现象是
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流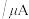 |
|
| 1 | 番茄 | 1 | 98.7 | |
| 2 | 番茄 | 2 | 72.5 | |
| 3 | 苹果 | 2 | 27.2 |
(3)该实验目的是研究水果种类和
(4)该实验装置中,正极的材料是
(5)当有3.25gZn参与反应,转移的电子数目为
您最近一年使用:0次
9 . Ⅰ.牙膏是常见的日用化学品。
(1)下表列出了两种牙膏中的摩擦剂,请在它们所属的物质类别(填“酸”、“碱”、“盐”或“氧化物”)。
(2)请根据用途推测并说明二氧化硅在水中的溶解性____ (“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。
①甲同学设计了一种在实验室制备碳酸钙的实验方案,如下所示:

②乙同学设计的实验方案为:

乙同学的实验方案与甲同学的相比,优点为________ 。
Ⅱ.阅读短文,回答问题。
世界卫生组织(WHO)和中国卫健委公认二氧化氯( )为新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播,餐饮用具可用
)为新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播,餐饮用具可用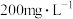 的
的 溶液浸泡,游泳池水可按
溶液浸泡,游泳池水可按 用
用 进行消毒。常温下,
进行消毒。常温下, 气体与
气体与 具有相似的颜色与气味,在水中的溶解度是
具有相似的颜色与气味,在水中的溶解度是 的5~8倍。
的5~8倍。 是强氧化剂,其有效氯是
是强氧化剂,其有效氯是 的2.6倍。
的2.6倍。 不与冷水反应,遇热水则分解成HClO、
不与冷水反应,遇热水则分解成HClO、 和
和 。
。
下表列出了 与传统消毒剂(氯制剂)的部分性能比较:
与传统消毒剂(氯制剂)的部分性能比较:
经大量实验研究表明, 对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用。
对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用。 反应释放出的原子氧还可以氧化色素,所以
反应释放出的原子氧还可以氧化色素,所以 也是优良的漂白剂。研究表明,
也是优良的漂白剂。研究表明, 在浓度低于
在浓度低于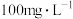 时不会对人体产生任何的影响。我国卫健委提出,逐步用
时不会对人体产生任何的影响。我国卫健委提出,逐步用 替代
替代 进行饮用水消毒。相信在不久的将来,
进行饮用水消毒。相信在不久的将来, 将广泛应用到杀菌消毒领域。
将广泛应用到杀菌消毒领域。
(4)请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
①可以用等浓度的 溶液对餐饮用具和游泳池进行消毒。
溶液对餐饮用具和游泳池进行消毒。______
② 是有刺激性气味的气体。
是有刺激性气味的气体。_______
③ 杀菌力强、无抗药性。
杀菌力强、无抗药性。_______
(5)某同学推测 能与
能与 溶液反应,用简要的文字说明推测合理的理由
溶液反应,用简要的文字说明推测合理的理由________ 。
(1)下表列出了两种牙膏中的摩擦剂,请在它们所属的物质类别(填“酸”、“碱”、“盐”或“氧化物”)。
| 摩擦剂 | 碳酸钙 | 二氧化硅 |
| 物质类别 | ① | ② |
(2)请根据用途推测并说明二氧化硅在水中的溶解性
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。
①甲同学设计了一种在实验室制备碳酸钙的实验方案,如下所示:

②乙同学设计的实验方案为:

乙同学的实验方案与甲同学的相比,优点为
Ⅱ.阅读短文,回答问题。
世界卫生组织(WHO)和中国卫健委公认二氧化氯(
 )为新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播,餐饮用具可用
)为新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播,餐饮用具可用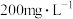 的
的 溶液浸泡,游泳池水可按
溶液浸泡,游泳池水可按 用
用 进行消毒。常温下,
进行消毒。常温下, 气体与
气体与 具有相似的颜色与气味,在水中的溶解度是
具有相似的颜色与气味,在水中的溶解度是 的5~8倍。
的5~8倍。 是强氧化剂,其有效氯是
是强氧化剂,其有效氯是 的2.6倍。
的2.6倍。 不与冷水反应,遇热水则分解成HClO、
不与冷水反应,遇热水则分解成HClO、 和
和 。
。下表列出了
 与传统消毒剂(氯制剂)的部分性能比较:
与传统消毒剂(氯制剂)的部分性能比较:| 性能 |  | 氯制剂(84消毒液、漂白粉等) |
| 杀菌力 | 可杀灭所有的微生物 | 可杀灭所有细菌繁殖体高浓度能杀死细菌芽孢 |
| 残留 | 无 | 有 |
| 抗药性 | 无 | 有 |
 对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用。
对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用。 反应释放出的原子氧还可以氧化色素,所以
反应释放出的原子氧还可以氧化色素,所以 也是优良的漂白剂。研究表明,
也是优良的漂白剂。研究表明, 在浓度低于
在浓度低于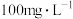 时不会对人体产生任何的影响。我国卫健委提出,逐步用
时不会对人体产生任何的影响。我国卫健委提出,逐步用 替代
替代 进行饮用水消毒。相信在不久的将来,
进行饮用水消毒。相信在不久的将来, 将广泛应用到杀菌消毒领域。
将广泛应用到杀菌消毒领域。(4)请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
①可以用等浓度的
 溶液对餐饮用具和游泳池进行消毒。
溶液对餐饮用具和游泳池进行消毒。②
 是有刺激性气味的气体。
是有刺激性气味的气体。③
 杀菌力强、无抗药性。
杀菌力强、无抗药性。(5)某同学推测
 能与
能与 溶液反应,用简要的文字说明推测合理的理由
溶液反应,用简要的文字说明推测合理的理由
您最近一年使用:0次
10 . 甲、乙、丙均为化合物,其中甲为淡黄色固体,乙在常温下为无色无味液体,丙为常见的无色无味气体,可使澄清石灰水变浑浊。它们有如图所示的转化关系,反应的量均为充足。(生成物中有水生成的,框图中没有表示出来),已知D为黄绿色气体,按要求回答下列问题:
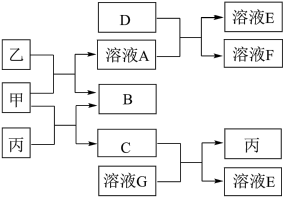
(1)F为______ (填化学式),G的溶质为_______ (填化学式)。
(2)若有3.9g甲与4.4g丙完全反应,则固体质量增加_____ g。
(3)C与溶液G反应生成丙的离子方程式为:________ 。
(4)甲与乙反应的化学方程式为:_______ 。
(5)D能使湿润的有色布条褪色,其褪色原因是_______ (结合离子方程式描述)。

(1)F为
(2)若有3.9g甲与4.4g丙完全反应,则固体质量增加
(3)C与溶液G反应生成丙的离子方程式为:
(4)甲与乙反应的化学方程式为:
(5)D能使湿润的有色布条褪色,其褪色原因是
您最近一年使用:0次