名校
1 . 研究有机物的结构和性质对生产生活意义深远。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。___________ ,B物质的分子式为:___________ 。
(2)按官能团分类,D所属的类别是___________ 。
(3)1molE与足量的金属钠反应产生___________ L氢气(标况下)。
(4)实验室制取C的化学方程式___________ 。
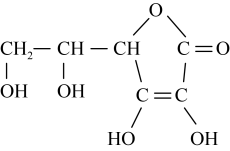
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。___________ (填名称)。
(6)脱氢维生素C中,键角①___________ 键角②(填“>”、“=”或“<”)。
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是___________ 。
(8)标出维生素C中所有的手性碳原子(用*标注)___________ 。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。A. 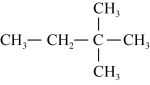 B.
B. 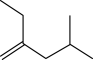 C.
C. D.
D. 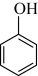 E.
E.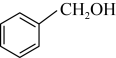
(2)按官能团分类,D所属的类别是
(3)1molE与足量的金属钠反应产生
(4)实验室制取C的化学方程式
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。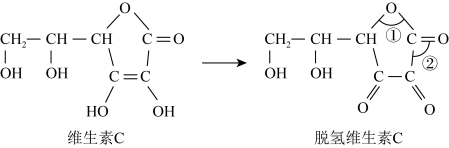
(6)脱氢维生素C中,键角①
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是
(8)标出维生素C中所有的手性碳原子(用*标注)
您最近一年使用:0次
名校
2 . 请按要求作答。
(1)在配合物 中,
中,___________ 是中心离子; 的结构式为
的结构式为___________ ,与氢氧化钠溶液共热能否产生氨气?如果可以请写出化学方程式,如果不可以请说明理由___________ 。
(2)请根据官能团的不同对下列有机物进行分类:___________ ;酮:___________ ;醛:___________ (填序号)。
Ⅱ.④的官能团名称为___________ ,⑥的官能团名称为___________ ,⑦的官能团名称为___________ 。
(3)请写出有机物①与金属钠反应的化学方程式___________ 。
(1)在配合物
 中,
中, 的结构式为
的结构式为(2)请根据官能团的不同对下列有机物进行分类:
①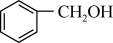 ②
②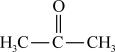 ③
③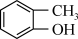 ④
④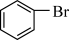 ⑤
⑤ ⑥
⑥ ⑦
⑦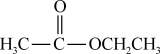
Ⅱ.④的官能团名称为
(3)请写出有机物①与金属钠反应的化学方程式
您最近一年使用:0次
名校
解题方法
3 . 铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用,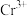 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态 原子价层电子的轨道表达式为
原子价层电子的轨道表达式为___________ ,同周期元素的基态原子最外层电子数与 相同的元素有
相同的元素有___________ (写元素符号)。
(2)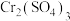 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为___________ ,基态 原子核外电子中成对电子数和未成对电子数之比为
原子核外电子中成对电子数和未成对电子数之比为___________ 。
(3) 中
中 的数目为
的数目为___________ ,含有的的配体是___________ ,配位数是___________ ,配位原子是___________ 。
(4)比较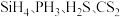 的键角,按由大到小顺序排列:
的键角,按由大到小顺序排列:___________ 。
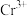 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态
 原子价层电子的轨道表达式为
原子价层电子的轨道表达式为 相同的元素有
相同的元素有(2)
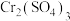 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为 原子核外电子中成对电子数和未成对电子数之比为
原子核外电子中成对电子数和未成对电子数之比为(3)
 中
中 的数目为
的数目为(4)比较
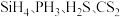 的键角,按由大到小顺序排列:
的键角,按由大到小顺序排列:
您最近一年使用:0次
名校
4 . 根据原子核外电子排布规则,回答下列问题:
(1)写出基态 原子的简化核外电子排布式:
原子的简化核外电子排布式:___________ ;写出基态 原子的价层电子排布式:
原子的价层电子排布式:___________ 。
(2)写出基态 原子的价层电子轨道表示式:
原子的价层电子轨道表示式:___________ 。
(3)若将基态 的电子排布式写成
的电子排布式写成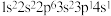 ,则它违背了
,则它违背了___________ 。
(4)已知 比
比 的稳定性更强,用电子排布解释其原因:
的稳定性更强,用电子排布解释其原因:___________ 。
(5)某基态原子的 能级中有一个电子,该原子为
能级中有一个电子,该原子为___________ (写元素符号)。
(1)写出基态
 原子的简化核外电子排布式:
原子的简化核外电子排布式: 原子的价层电子排布式:
原子的价层电子排布式:(2)写出基态
 原子的价层电子轨道表示式:
原子的价层电子轨道表示式:(3)若将基态
 的电子排布式写成
的电子排布式写成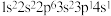 ,则它违背了
,则它违背了(4)已知
 比
比 的稳定性更强,用电子排布解释其原因:
的稳定性更强,用电子排布解释其原因:(5)某基态原子的
 能级中有一个电子,该原子为
能级中有一个电子,该原子为
您最近一年使用:0次
5 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图中分别为钠和氯及其化合物的“价-类”二维图,请回答下列问题:

(1)填写二维图中缺失的化学式:①________ 、②________ 。
(2)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种________ 颜色气体。实验室沿用舍勒的方法制取Cl2的化学方程式为_________ 。
(3)常温下将Cl2通入NaOH溶液中,可以得到一中漂白液。上述反应的离子方程式为:________________ ,该漂白液的有效成分为________ (填名称)。
(4)小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式:________________ 。

(1)填写二维图中缺失的化学式:①
(2)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种
(3)常温下将Cl2通入NaOH溶液中,可以得到一中漂白液。上述反应的离子方程式为:
(4)小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式:
您最近一年使用:0次
名校
6 . 按要求完成下列方程式
(1)用一种碱性氧化物和一种酸制备MgCl2,写出该制备反应的化学方程式___________ 。
(2)常温下以Fe、CuO、H2SO4三种物质为原料制备Cu的离子方程式___________ ,___________ 。
(3)用稀硫酸清洗青铜器表面的铜绿[Cu2(OH)2CO3],写出涉及的离子方程式___________ 。
(4)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为___________ 。
(5)工业废水中含有的Cr2O 有毒,必须处理达标后才能排放。工业上常用FeSO4·7H2O做处理剂将Cr2O
有毒,必须处理达标后才能排放。工业上常用FeSO4·7H2O做处理剂将Cr2O 还原为Cr3+,反应的离子方程式为
还原为Cr3+,反应的离子方程式为___________ 。
(6)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上通过碱性环境中次氯酸钠氧化三氯化铁制备高铁酸钠,制备过程的离子方程式为___________ 。
(1)用一种碱性氧化物和一种酸制备MgCl2,写出该制备反应的化学方程式
(2)常温下以Fe、CuO、H2SO4三种物质为原料制备Cu的离子方程式
(3)用稀硫酸清洗青铜器表面的铜绿[Cu2(OH)2CO3],写出涉及的离子方程式
(4)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为
(5)工业废水中含有的Cr2O
 有毒,必须处理达标后才能排放。工业上常用FeSO4·7H2O做处理剂将Cr2O
有毒,必须处理达标后才能排放。工业上常用FeSO4·7H2O做处理剂将Cr2O 还原为Cr3+,反应的离子方程式为
还原为Cr3+,反应的离子方程式为(6)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上通过碱性环境中次氯酸钠氧化三氯化铁制备高铁酸钠,制备过程的离子方程式为
您最近一年使用:0次
7 . ClO2是一种新型消毒剂,以下反应均能制得ClO2。
Ⅰ.2NaCl+6H2O 2ClO2↑+5H2↑+2NaOH
2ClO2↑+5H2↑+2NaOH
Ⅱ.5NaClO3+6HCl=6ClO2↑+3H2O+5NaCl
Ⅲ.Cl2+2NaClO2=2ClO2↑+2NaCl
(1)请表示反应Ⅰ中电子转移的方向和数目___________ 。
(2)由反应②可知,氧化性NaClO3____ ClO2;
(3)通过反应Ⅱ和Ⅲ分别制备标准状况下2.24LClO2,转移电子物质的量之比为___________ 。
(4)从氯元素利用率的角度分析,以上三种方法中,制备ClO2的最佳方法是___________ 。(填序号)
Ⅰ.2NaCl+6H2O
 2ClO2↑+5H2↑+2NaOH
2ClO2↑+5H2↑+2NaOHⅡ.5NaClO3+6HCl=6ClO2↑+3H2O+5NaCl
Ⅲ.Cl2+2NaClO2=2ClO2↑+2NaCl
(1)请表示反应Ⅰ中电子转移的方向和数目
(2)由反应②可知,氧化性NaClO3
(3)通过反应Ⅱ和Ⅲ分别制备标准状况下2.24LClO2,转移电子物质的量之比为
(4)从氯元素利用率的角度分析,以上三种方法中,制备ClO2的最佳方法是
您最近一年使用:0次
解题方法
8 . I.已知水的电离平衡曲线如图所示:
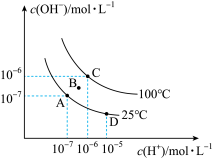
回答下列问题:
(1)图中C点水的离子积常数为___________ (mol·L-1)2。
(2)A、B、C、D四点KW的关系是___________ 。
(3)从A点到D点,可采取的措施是___________ 。
a.升温b.加入少量盐酸c.降温d.加入少量NaOH
Ⅱ.下表是不同温度下水的离子积数据:
试回答以下问题:
(4)若25<t1<t2,则a___________ (填“>”“<”或“=”)1×10-14。
(5)在t2℃,pH=10的NaOH溶液中,水电离产生的OH-浓度为___________ 。
(6)在t2℃下,其溶液的pH=7,则该溶液___________ (填字母)。
a.呈中性b.呈碱性c.呈酸性d.c(OH-)=100c(H+)
(7)25℃时,某Na2SO4溶液中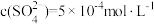 ,取该溶液1mL加水稀至10mL,则稀释后溶液中c(Na+):c(OH-)=
,取该溶液1mL加水稀至10mL,则稀释后溶液中c(Na+):c(OH-)=___________ 。

回答下列问题:
(1)图中C点水的离子积常数为
(2)A、B、C、D四点KW的关系是
(3)从A点到D点,可采取的措施是
a.升温b.加入少量盐酸c.降温d.加入少量NaOH
Ⅱ.下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积KW | 1×10-14 | a | 1×10-12 |
(4)若25<t1<t2,则a
(5)在t2℃,pH=10的NaOH溶液中,水电离产生的OH-浓度为
(6)在t2℃下,其溶液的pH=7,则该溶液
a.呈中性b.呈碱性c.呈酸性d.c(OH-)=100c(H+)
(7)25℃时,某Na2SO4溶液中
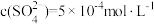 ,取该溶液1mL加水稀至10mL,则稀释后溶液中c(Na+):c(OH-)=
,取该溶液1mL加水稀至10mL,则稀释后溶液中c(Na+):c(OH-)=
您最近一年使用:0次
解题方法
9 . I.写出对应的反应热和热化学方程式
(1)足量H2在1molO2中完全燃烧生成2mol液态水,放出571.6k的热量,则H2的燃烧热ΔH=___________ 。
(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧的热化学方程式:___________ 。
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为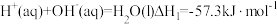
(3)下列各组试剂混合发生反应的离子方程式为 的是
的是___________ (填序号)。
A.盐酸与氢氧化钠溶液B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(4)若稀硫酸与氢氧化钠固体反应生成1mo1H2O(1),则反应放出的热量___________ (填“>”“<”或“=”)57.3kJ,原因是___________ 。
Ⅲ.如图所示,某反应在不同条件下的反应历程分别为a、b。
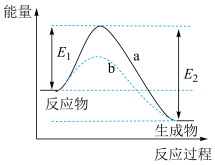
(5)据图可判断出反应物的总键能___________ (填“>”“<”或“=”)生成物的总键能,则该反应的反应热ΔH___________ 0。
(1)足量H2在1molO2中完全燃烧生成2mol液态水,放出571.6k的热量,则H2的燃烧热ΔH=
(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧的热化学方程式:
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为
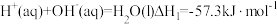
(3)下列各组试剂混合发生反应的离子方程式为
 的是
的是A.盐酸与氢氧化钠溶液B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(4)若稀硫酸与氢氧化钠固体反应生成1mo1H2O(1),则反应放出的热量
Ⅲ.如图所示,某反应在不同条件下的反应历程分别为a、b。

(5)据图可判断出反应物的总键能
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题
(1)氧化铝 具有耐高温、抗冲击、导热性好等优良性质.广泛应用于电子工业,陶瓷工业等领域。在一定条件下,氮化铝通过如下反应合成:
具有耐高温、抗冲击、导热性好等优良性质.广泛应用于电子工业,陶瓷工业等领域。在一定条件下,氮化铝通过如下反应合成: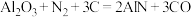 。
。
①在化学方程式上用双线桥标出反应中电子转移的方向和数目______
(2)已知以下反应
Ⅰ、
Ⅱ、
Ⅲ、
根据以上四个反应,回答下列有关问题。
①反应Ⅰ中,氧化产物和还原产物的分子个数比为______ 。
②反应Ⅱ中氧化剂与还原剂的个数比为______ 。
③反应Ⅲ的离子方程式______ 。
④若要制取相等质量的氯气,Ⅰ、Ⅲ反应中电子转移的数目之比为______ 。
⑤ ,
, ,
, 按氧化性由强到弱的顺序排序
按氧化性由强到弱的顺序排序______ 。
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒: 、
、 、
、 、
、 、
、 、
、 。
。
已知物质混合后有大量气泡产生。写出该反应的离子方程式(不用配平)_______ 。
(1)氧化铝
 具有耐高温、抗冲击、导热性好等优良性质.广泛应用于电子工业,陶瓷工业等领域。在一定条件下,氮化铝通过如下反应合成:
具有耐高温、抗冲击、导热性好等优良性质.广泛应用于电子工业,陶瓷工业等领域。在一定条件下,氮化铝通过如下反应合成: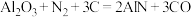 。
。①在化学方程式上用双线桥标出反应中电子转移的方向和数目
(2)已知以下反应
Ⅰ、

Ⅱ、

Ⅲ、

根据以上四个反应,回答下列有关问题。
①反应Ⅰ中,氧化产物和还原产物的分子个数比为
②反应Ⅱ中氧化剂与还原剂的个数比为
③反应Ⅲ的离子方程式
④若要制取相等质量的氯气,Ⅰ、Ⅲ反应中电子转移的数目之比为
⑤
 ,
, ,
, 按氧化性由强到弱的顺序排序
按氧化性由强到弱的顺序排序(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
 、
、 、
、 、
、 、
、 、
、 。
。已知物质混合后有大量气泡产生。写出该反应的离子方程式(不用配平)
您最近一年使用:0次



