1 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: 。请回答下列问题:
。请回答下列问题:
(1)上述反应中,被氧化的元素是___________ ,还原产物是___________ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:___________ 。

(3)反应中每生成1个 ,转移
,转移___________ 个电子。
(4)请配平下列离子方程式:___________ 。
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
(5)已知 、
、 、
、 、
、 、
、 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: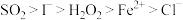 ,则下列反应不能发生的是:___________。
,则下列反应不能发生的是:___________。
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: 。请回答下列问题:
。请回答下列问题:(1)上述反应中,被氧化的元素是
(2)用“双线桥法”表示反应中电子转移的方向和数目:

(3)反应中每生成1个
 ,转移
,转移(4)请配平下列离子方程式:
___________
 ___________
___________ ___________
___________ ___________
___________ ___________
___________
(5)已知
 、
、 、
、 、
、 、
、 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: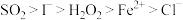 ,则下列反应不能发生的是:___________。
,则下列反应不能发生的是:___________。A.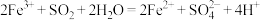 |
B. |
C.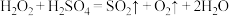 |
D. |
您最近一年使用:0次
名校
2 . 氢叠氮酸( )和莫尔盐
)和莫尔盐 是两种常用原料。
是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为
①氢叠氮酸在水溶液中的电离方程式为___________ 。
②0.1mol/L的 溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为
溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为___________ 。
③已知T℃时,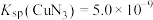 ,
, ,在此温度下,
,在此温度下,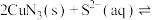
 ,该反应正反应方向
,该反应正反应方向___________ (填“能”或“不能”)基本进行彻底,请通过计算说明___________ 。
(2)在 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
滴定终点的现象是___________ ,通过实验数据,计算该产品的纯度为___________ (用含字母a、c的式子表示)。上表中第一次实验的记录数据明显大于后两次,其原因可能是___________ (填字母)。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视读数,滴定结束后俯视读数
 )和莫尔盐
)和莫尔盐 是两种常用原料。
是两种常用原料。(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为

①氢叠氮酸在水溶液中的电离方程式为
②0.1mol/L的
 溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为
溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为③已知T℃时,
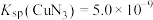 ,
, ,在此温度下,
,在此温度下,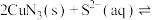
 ,该反应正反应方向
,该反应正反应方向(2)在
 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液体积/mL 溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视读数,滴定结束后俯视读数
您最近一年使用:0次
名校
解题方法
3 . I.现有下列十种物质:①硫酸 ②石墨 ③纯碱 ④二氧化碳 ⑤葡萄糖 ⑥氨水 ⑦小苏打⑧NaOH溶液 ⑨Al2O3 ⑩硫酸铁溶液
上述十种物质中能导电的物质有___________ ,属于电解质的有___________ (填序号)。
Ⅱ.(1)14 g C2H4与C4H8的混合物所含质子的物质的量为___________ 。
(2)Cl﹣浓度为0.4mol•L﹣1的BaCl2溶液的物质的量浓度为___________ ,200mL该BaCl2溶液中含Ba2+的数目为___________ 。
(3)50mL质量分数为98%、密度为1.84g·cm-3的硫酸中,H2SO4的物质的量浓度为___________ 。
(4)3.1g Na2X含有Na+ 0.1 mol,则Na2X的摩尔质量为___________ ,X的相对原子质量为___________ 。
上述十种物质中能导电的物质有
Ⅱ.(1)14 g C2H4与C4H8的混合物所含质子的物质的量为
(2)Cl﹣浓度为0.4mol•L﹣1的BaCl2溶液的物质的量浓度为
(3)50mL质量分数为98%、密度为1.84g·cm-3的硫酸中,H2SO4的物质的量浓度为
(4)3.1g Na2X含有Na+ 0.1 mol,则Na2X的摩尔质量为
您最近一年使用:0次
4 . Ⅰ、重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(1)你认为往废水中投入_____ (填字母序号),沉淀效果最好。
A NaOH B Na2S C KI D Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______ mol/L。
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。回答下列问题:
已知:25℃,Ksp(AgI,黄色)=8.3×10‾17,Ksp(AgSCN,白色)= 1.0×10‾12 。
(3)步骤3中现象a是________________ 。
(4)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为__________ mol/L。
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A NaOH B Na2S C KI D Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。回答下列问题:
| 步骤1:向2mL0.005 mol/LAgNO3溶液中加入2 mL0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
(3)步骤3中现象a是
(4)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为
您最近一年使用:0次
2020-11-04更新
|
328次组卷
|
2卷引用:广东省珠海市第二中学2019-2020学年高二上学期期中考试化学试题
名校
解题方法
5 . 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。

(1)A室混合气体的物质的量为________ ,所含原子总数为________ 。
(2)实验测得A室混合气体的质量为34g,该混合气体的密度是同温同压条件下氦气密度的________ 倍,该混合气体含电子总数为________ 。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________ 刻度,容器内气体压强与反应前气体压强之比为________ 。

(1)A室混合气体的物质的量为
(2)实验测得A室混合气体的质量为34g,该混合气体的密度是同温同压条件下氦气密度的
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在
您最近一年使用:0次



