1 . 铵盐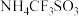 可用于水系电池中降低水的活性,提高放电效率。回答下列问题:
可用于水系电池中降低水的活性,提高放电效率。回答下列问题:
(1)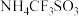 组成元素中基态氮原子的核外电子排布式为
组成元素中基态氮原子的核外电子排布式为_______ ,占据最高能级电子的电子云轮廓图为_______ 形。
(2)阴离子 组成元素中,第一电离能比氮小的元素除C外还有
组成元素中,第一电离能比氮小的元素除C外还有_______ (填元素符号)。
(3)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是_______ (填字母)。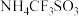 组成元素的化合价正负可用元素的电负性判断,元素的电负性还可用于判断元素的其他性质,下表列出10种元素的电负性。
组成元素的化合价正负可用元素的电负性判断,元素的电负性还可用于判断元素的其他性质,下表列出10种元素的电负性。
已知:通常两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
①根据表格中的数据,确定 元素电负性的最小范围为
元素电负性的最小范围为_______ 。
②下列物质属于离子化合物的是_______ (填字母)。
a. b.
b.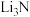 c.
c. d.
d.
③请设计实验方案证明②中你选出的物质为离子化合物_______ 。
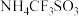 可用于水系电池中降低水的活性,提高放电效率。回答下列问题:
可用于水系电池中降低水的活性,提高放电效率。回答下列问题:(1)
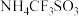 组成元素中基态氮原子的核外电子排布式为
组成元素中基态氮原子的核外电子排布式为(2)阴离子
 组成元素中,第一电离能比氮小的元素除C外还有
组成元素中,第一电离能比氮小的元素除C外还有(3)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是
a.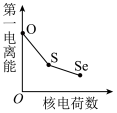 b.
b.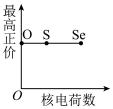 c.
c.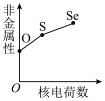 d.
d.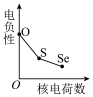
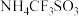 组成元素的化合价正负可用元素的电负性判断,元素的电负性还可用于判断元素的其他性质,下表列出10种元素的电负性。
组成元素的化合价正负可用元素的电负性判断,元素的电负性还可用于判断元素的其他性质,下表列出10种元素的电负性。| 元素 |  |  |  |  |  |  |  |  |  |  |  |
| 电负性 | 1.5 | 1.5 | 2.5 | 3.0 | 0.9 | 1.0 | 3.0 | 1.8 | 3.5 | 2.1 |
①根据表格中的数据,确定
 元素电负性的最小范围为
元素电负性的最小范围为②下列物质属于离子化合物的是
a.
 b.
b.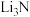 c.
c. d.
d.
③请设计实验方案证明②中你选出的物质为离子化合物
您最近一年使用:0次
2 . 生理氯化钠溶液主要用于手术、伤口、眼部、黏膜等冲洗。某品牌的生理氯化钠溶液及相关的成份、性状等如下图所示:
(1)氯化钠属于___________ (填物质类别)。
(2)该生理氯化钠溶液的物质的量浓度为___________ mol/L(精确到0.01)。
(3)实验室配制100mL与上述浓度相同的氯化钠溶液:
①配制过程中不需要用到的仪器是___________ 。___________ (填字母)。
A.摇匀后液面低于刻度线,加水至刻度线
B.定容时,俯视刻度线
C.未将烧杯中的洗涤液转移至容量瓶中
D.容量瓶中事先含有少量蒸馏水
(4)电导率可用于衡量电解质溶液导电能力的大小。为探究电解质溶液电导率的影响因素,某实验小组用相同浓度的氯化钠溶液设计实验,方案如下表:
①实验 、
、 的目的是
的目的是___________ 。
②实验 、
、 的目的是其他条件不变时,探究离子浓度对电导率的影响,则
的目的是其他条件不变时,探究离子浓度对电导率的影响,则
___________ mL,理由是___________ 。

(1)氯化钠属于
(2)该生理氯化钠溶液的物质的量浓度为
(3)实验室配制100mL与上述浓度相同的氯化钠溶液:
①配制过程中不需要用到的仪器是
A.  B.
B.  C.
C. D.
D.
A.摇匀后液面低于刻度线,加水至刻度线
B.定容时,俯视刻度线
C.未将烧杯中的洗涤液转移至容量瓶中
D.容量瓶中事先含有少量蒸馏水
(4)电导率可用于衡量电解质溶液导电能力的大小。为探究电解质溶液电导率的影响因素,某实验小组用相同浓度的氯化钠溶液设计实验,方案如下表:
| 实验序号 | 氯化钠溶液/mL | 水/mL | 温度/ | 电导率/( ) ) |
 | 10.0 | 0.0 | 25 |  |
 | 9.0 | V | 25 |  |
 | 10.0 | 0.0 | 35 |  |
 、
、 的目的是
的目的是②实验
 、
、 的目的是其他条件不变时,探究离子浓度对电导率的影响,则
的目的是其他条件不变时,探究离子浓度对电导率的影响,则
您最近一年使用:0次
解题方法
3 . 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值 可通过量热装置测量反应前后体系温度变化,用公式
可通过量热装置测量反应前后体系温度变化,用公式 计算获得(
计算获得( 和
和 分别取
分别取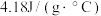 和
和 ,忽略水以外各物质吸收的热量)。
,忽略水以外各物质吸收的热量)。
(1)配制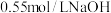 溶液,若实验中大约要使用
溶液,若实验中大约要使用 溶液,则需要称量
溶液,则需要称量 固体
固体_______ g。
(2)测定中和热的实验装置如下图所示。取 溶液和
溶液和 硫酸溶液进行实验,从实验装置上看,图中尚缺少的重要仪器为
硫酸溶液进行实验,从实验装置上看,图中尚缺少的重要仪器为_______ 。 溶液和
溶液和 硫酸溶液进行中和反应,测得生成
硫酸溶液进行中和反应,测得生成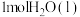 时放出热量
时放出热量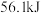 ,写出该反应的热化学方程式
,写出该反应的热化学方程式_______ 。
(4)借鉴上述方法,甲同学测量放热反应 的焓变
的焓变 (忽略温度对焓变的影响,下同)。实验结果见下表:
(忽略温度对焓变的影响,下同)。实验结果见下表:
①温度:b_______ c(填“>”“<”或“=”)。
②
_______ (选择表中一组数据计算)。结果表明,该方法可行。
(5)乙同学也借鉴上述方法,测量反应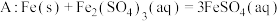 的焓变。
的焓变。
查阅资料:配置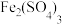 溶液时需加入
溶液时需加入_______ ,目的是抑制 水解。
水解。
提出猜想: 粉与
粉与 溶液混合,在反应A进行的过程中,可能存在
溶液混合,在反应A进行的过程中,可能存在 粉和酸的反应。
粉和酸的反应。
验证猜想:用 试纸测得
试纸测得 溶液的
溶液的 不大于1;向少量
不大于1;向少量 溶液中加入
溶液中加入 粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和
粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和_______ (用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
优化设计:鉴于以上问题,乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案如下:_______ ;
根据(4)中实验计算得到反应 的焓变
的焓变 ,利用盖斯定律计算得到反应
,利用盖斯定律计算得到反应 的焓变为
的焓变为 。请补充完整上述方案。
。请补充完整上述方案。
 可通过量热装置测量反应前后体系温度变化,用公式
可通过量热装置测量反应前后体系温度变化,用公式 计算获得(
计算获得( 和
和 分别取
分别取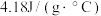 和
和 ,忽略水以外各物质吸收的热量)。
,忽略水以外各物质吸收的热量)。(1)配制
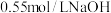 溶液,若实验中大约要使用
溶液,若实验中大约要使用 溶液,则需要称量
溶液,则需要称量 固体
固体(2)测定中和热的实验装置如下图所示。取
 溶液和
溶液和 硫酸溶液进行实验,从实验装置上看,图中尚缺少的重要仪器为
硫酸溶液进行实验,从实验装置上看,图中尚缺少的重要仪器为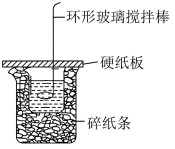
 溶液和
溶液和 硫酸溶液进行中和反应,测得生成
硫酸溶液进行中和反应,测得生成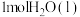 时放出热量
时放出热量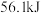 ,写出该反应的热化学方程式
,写出该反应的热化学方程式(4)借鉴上述方法,甲同学测量放热反应
 的焓变
的焓变 (忽略温度对焓变的影响,下同)。实验结果见下表:
(忽略温度对焓变的影响,下同)。实验结果见下表:| 序号 | 反应试剂 | 体系温度/℃ | ||
| 反应前 | 反应后 | |||
| i |  溶液 溶液 |  粉 粉 | a | b |
| ii |  粉 粉 | a | c | |
②

(5)乙同学也借鉴上述方法,测量反应
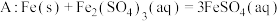 的焓变。
的焓变。查阅资料:配置
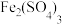 溶液时需加入
溶液时需加入 水解。
水解。提出猜想:
 粉与
粉与 溶液混合,在反应A进行的过程中,可能存在
溶液混合,在反应A进行的过程中,可能存在 粉和酸的反应。
粉和酸的反应。验证猜想:用
 试纸测得
试纸测得 溶液的
溶液的 不大于1;向少量
不大于1;向少量 溶液中加入
溶液中加入 粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和
粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和实验小结:猜想成立,不能直接测反应A的焓变。
优化设计:鉴于以上问题,乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案如下:
根据(4)中实验计算得到反应
 的焓变
的焓变 ,利用盖斯定律计算得到反应
,利用盖斯定律计算得到反应 的焓变为
的焓变为 。请补充完整上述方案。
。请补充完整上述方案。
您最近一年使用:0次
4 . 写出下列有关的化学方程式:
(1)碳酸钙和醋酸溶液反应:___________ ;
(2)硫酸铁和氢氧化钡溶液反应:___________ ;
(3)硫酸铜溶液和铁反应:___________ ;
(4)氯化钡溶液和碳酸钠溶液反应:___________ 。
(1)碳酸钙和醋酸溶液反应:
(2)硫酸铁和氢氧化钡溶液反应:
(3)硫酸铜溶液和铁反应:
(4)氯化钡溶液和碳酸钠溶液反应:
您最近一年使用:0次
名校
解题方法
5 . 填空
| 酸性氧化物 | 碱性氧化物 | |
| 定义 | 凡能与碱反应生成盐和水的氧化物。 如:CO2、SO2、SO3、P2O5、SiO2 「大多数非金属氧化物是酸性氧化物,大多数酸性氧化物是非金属氧化物」 | 凡能与酸反应生成盐和水的氧化物。 如:K2O、Na2O、BaO、CaO、CuO、Fe2O3、MgO。 「大多数金属氧化物是碱性氧化物,所有碱性氧化物是金属氧化物」 |
| 化学性质 | (1)可溶的能与水反应生成酸 CO2+H2O  H2CO3 H2CO3SO2+H2O  SO3+H2O= | (1)可溶的能与水反应生成碱 Na2O+H2O=2NaOH K2O+H2O= CaO+ |
| (2)酸性氧化物+碱→盐+水 (不是复分解反应) | (2)碱性氧化物+酸→盐+水 |
您最近一年使用:0次
6 . 酸雨对环境危害巨大, 、
、 的排放都会形成酸雨。某地的酸雨中溶质只含有
的排放都会形成酸雨。某地的酸雨中溶质只含有 、
、 、HCl,为检验这三种成分,甲、乙两个兴趣小组分别设计了实验进行探究。
、HCl,为检验这三种成分,甲、乙两个兴趣小组分别设计了实验进行探究。
(1)实验室常用浓硫酸与铜反应制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)甲组同学取少量该酸雨于试管中,滴加少量的 溶液,产生白色沉淀,据此认为酸雨中一定含有
溶液,产生白色沉淀,据此认为酸雨中一定含有 。该结论是否正确?并说明理由
。该结论是否正确?并说明理由___________ 。
(3)为检验酸雨中的成分,乙组同学设计了如下实验方案。可选用试剂:稀盐酸、稀硝酸、 溶液、
溶液、 溶液、紫色石蕊溶液、品红溶液、淀粉溶液。请将下表中的内容补充完整。
溶液、紫色石蕊溶液、品红溶液、淀粉溶液。请将下表中的内容补充完整。
(4)酸雨中 含量的测定。
含量的测定。
①反应原理: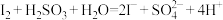
②配制100 mL一定浓度的碘水溶液:称取a g碘单质,加入适量的水溶解后,转移至___________ ,用蒸馏水定容。
③滴定:准确量取25.00 mL该酸雨于锥形瓶中,加入几滴淀粉溶液,将配制好的碘水装入50 mL的酸式滴定管中,滴定。记录数据,重复滴定2次,平均消耗碘水的体积为b mL。
④计算:酸雨中 的物质的量浓度为
的物质的量浓度为___________ mol⋅L (列式表示)。
(列式表示)。
 、
、 的排放都会形成酸雨。某地的酸雨中溶质只含有
的排放都会形成酸雨。某地的酸雨中溶质只含有 、
、 、HCl,为检验这三种成分,甲、乙两个兴趣小组分别设计了实验进行探究。
、HCl,为检验这三种成分,甲、乙两个兴趣小组分别设计了实验进行探究。(1)实验室常用浓硫酸与铜反应制备
 ,该反应的化学方程式为
,该反应的化学方程式为(2)甲组同学取少量该酸雨于试管中,滴加少量的
 溶液,产生白色沉淀,据此认为酸雨中一定含有
溶液,产生白色沉淀,据此认为酸雨中一定含有 。该结论是否正确?并说明理由
。该结论是否正确?并说明理由(3)为检验酸雨中的成分,乙组同学设计了如下实验方案。可选用试剂:稀盐酸、稀硝酸、
 溶液、
溶液、 溶液、紫色石蕊溶液、品红溶液、淀粉溶液。请将下表中的内容补充完整。
溶液、紫色石蕊溶液、品红溶液、淀粉溶液。请将下表中的内容补充完整。| 步骤 | 实验方案 | 实验现象 | 结论 |
| ① | 往A、B两支试管中分别加入2~3mL酸雨。 | ||
| ② | 往A试管中加入过量的 | 产生白色沉淀。 | 酸雨中含有 或 或 或两者均有。 或两者均有。 |
| ③ | 往B试管中加入少量品红溶液。 | 品红溶液褪色。 | 酸雨中含有 。 。 |
| ④ | 取少量步骤②得到的沉淀加入过量稀盐酸。 | 酸雨中含有 。 。 | |
| ⑤ | 取少量步骤②得到的滤液, | 产生白色沉淀。 | 酸雨中含有HCl。 |
 含量的测定。
含量的测定。①反应原理:
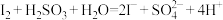
②配制100 mL一定浓度的碘水溶液:称取a g碘单质,加入适量的水溶解后,转移至
③滴定:准确量取25.00 mL该酸雨于锥形瓶中,加入几滴淀粉溶液,将配制好的碘水装入50 mL的酸式滴定管中,滴定。记录数据,重复滴定2次,平均消耗碘水的体积为b mL。
④计算:酸雨中
 的物质的量浓度为
的物质的量浓度为 (列式表示)。
(列式表示)。
您最近一年使用:0次
7 . 阅读下面一段材料并回答问题。
(1)K2FeO4中铁元素的化合价为___________ 。
(2)制备K2FeO4需要在___________ (填“酸性 ”、“碱性 ”或“ 中性 ”)环境中进行。
(3)下列关于K2FeO4的说法中,不正确的是___________ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠 Na2FeO4 是一种新型的净水剂,可以通过下述反应制取:
2Fe(OH)3 +4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是___________ (用化学式表示,下同),还原产物为___________ 。
②用双线桥法在方程式中标出电子转移的情况:___________ 。
(5)将K2FeO4与水反应的化学方程式补充完整:___________ 。
4K2FeO4+___________H2O=___________Fe(OH)3(胶体)+___________+___________KOH
(6)在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
2FeSO4+6Na2O2 2Na2FeO4+2Na2O+2Na2SO4+O2↑,再加入适量饱和KOH溶液反应得到K2FeO4,若生成标准状况下3.36LO2,则转移电子总数是
2Na2FeO4+2Na2O+2Na2SO4+O2↑,再加入适量饱和KOH溶液反应得到K2FeO4,若生成标准状况下3.36LO2,则转移电子总数是___________ 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是___________ (用化学方程式表示)。
| 高铁酸钾使用说明书 【化学式】K2FeO4 【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH 减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的 Fe(OH)3 胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化 1L 水投放 5mg K2FeO4 ,即可达到卫生标准 |
(2)制备K2FeO4需要在
(3)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠 Na2FeO4 是一种新型的净水剂,可以通过下述反应制取:
2Fe(OH)3 +4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是
②用双线桥法在方程式中标出电子转移的情况:
(5)将K2FeO4与水反应的化学方程式补充完整:
4K2FeO4+___________H2O=___________Fe(OH)3(胶体)+___________+___________KOH
(6)在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
2FeSO4+6Na2O2
 2Na2FeO4+2Na2O+2Na2SO4+O2↑,再加入适量饱和KOH溶液反应得到K2FeO4,若生成标准状况下3.36LO2,则转移电子总数是
2Na2FeO4+2Na2O+2Na2SO4+O2↑,再加入适量饱和KOH溶液反应得到K2FeO4,若生成标准状况下3.36LO2,则转移电子总数是
您最近一年使用:0次
名校
8 . 回答下列问题。
Ⅰ.根据物质结构和性质的知识,回答下列问题:
(1)下列物质中既有极性键,又有非极性键的极性分子是_______。
(2)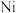 能与
能与 形成正四面体形的配合物
形成正四面体形的配合物 中含有
中含有_______ 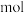
 键。
键。
(3) 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是_______ 。
(4)文献报道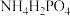 是制备
是制备 的原料。
的原料。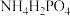 中,电负性最高的元素是
中,电负性最高的元素是_______ 。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。有机物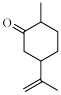 中,有
中,有_______ 个手性碳, 该有机物含
该有机物含 键的个数为
键的个数为_______ 。
Ⅱ.现有十种有机物,请用所学知识回答下列问题:_______ (填“醇”或“酚”)类。
(7)⑧和⑩的关系为_______ (填“同分异构体”或“同系物”)。
(8)能使酸性高锰酸钾溶液褪色的烃有_______ (填序号)。
(9)⑩的一氯代物有_______ 种。
Ⅰ.根据物质结构和性质的知识,回答下列问题:
(1)下列物质中既有极性键,又有非极性键的极性分子是_______。
A. | B. | C. | D.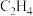 |
(2)
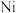 能与
能与 形成正四面体形的配合物
形成正四面体形的配合物 中含有
中含有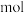
 键。
键。(3)
 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是(4)文献报道
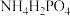 是制备
是制备 的原料。
的原料。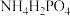 中,电负性最高的元素是
中,电负性最高的元素是(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。有机物
 中,有
中,有 该有机物含
该有机物含 键的个数为
键的个数为Ⅱ.现有十种有机物,请用所学知识回答下列问题:
① ;②
;②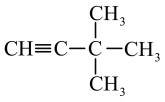 ;③
;③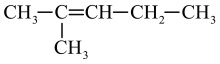 ;
;
④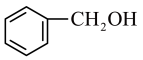 ;⑤
;⑤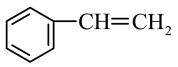 ;⑥
;⑥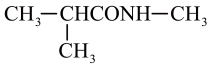 ;
;
⑦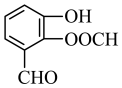 ;⑧
;⑧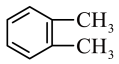 ;⑨
;⑨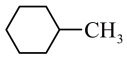 ;⑩
;⑩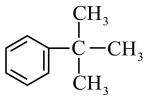
(7)⑧和⑩的关系为
(8)能使酸性高锰酸钾溶液褪色的烃有
(9)⑩的一氯代物有
您最近一年使用:0次
名校
9 . 能源的开发、利用与人类社会息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
(1)下列列举的能源中属于新能源的是_______ (填标号)。
a.煤炭 b.氢能 c.风能 d.地热能 e.太阳能 f.天然气
(2) 与
与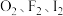 均能发生反应。
均能发生反应。
① 在
在 中燃烧生成水的过程中,能量转化的主要形式为
中燃烧生成水的过程中,能量转化的主要形式为_______ 转化为_______ 。
② 与
与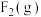 反应生成
反应生成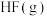 过程中的能量变化示意图如图1。
过程中的能量变化示意图如图1。 中的化学键需要
中的化学键需要_______ (填“吸收”或“放出”)的能量为_______  ;形成
;形成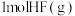 中的化学键需要
中的化学键需要_______ (填“吸收”或“放出”)的能量为_______  。
。
③ 与
与 反应生成
反应生成 过程中的能量变化示意图如图2。
过程中的能量变化示意图如图2。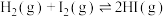 的正向反应为
的正向反应为_______ (填“吸热”或“放热”)反应;当反应 中有
中有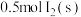 完全转化为
完全转化为 时,
时,_______ (填“吸收”或“放出”)的能量为_______  。
。
(1)下列列举的能源中属于新能源的是
a.煤炭 b.氢能 c.风能 d.地热能 e.太阳能 f.天然气
(2)
 与
与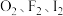 均能发生反应。
均能发生反应。①
 在
在 中燃烧生成水的过程中,能量转化的主要形式为
中燃烧生成水的过程中,能量转化的主要形式为②
 与
与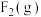 反应生成
反应生成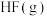 过程中的能量变化示意图如图1。
过程中的能量变化示意图如图1。
 中的化学键需要
中的化学键需要 ;形成
;形成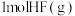 中的化学键需要
中的化学键需要 。
。③
 与
与 反应生成
反应生成 过程中的能量变化示意图如图2。
过程中的能量变化示意图如图2。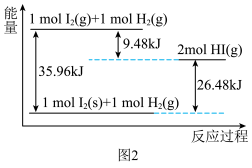
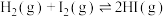 的正向反应为
的正向反应为 中有
中有 完全转化为
完全转化为 时,
时, 。
。
您最近一年使用:0次
10 . 如图为几种晶体或晶胞的结构示意图。
(1)CaCl2晶体属于___________ 晶体。
(2)微粒之间以共价键结合而形成晶体的是___________ (填写晶体名称)。
(3)冰、金刚石、MgO、碘单质四种晶体的熔点由高到低的顺序为___________ 。
(4)NaCl晶胞与MgO晶胞结构相同,而NaCl晶体的熔点小于MgO晶体的熔点,原因是___________ 。
(5)GaN是很好的半导体材料,晶体类型与金刚石晶体类似,晶胞结构如图1所示,已知六棱柱底边边长为acm。从GaN晶体中分割出的平行六面体如图2。若该平行六面体的体积为 a3cm3,GaN晶体的密度为
a3cm3,GaN晶体的密度为___________ g·cm-3(用a、NA表示,近似相对原子量:Ga70;N14)

(1)CaCl2晶体属于
(2)微粒之间以共价键结合而形成晶体的是
(3)冰、金刚石、MgO、碘单质四种晶体的熔点由高到低的顺序为
(4)NaCl晶胞与MgO晶胞结构相同,而NaCl晶体的熔点小于MgO晶体的熔点,原因是
(5)GaN是很好的半导体材料,晶体类型与金刚石晶体类似,晶胞结构如图1所示,已知六棱柱底边边长为acm。从GaN晶体中分割出的平行六面体如图2。若该平行六面体的体积为
 a3cm3,GaN晶体的密度为
a3cm3,GaN晶体的密度为
您最近一年使用:0次



