1 . N、S元素化合物知识在高中化学体系中占有重要地位,请根据题意回答下列问题。
(1)工业制硝酸中NH3的催化氧化化学方程式_______ 。
(2)检验溶液中含有NH4+的离子方程式_______ ,实验室一般使用_______ 检验该反应有氨气生成。
(3)向蔗糖中滴加浓硫酸,蔗糖变黑并膨胀,散发刺激性气味,说明浓硫酸具有_______ 和_______ 。(填浓硫酸的性质)
(4)铜与浓硫酸的化学反应方程式为_______ 。
(5)请用方程式解释实验室盛放碱液的试剂瓶不用玻璃塞的原因_______ 。
(1)工业制硝酸中NH3的催化氧化化学方程式
(2)检验溶液中含有NH4+的离子方程式
(3)向蔗糖中滴加浓硫酸,蔗糖变黑并膨胀,散发刺激性气味,说明浓硫酸具有
(4)铜与浓硫酸的化学反应方程式为
(5)请用方程式解释实验室盛放碱液的试剂瓶不用玻璃塞的原因
您最近一年使用:0次
名校
2 . 铁及铁的化合物应用广泛。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___________ 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图___________ ,标出电极名称及电极材料、电解质溶液、电流方向,并写出正极反应式___________ ,负极反应式___________ 。
(3)高铁酸钾(K2FeO4)是一种理想的水处理剂,目前高铁电池的研制正在进行中。如图甲所示是高铁电池的模拟实验装置。
①该电池放电时正极产生Fe(OH)3,正极电极反应为___________ 。
②电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择___________ 作为电解质。
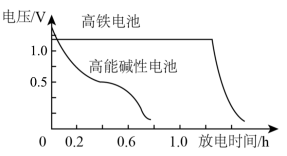
③图乙为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图
(3)高铁酸钾(K2FeO4)是一种理想的水处理剂,目前高铁电池的研制正在进行中。如图甲所示是高铁电池的模拟实验装置。

①该电池放电时正极产生Fe(OH)3,正极电极反应为
②电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择
| 阳离子 | 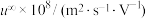 | 阴离子 | 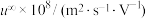 |
| Li+ | 4.07 |  | 4.61 |
| Na+ | 5.19 |  | 7.40 |
| K+ | 7.62 |  | 8.27 |
您最近一年使用:0次
名校
3 . 硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是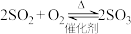 ,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。 的平均反应速率为
的平均反应速率为___________ 。
(2)图中a点,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(3)反应进行到第___________ 分钟时恰好达到平衡,此时 的转化率为
的转化率为___________ 。
(4)下列说法正确的是___________。
(5)硫酸厂产生的尾气中含有少量 。双碱法脱硫的原理示意图如下:
。双碱法脱硫的原理示意图如下:___________ ,过程I的离子方程式为___________ 。
②理论上,过程 中消耗1mol氧气时,过程I中吸收
中消耗1mol氧气时,过程I中吸收 的体积(标准状况)是
的体积(标准状况)是___________ L。
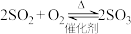 ,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
 的平均反应速率为
的平均反应速率为(2)图中a点,正反应速率
(3)反应进行到第
 的转化率为
的转化率为(4)下列说法正确的是___________。
A.反应过程中, 和 和 的转化率始终相等 的转化率始终相等 |
B.通过调控反应条件,可以实现 的完全转化 的完全转化 |
| C.其他条件不变,升高温度,正反应速率和逆反应速率均增大 |
| D.使用催化剂可以提高反应速率,提高生产效率 |
(5)硫酸厂产生的尾气中含有少量
 。双碱法脱硫的原理示意图如下:
。双碱法脱硫的原理示意图如下: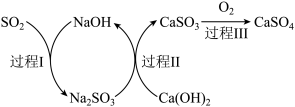
②理论上,过程
 中消耗1mol氧气时,过程I中吸收
中消耗1mol氧气时,过程I中吸收 的体积(标准状况)是
的体积(标准状况)是
您最近一年使用:0次
解题方法
4 . 某化合物W的分子结构可表示为
(2)W的一氯代物有
(3)下列有关W的说法错误的是___________;
| A.能发生氧化反应 | B.能发生加成反应 |
| C.能发生加聚反应 | D.等质量的W与苯分别完全燃烧所消耗的氧气量,前者大 |
(4)写出W的芳香族同分异构体的结构简式
(5)下列选项中互为同系物的是
 和
和
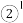 H、
H、 H、
H、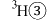


 与
与
 戊烯和环戊烷
戊烯和环戊烷

您最近一年使用:0次
名校
5 . 硫有多种化合物,如 、
、 等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(1)有学者提出利用 、
、 等离子的作用。在常温下将
等离子的作用。在常温下将 氧化成
氧化成 而实现
而实现 的回收利用,写出
的回收利用,写出 将
将 氧化成
氧化成 反应的离子方程式
反应的离子方程式___________ 。
(2)含有 、
、 的硫酸盐混合溶液可用于吸收
的硫酸盐混合溶液可用于吸收 回收硫单质,其转化关系如图所示。该图示中总反应的化学方程式为
回收硫单质,其转化关系如图所示。该图示中总反应的化学方程式为___________ ,其中催化剂是___________ 。 的烟气,以减少其对环境造成的污染。“
的烟气,以减少其对环境造成的污染。“ 吸收塔”中发生反应的化学方程式为
吸收塔”中发生反应的化学方程式为___________ ,该流程中可循环利用的物质为___________ (填化学式)。 的含量符合标准才能排放。已知有V L(已换算成标准状况)尾气,通入足量
的含量符合标准才能排放。已知有V L(已换算成标准状况)尾气,通入足量 溶液吸收再加入足量
溶液吸收再加入足量 溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到b g沉淀。
溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到b g沉淀。 溶液的作用是
溶液的作用是___________ ;尾气中 含量(体积分数)的计算式是
含量(体积分数)的计算式是___________ (用含V、b的代数式表示)。
 、
、 等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。(1)有学者提出利用
 、
、 等离子的作用。在常温下将
等离子的作用。在常温下将 氧化成
氧化成 而实现
而实现 的回收利用,写出
的回收利用,写出 将
将 氧化成
氧化成 反应的离子方程式
反应的离子方程式(2)含有
 、
、 的硫酸盐混合溶液可用于吸收
的硫酸盐混合溶液可用于吸收 回收硫单质,其转化关系如图所示。该图示中总反应的化学方程式为
回收硫单质,其转化关系如图所示。该图示中总反应的化学方程式为
 的烟气,以减少其对环境造成的污染。“
的烟气,以减少其对环境造成的污染。“ 吸收塔”中发生反应的化学方程式为
吸收塔”中发生反应的化学方程式为
 的含量符合标准才能排放。已知有V L(已换算成标准状况)尾气,通入足量
的含量符合标准才能排放。已知有V L(已换算成标准状况)尾气,通入足量 溶液吸收再加入足量
溶液吸收再加入足量 溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到b g沉淀。
溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到b g沉淀。 溶液的作用是
溶液的作用是 含量(体积分数)的计算式是
含量(体积分数)的计算式是
您最近一年使用:0次
解题方法
6 . 钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。
① 是助氧化剂,可处理产生的Na,其中氯元素的化合价是
是助氧化剂,可处理产生的Na,其中氯元素的化合价是___________ 。
② 是主氧化剂,也可处理产生的Na,反应为
是主氧化剂,也可处理产生的Na,反应为 ,反应中
,反应中 是
是___________ (填“还原产物”或“氧化产物”)。
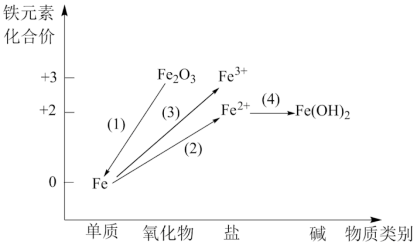
(2)铁及其重要化合物之间的部分转化关系如图所示。___________ (填序号);
a.金红石(TiO2) b.赤铁矿(Fe2O3) c.辉铜矿(Cu2S)
②实现Fe转化为Fe2+可选用足量的___________ (填序号);
a.稀盐酸 b.氢氧化钠溶液 c.稀硝酸
③在点燃的条件下,Fe与足量Cl2剧烈反应后,将产物溶于水,再滴加KSCN溶液,则溶液变为血红色,证明产物为FeCl3,写出氯气和铁反应的化学方程式为___________ 。
④在FeSO4中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为___________ ,此过程中发生的氧化还原反应为(用化学方程式表达)___________ 。
(1)某汽车安全气囊的产气药剂主要含有
 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。①
 是助氧化剂,可处理产生的Na,其中氯元素的化合价是
是助氧化剂,可处理产生的Na,其中氯元素的化合价是②
 是主氧化剂,也可处理产生的Na,反应为
是主氧化剂,也可处理产生的Na,反应为 ,反应中
,反应中 是
是(2)铁及其重要化合物之间的部分转化关系如图所示。
a.金红石(TiO2) b.赤铁矿(Fe2O3) c.辉铜矿(Cu2S)
②实现Fe转化为Fe2+可选用足量的
a.稀盐酸 b.氢氧化钠溶液 c.稀硝酸
③在点燃的条件下,Fe与足量Cl2剧烈反应后,将产物溶于水,再滴加KSCN溶液,则溶液变为血红色,证明产物为FeCl3,写出氯气和铁反应的化学方程式为
④在FeSO4中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
您最近一年使用:0次
名校
解题方法
7 . 硫、硒、碲的化合物在农药、石油工业、矿物开采、萃取及有机合成等领域的应用广泛。回答下列问题:
(1)基态Se原子的价层电子排布式为___________ 。
(2)下列有关氧族元素单质及其化合物的性质说法正确的是___________。
(3)类卤素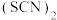 分子结构式为
分子结构式为___________ ,1mol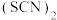 中含有π键的数目为
中含有π键的数目为___________ ,HSCN结构有两种,已知硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸( ),其原因是
),其原因是___________ 。
(4)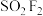 分子结构如图所示,已知键角
分子结构如图所示,已知键角 为124°,
为124°, 为96°,则
为96°,则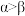 的原因主要是
的原因主要是___________ 。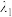
___________  (填“>”或“<”或“=”),其原因是
(填“>”或“<”或“=”),其原因是___________ 。
(1)基态Se原子的价层电子排布式为
(2)下列有关氧族元素单质及其化合物的性质说法正确的是___________。
A.氧族元素气态氢化物的稳定性按 、 、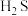 、 、 、 、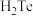 的顺序依次减弱 的顺序依次减弱 |
| B.其氢化物中的键长按O―H、S―H、Se―H、Te―H的顺序依次减小 |
C.其阴离子的还原性按 、 、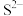 、 、 、 、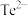 的顺序依次增强 的顺序依次增强 |
D.其最高价氧化物的水化物酸性按 、 、 、 、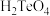 顺序依次增强 顺序依次增强 |
(3)类卤素
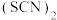 分子结构式为
分子结构式为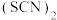 中含有π键的数目为
中含有π键的数目为 )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸( ),其原因是
),其原因是(4)
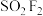 分子结构如图所示,已知键角
分子结构如图所示,已知键角 为124°,
为124°, 为96°,则
为96°,则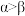 的原因主要是
的原因主要是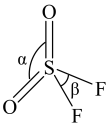
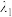
 (填“>”或“<”或“=”),其原因是
(填“>”或“<”或“=”),其原因是
您最近一年使用:0次
8 . 回答下列问题
(1)0.5molCO2的质量是___________ g;分子数为___________ 。在标准状况下,体积为___________ 。
(2)0.5molNa2SO4含有___________ molSO ,含
,含___________ molO,含___________ 个O,Na2SO4摩尔质量为___________ 。
(1)0.5molCO2的质量是
(2)0.5molNa2SO4含有
 ,含
,含
您最近一年使用:0次
名校
解题方法
9 . 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钴、钙等多种化学物质。请回答下列问题:
(1)科学家常利用仪器进行___________ 实验来区分晶体硼和无定形硼,二者之间的关系互为___________ 。第二周期元素的第一电离能按由小到大的顺序排列,B元素排在第___________ 位,其基态能量最高的能级电子云轮廓图为___________ 形。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为___________ ,Si原子的杂化类型为___________ 。 的几何构型为正八面体形,Co在中心。
的几何构型为正八面体形,Co在中心。 中,1个Co提供
中,1个Co提供___________ 个空轨道。该配位离子的作用力为___________ (填序号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
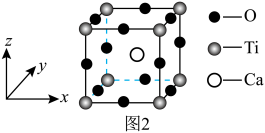
(4)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。与Ti紧邻的Ca有___________ 个。晶胞中Ca原子坐标参数为___________ 。
(1)科学家常利用仪器进行
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为

 的几何构型为正八面体形,Co在中心。
的几何构型为正八面体形,Co在中心。 中,1个Co提供
中,1个Co提供A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
(4)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。与Ti紧邻的Ca有
您最近一年使用:0次
名校
解题方法
10 . 下表是某些短周期元素的电负性(x)值:
(1)根据上表试推测,元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为___________ 。
(2)已知: 。
。
①若 最初水解产物是
最初水解产物是 和HClO,根据
和HClO,根据 的化合价推测
的化合价推测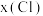 的范围是
的范围是___________ (填表中数值);
② 水解的化学反应方程式是
水解的化学反应方程式是___________ 。
(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析, 属于
属于___________ (填“离子化合物”或“共价化合物”),可设计实验证明,如测定___________ 。
| 元素符号 | Li | Be | N | O | F | Na | Mg | Al | P | S |
| x值 | 1.0 | 1.5 | 3.0 | a | 4.0 | 0.9 | 1.2 | 1.5 | 2.1 | 2.5 |
(2)已知:
 。
。①若
 最初水解产物是
最初水解产物是 和HClO,根据
和HClO,根据 的化合价推测
的化合价推测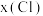 的范围是
的范围是②
 水解的化学反应方程式是
水解的化学反应方程式是(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析,
 属于
属于
您最近一年使用:0次



