1 . 能量以多种不同的形式存在,并能相互转化。
Ⅰ.合成氨反应在化工生产中具有重要意义。
(1)氮元素在周期表的位置为_______ ,氨气的电子式为_______ 。
(2)合成氨反应为放热反应,下列图示表示的过程也为放热反应的是_______ 。(填字母) ,放出
,放出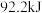 热量,已知断开
热量,已知断开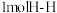 键、
键、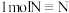 键分别需要吸收的能量为
键分别需要吸收的能量为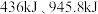 ,则
,则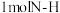 键断裂吸收的能量为
键断裂吸收的能量为______  (保留到小数点后一位)。
(保留到小数点后一位)。
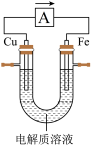
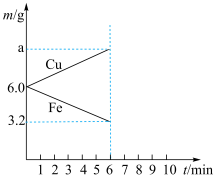
Ⅱ.电池的发明是储能和供能技术的巨大进步,如图所示的原电池装置,插入电解质溶液前 和
和 电极质量相等。
电极质量相等。
(4)电解质为稀盐酸时,图中箭头的方向表示_______ (填“电子”或“电流”)的流向,铁棒上的电极反应式为_______ 。_______ 。
A.稀硫酸 B. 溶液 C.浓硝酸 D.
溶液 C.浓硝酸 D. 溶液
溶液
② 时
时 电极的质量a为
电极的质量a为_______ g。
Ⅰ.合成氨反应在化工生产中具有重要意义。
(1)氮元素在周期表的位置为
(2)合成氨反应为放热反应,下列图示表示的过程也为放热反应的是
a.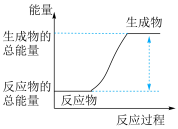 b.
b.  c.
c.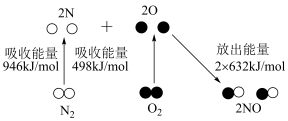
 ,放出
,放出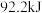 热量,已知断开
热量,已知断开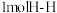 键、
键、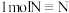 键分别需要吸收的能量为
键分别需要吸收的能量为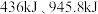 ,则
,则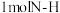 键断裂吸收的能量为
键断裂吸收的能量为 (保留到小数点后一位)。
(保留到小数点后一位)。Ⅱ.电池的发明是储能和供能技术的巨大进步,如图所示的原电池装置,插入电解质溶液前
 和
和 电极质量相等。
电极质量相等。(4)电解质为稀盐酸时,图中箭头的方向表示
A.稀硫酸 B.
 溶液 C.浓硝酸 D.
溶液 C.浓硝酸 D. 溶液
溶液②
 时
时 电极的质量a为
电极的质量a为
您最近一年使用:0次
解题方法
2 . 一定温度下,在 的密闭容器中,
的密闭容器中, 两种气体的物质的量随时间变化的曲线如图所示:
两种气体的物质的量随时间变化的曲线如图所示:_______ 。
(2)反应达到最大限度的时间是______  ,该时间内的平均反应速率
,该时间内的平均反应速率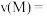
______ 。
(3)判断该反应达到平衡状态的依据是_______。
(4)能加快反应速率的措施是_______。
(5)反应进行到4min时,N的转化率为_______ 。
 的密闭容器中,
的密闭容器中, 两种气体的物质的量随时间变化的曲线如图所示:
两种气体的物质的量随时间变化的曲线如图所示: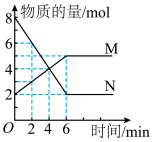
(2)反应达到最大限度的时间是
 ,该时间内的平均反应速率
,该时间内的平均反应速率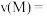
(3)判断该反应达到平衡状态的依据是_______。
| A.该条件下,正、逆反应速率都为零 |
| B.该条件下,混合气体的密度不再发生变化 |
| C.该条件下,混合气体的压强不再发生变化 |
D.该条件下,单位时间内消耗 的同时,消耗 的同时,消耗 |
(4)能加快反应速率的措施是_______。
| A.升高温度 |
B.容器容积不变,充入惰性气体 |
C.容器压强不变,充入惰性气体 |
| D.使用催化剂 |
(5)反应进行到4min时,N的转化率为
您最近一年使用:0次
名校
解题方法
3 . 碳是一种非常神奇的元素,它有着像 、石墨和金刚石等这样结构和性质截然不同的单质,如下图所示,碳还是构成有机物的基本元素。请回答下列问题:
、石墨和金刚石等这样结构和性质截然不同的单质,如下图所示,碳还是构成有机物的基本元素。请回答下列问题: 、碳纳米管等都是碳元素的单质形式,它们互为
、碳纳米管等都是碳元素的单质形式,它们互为___________ 。
(2)石墨属于___________ 晶体,24g的石墨中含有共价键的数目为___________ 。
(3)金刚石中碳原子数目与C-C键数目之比为___________ 。
(4)青蒿素是从植物青蒿中提取的有机物,用于抗疟疾的药物。分子结构如图所示,则青蒿素分子中含有___________ 个手性碳原子。
 、石墨和金刚石等这样结构和性质截然不同的单质,如下图所示,碳还是构成有机物的基本元素。请回答下列问题:
、石墨和金刚石等这样结构和性质截然不同的单质,如下图所示,碳还是构成有机物的基本元素。请回答下列问题: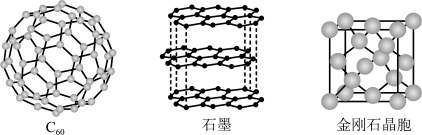
 、碳纳米管等都是碳元素的单质形式,它们互为
、碳纳米管等都是碳元素的单质形式,它们互为(2)石墨属于
(3)金刚石中碳原子数目与C-C键数目之比为
(4)青蒿素是从植物青蒿中提取的有机物,用于抗疟疾的药物。分子结构如图所示,则青蒿素分子中含有
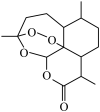
您最近一年使用:0次
4 . 配位化学的应用十分广泛,在经济、生产、生活等方面都有重要作用
(1) 在水溶液中以配离子
在水溶液中以配离子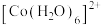 存在,在
存在,在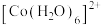 中配体是
中配体是______ ,配位原子是______ ;向含Co²⁺的水溶液中加入过量氨水可生成更稳定的 ,其原因是
,其原因是______ 。
(2)在碱性溶液中, 可以与缩二脲形成紫色配离子,其结构如图所示。
可以与缩二脲形成紫色配离子,其结构如图所示。
(3)实验测得 蒸气以双聚分子(
蒸气以双聚分子(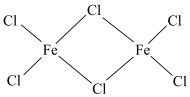 )的形式存在,其中所含化学键类型有
)的形式存在,其中所含化学键类型有______ (填字母)。
a.共价键 b.离子键 c.配位键
(4)在配合物中部分分子或离子与中心离子较紧密地结合在一起,组成在溶液中能够稳定存在的整体,称为“内界”{书写时用“[ ]”与外界分离}。与中心离子结合不够紧密的离子则处于“外界”。内界和外界不同,物质的性质也不同,如 与
与 形成的三种配合物A、B、C,
形成的三种配合物A、B、C, 的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:______ ;B:______
(1)
 在水溶液中以配离子
在水溶液中以配离子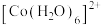 存在,在
存在,在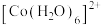 中配体是
中配体是 ,其原因是
,其原因是(2)在碱性溶液中,
 可以与缩二脲形成紫色配离子,其结构如图所示。
可以与缩二脲形成紫色配离子,其结构如图所示。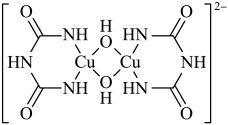
| A.该配离子与水分子可以形成氢键 |
| B.该配离子中铜离子的配位数是2 |
C.该配离子中 原子的杂化方式均是 原子的杂化方式均是 |
D.该配离子中非金属元素的电负性大小顺序为 |
(3)实验测得
 蒸气以双聚分子(
蒸气以双聚分子( )的形式存在,其中所含化学键类型有
)的形式存在,其中所含化学键类型有a.共价键 b.离子键 c.配位键
(4)在配合物中部分分子或离子与中心离子较紧密地结合在一起,组成在溶液中能够稳定存在的整体,称为“内界”{书写时用“[ ]”与外界分离}。与中心离子结合不够紧密的离子则处于“外界”。内界和外界不同,物质的性质也不同,如
 与
与 形成的三种配合物A、B、C,
形成的三种配合物A、B、C, 的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
您最近一年使用:0次
解题方法
5 . 硅及其化合物在工业中有很多用处,一些硅的卤化物的熔点如表所示:
完成下列填空:
(1)硅原子核外电子共有______ 种形状不同的电子云,画出基态硅原子最外层电子的轨道表示式______ 。
(2)表中四种卤化物分子的空间结构均为______ ,由此推断 的键角为
的键角为______ , 属于
属于______ (填“极性”或“非极性”)分子。
(3)已知 (熔点为-56.6℃)和
(熔点为-56.6℃)和 (熔点为1713℃)熔点相差较大;原因是
(熔点为1713℃)熔点相差较大;原因是______ ,表中四种卤化硅熔点存在差异的原因是______ 。
完成下列填空:
卤化物 |
|
|
|
|
熔点/℃ | -90.2 | 70.4 | 5.2 | 120.5 |
(1)硅原子核外电子共有
(2)表中四种卤化物分子的空间结构均为
 的键角为
的键角为 属于
属于(3)已知
 (熔点为-56.6℃)和
(熔点为-56.6℃)和 (熔点为1713℃)熔点相差较大;原因是
(熔点为1713℃)熔点相差较大;原因是
您最近一年使用:0次
解题方法
6 . 已知W、X、Y、Z、N是周期表中前四周期元素,它们的核电荷数依次增大。
回答下列问题:
(1)写出X的元素符号:X______ 。
(2)基态Y原子价电子的电子排布式:______ 。
(3)W、X、Z三种元素的电负性由大到小的顺序是______ (填元素符号)。
(4) 和
和 的熔点更高的是
的熔点更高的是______ (填化学式),原因是:______ 。
(5)根据价层电子对互斥理论, 的空间构型为
的空间构型为______ , 中心原子的杂化方式为
中心原子的杂化方式为______ , 和
和 中键角较小的是
中键角较小的是______ (用离子符号表示)。
元素 | 元素性质或原子结构或离子结构 |
W | 原子核内无中子 |
X | 基态原子核外s能级上的电子总数与p能级上的电子总数相等 |
Y | 元素的原子半径在同周期中最大 |
Z | 基态原子核外有9种不同空间运动状态的电子,且有两个未成对电子 |
N |
|
(1)写出X的元素符号:X
(2)基态Y原子价电子的电子排布式:
(3)W、X、Z三种元素的电负性由大到小的顺序是
(4)
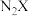 和
和 的熔点更高的是
的熔点更高的是(5)根据价层电子对互斥理论,
 的空间构型为
的空间构型为 中心原子的杂化方式为
中心原子的杂化方式为 和
和 中键角较小的是
中键角较小的是
您最近一年使用:0次
7 . 完成下列问题。
(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式_______ 。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol/L的NaOH溶液,试管中溶液呈____ 色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈_______ 色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡_______ (填“向左移动”或“向右移动”),溶液颜色将_______ 。
(2)现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向_______ 反应方向移动,正反应为_______ (填“吸热”或“放热”)反应,平衡时B、C的浓度之比 将
将_______ 。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向_______ 反应方向移动,A的质量分数_______ ,且m+n_______ p(填“>”或“<”)。
③若容积不变加入B,则B的转化率_______ ,A的转化率_______ 。
(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol/L的NaOH溶液,试管中溶液呈
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡
(2)现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向
 将
将②减小压强时平衡向
③若容积不变加入B,则B的转化率
您最近一年使用:0次
8 . 盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
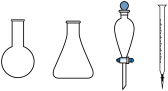
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示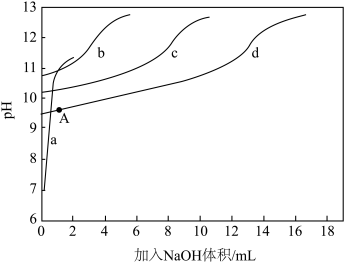
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
您最近一年使用:0次
名校
9 . 基于所学内容回答问题
(1)基态铜原子的价电子排布式为_______ ;As原子的价电子排布图为_______ 。
(2)联氨(N2H4)也叫肼,常用于火箭推进剂。N2H4_______ (填“难”或“易”)溶于水,原因是_______ 。
(3)①钛在元素周期表中的位置是_______ 。
②原子中运动的电子有两种相反的自旋状态,若一种自旋状态用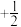 表示,与之相反的则用
表示,与之相反的则用 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为____ 。
③离子半径Ca2+>Ti4+,理由是_______ 。
(1)基态铜原子的价电子排布式为
(2)联氨(N2H4)也叫肼,常用于火箭推进剂。N2H4
(3)①钛在元素周期表中的位置是
②原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
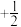 表示,与之相反的则用
表示,与之相反的则用 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为③离子半径Ca2+>Ti4+,理由是
您最近一年使用:0次
名校
10 . 依据物质结构知识,回答下列问题。
I.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为_______ 。
(2)根据价层电子对互斥理论,可以推知 白的空间构型为
白的空间构型为_______ ,其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为_______ 。
Ⅱ.H、C、N、O、S、Cl是非常重要的非金属元素,广泛存在于自然界。回答下列问题:
(3)H、C、N三种元素的电负性从小到大的顺序为_______ 。
(4)硫单质的一种结构为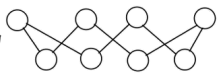 ,该物质
,该物质_______ (填“可溶”或“难溶”)于水。
(5)沸点:
_______ 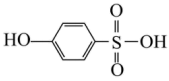 (填“>”或“<”),原因:
(填“>”或“<”),原因:_______ 。
I.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为
(2)根据价层电子对互斥理论,可以推知
 白的空间构型为
白的空间构型为 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为Ⅱ.H、C、N、O、S、Cl是非常重要的非金属元素,广泛存在于自然界。回答下列问题:
(3)H、C、N三种元素的电负性从小到大的顺序为
(4)硫单质的一种结构为
 ,该物质
,该物质(5)沸点:

 (填“>”或“<”),原因:
(填“>”或“<”),原因:
您最近一年使用:0次




 的M层全充满
的M层全充满

