解题方法
1 . 元素周期律和元素周期表,反映了元素性质与原子结构的关系,在自然科学、生产实践等各方面都有重要意义。下图为部分短周期元素化合价与原子序数的关系图。_______ 。
(2)f在半导体领域中有着重要应用,其原子结构示意图为_______ 。
(3)h、g的气态氢化物稳定性由强到弱的顺序为_______ (填化学式)。
(4)c、d、e简单离子的半径从大到小为_______ (用化学式表示)。
(5)c与d形成的淡黄色化合物的电子式为_______ 。
(6)X射线衍射法可以测定某些分子的结构,下列分子的结构模型正确是_______(填字母)。
(7)a、h的最高价氧化物的水化物酸性由强到弱的顺序为_______ (填化学式)。
(8)写出一条仅含a、b、c元素的氧化还原反应方程式_______ 。

(2)f在半导体领域中有着重要应用,其原子结构示意图为
(3)h、g的气态氢化物稳定性由强到弱的顺序为
(4)c、d、e简单离子的半径从大到小为
(5)c与d形成的淡黄色化合物的电子式为
(6)X射线衍射法可以测定某些分子的结构,下列分子的结构模型正确是_______(填字母)。
| 选项 | A | B | C | D |
| 分子 |  |  |  |  |
| 结构 模型 | 直线形
| 直线形
| 直线形
| 平面正方形
|
| A.A | B.B | C.C | D.D |
(7)a、h的最高价氧化物的水化物酸性由强到弱的顺序为
(8)写出一条仅含a、b、c元素的氧化还原反应方程式
您最近一年使用:0次
2 . 某实验小组用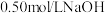 溶液和
溶液和 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。
I.配制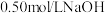 溶液
溶液
(1)从图中选择称量 固体所需要的仪器是(填字母):
固体所需要的仪器是(填字母):_______ 。
Ⅱ.中和热的测定:
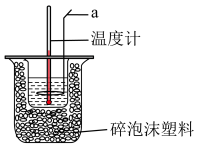
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。_______ 。
(3)取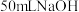 溶液和
溶液和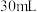 硫酸溶液进行实验,实验数据如表。
硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
②通过上述实验测得中和热数值为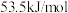 与
与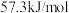 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.配制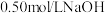 溶液时俯视刻度线读数
溶液时俯视刻度线读数
d.用温度计测定 溶液起始温度后直接测定硫酸溶液的温度
溶液起始温度后直接测定硫酸溶液的温度
e.用量筒量取 溶液的体积时仰视读数
溶液的体积时仰视读数
(4)实验中改用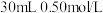 的硫酸跟
的硫酸跟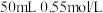 的
的 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”或“不相等”),所求中和热的数值会_______ (填“相等”或“不相等”)。
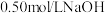 溶液和
溶液和 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。I.配制
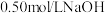 溶液
溶液(1)从图中选择称量
 固体所需要的仪器是(填字母):
固体所需要的仪器是(填字母):名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(3)取
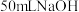 溶液和
溶液和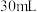 硫酸溶液进行实验,实验数据如表。
硫酸溶液进行实验,实验数据如表。①请填写表中的空白:
温度 实验次数 | 起始温度 | 终止温度 | 温度差平均值 | ||
|
| 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
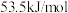 与
与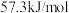 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是a.实验装置保温、隔热效果差
b.配制
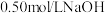 溶液时俯视刻度线读数
溶液时俯视刻度线读数d.用温度计测定
 溶液起始温度后直接测定硫酸溶液的温度
溶液起始温度后直接测定硫酸溶液的温度e.用量筒量取
 溶液的体积时仰视读数
溶液的体积时仰视读数(4)实验中改用
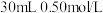 的硫酸跟
的硫酸跟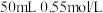 的
的 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
3 . 回答下列问题。
(1)在 时,
时, 硫粉在氧气中完全燃烧生成二氧化硫,放出
硫粉在氧气中完全燃烧生成二氧化硫,放出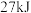 的热量,硫燃烧的热化学方程式为
的热量,硫燃烧的热化学方程式为_______ 。
(2)在 时,氢气在
时,氢气在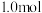 氧气中完全燃烧,生成
氧气中完全燃烧,生成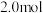 液态水,放出
液态水,放出 的热量,则氢气的燃烧热为
的热量,则氢气的燃烧热为_______  。
。
(3)在反应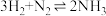 中,经一段时间后,氨的浓度增加了
中,经一段时间后,氨的浓度增加了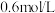 ,在此时间内用
,在此时间内用 表示的平均反应速率为
表示的平均反应速率为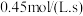 ,则反应所经过的时间为
,则反应所经过的时间为_______ 。
(1)在
 时,
时, 硫粉在氧气中完全燃烧生成二氧化硫,放出
硫粉在氧气中完全燃烧生成二氧化硫,放出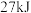 的热量,硫燃烧的热化学方程式为
的热量,硫燃烧的热化学方程式为(2)在
 时,氢气在
时,氢气在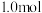 氧气中完全燃烧,生成
氧气中完全燃烧,生成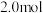 液态水,放出
液态水,放出 的热量,则氢气的燃烧热为
的热量,则氢气的燃烧热为 。
。(3)在反应
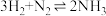 中,经一段时间后,氨的浓度增加了
中,经一段时间后,氨的浓度增加了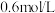 ,在此时间内用
,在此时间内用 表示的平均反应速率为
表示的平均反应速率为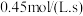 ,则反应所经过的时间为
,则反应所经过的时间为
您最近一年使用:0次
解题方法
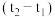
4 . 一定温度下,体积为2L的密闭容器中装有4molSO2和2molO2,发生反应 ,2min末达到平衡测得容器中有1.6molSO2,请列出三段式计算:该温度下的平衡常数为K=
,2min末达到平衡测得容器中有1.6molSO2,请列出三段式计算:该温度下的平衡常数为K=___________ L·mol-1。(计算结果)
 ,2min末达到平衡测得容器中有1.6molSO2,请列出三段式计算:该温度下的平衡常数为K=
,2min末达到平衡测得容器中有1.6molSO2,请列出三段式计算:该温度下的平衡常数为K=
您最近一年使用:0次
2024-08-20更新
|
233次组卷
|
3卷引用:广东省东莞市翰林高级中学与翰林实验学校2023-2024学年高二下学期期中考试化学试题(澳台班)
5 . 用标准 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均约为
、浓度均约为 的盐酸和醋酸溶液,得到溶液
的盐酸和醋酸溶液,得到溶液 随加入
随加入 溶液体积变化的两条滴定曲线,如下图所示。
溶液体积变化的两条滴定曲线,如下图所示。 标准
标准 溶液,需用到的玻璃仪器有___________(填选项字母)。
溶液,需用到的玻璃仪器有___________(填选项字母)。
(2)滴定管在使用前,应进行的操作是___________ 。
(3)滴定开始前, 、盐酸和醋酸三种溶液中,水的电离程度最大的是
、盐酸和醋酸三种溶液中,水的电离程度最大的是___________ 。
(4) 溶液滴定醋酸的曲线是
溶液滴定醋酸的曲线是___________ (填“I”或“Ⅱ”),该过程中应选用___________ 作为指示剂。
(5)滴定接近终点时,用蒸馏水冲洗锥形瓶内壁,测得待测液浓度___________ (填“偏大”“偏小”或“准确”)。
(6)结合滴定曲线判断,加入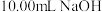 溶液时,混合液中
溶液时,混合液中
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均约为
、浓度均约为 的盐酸和醋酸溶液,得到溶液
的盐酸和醋酸溶液,得到溶液 随加入
随加入 溶液体积变化的两条滴定曲线,如下图所示。
溶液体积变化的两条滴定曲线,如下图所示。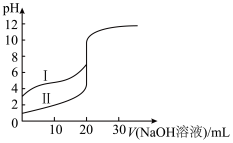
 标准
标准 溶液,需用到的玻璃仪器有___________(填选项字母)。
溶液,需用到的玻璃仪器有___________(填选项字母)。A. 容量瓶 容量瓶 | B.烧杯 | C.圆底烧瓶 | D.分液漏斗 |
(2)滴定管在使用前,应进行的操作是
(3)滴定开始前,
 、盐酸和醋酸三种溶液中,水的电离程度最大的是
、盐酸和醋酸三种溶液中,水的电离程度最大的是(4)
 溶液滴定醋酸的曲线是
溶液滴定醋酸的曲线是(5)滴定接近终点时,用蒸馏水冲洗锥形瓶内壁,测得待测液浓度
(6)结合滴定曲线判断,加入
 溶液时,混合液中
溶液时,混合液中
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2024-08-19更新
|
150次组卷
|
2卷引用:广东省东莞市2023-2024学年高二下学期7月期末教学质量检查化学试题
解题方法
6 . 回答下列问题:
(1)0.1 mol/L HCl溶液和0.05 mol/L H2SO4溶液等体积混合,pH=___________ 。
(2)在25℃下,将pH=3的强酸溶液和pH=12强碱溶液混合,当混合溶液的pH=11时,强酸溶液和强碱溶液的体积比是___________ 。
(3)某温度(t℃) 时,测得0.01 mol/L的NaOH溶液的pH=11,则该温度下水的Kw=___________ 。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
①若所得混合液为中性,且a=12,b=2,则Va:Vb=___________ 。
②若所得混合液为中性,且a+b=12,则Va:Vb=___________ 。
③若所得混合液的pH=10,且a=12,b=2,则Va:Vb=___________ 。
(4) 水溶液呈酸性的原因是
水溶液呈酸性的原因是 的水解程度
的水解程度___________ 电离程度(填大于或小于)。
(5)相同温度下,相同物质的量浓度的下列溶液:① 、②
、② 、③
、③ 、④
、④ ⑤
⑤ 、⑥
、⑥ 按
按 由大到小的排列为:
由大到小的排列为:___________ (填序号)。
(1)0.1 mol/L HCl溶液和0.05 mol/L H2SO4溶液等体积混合,pH=
(2)在25℃下,将pH=3的强酸溶液和pH=12强碱溶液混合,当混合溶液的pH=11时,强酸溶液和强碱溶液的体积比是
(3)某温度(t℃) 时,测得0.01 mol/L的NaOH溶液的pH=11,则该温度下水的Kw=
①若所得混合液为中性,且a=12,b=2,则Va:Vb=
②若所得混合液为中性,且a+b=12,则Va:Vb=
③若所得混合液的pH=10,且a=12,b=2,则Va:Vb=
(4)
 水溶液呈酸性的原因是
水溶液呈酸性的原因是 的水解程度
的水解程度(5)相同温度下,相同物质的量浓度的下列溶液:①
 、②
、② 、③
、③ 、④
、④ ⑤
⑤ 、⑥
、⑥ 按
按 由大到小的排列为:
由大到小的排列为:
您最近一年使用:0次
2024-08-19更新
|
459次组卷
|
2卷引用:广东省东莞市翰林高级中学与翰林实验学校2023-2024学年高二下学期期中考试化学试题(澳台班)
7 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2常用作净水剂,请用离子方程式解释___________ 。
(2)相同条件下,0.1mol·L-1NH4Al(SO4)2溶液中c( )
)___________ (填“等于”、“大于”或“小于”)0.1mol·L-1NH4HSO4溶液中c( )。
)。
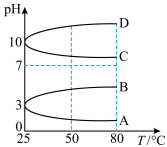
(3)如图是0.1mol·L-1电解质溶液的pH随温度变化的图象。___________ (填字母),25℃时,该溶液中由水电离的c(H+)=___________ mol·L-1。
②25℃时,0.1mol·L-1NH4Al(SO4)2溶液中2c( )-c(
)-c( )-3c(Al3+)=
)-3c(Al3+)=___________ mol·L-1(列计算式,不必化简)。
(4)25℃时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。___________ (填“a”、“b”、“c”或“d”)点;在b点,溶液中 、Na+、
、Na+、 浓度由大到小的排列顺序是
浓度由大到小的排列顺序是___________ 。
(1)NH4Al(SO4)2常用作净水剂,请用离子方程式解释
(2)相同条件下,0.1mol·L-1NH4Al(SO4)2溶液中c(
 )
) )。
)。(3)如图是0.1mol·L-1电解质溶液的pH随温度变化的图象。
②25℃时,0.1mol·L-1NH4Al(SO4)2溶液中2c(
 )-c(
)-c( )-3c(Al3+)=
)-3c(Al3+)=(4)25℃时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
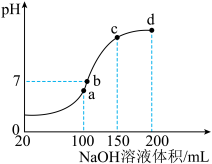
 、Na+、
、Na+、 浓度由大到小的排列顺序是
浓度由大到小的排列顺序是
您最近一年使用:0次
8 . I.回答下列问题。
(1)汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,其中生成NO的能量变化如左下图所示,图中对应反应的热化学方程式为
等污染大气,其中生成NO的能量变化如左下图所示,图中对应反应的热化学方程式为___________ 。 与CO反应转化为
与CO反应转化为 和NO过程中的能量变化示意图,该反应的活化能为
和NO过程中的能量变化示意图,该反应的活化能为___________ kJ/mol。根据图分析,若该反应是可逆反应,在相同条件下将0.5molCO与1mol 混合,则充分反应后放出的热量
混合,则充分反应后放出的热量___________ (填“>”“<”或“=”)117kJ。
(3)热量的测定:取 NaOH和
NaOH和 盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为
盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为 、
、 ,则该过程放出的热量为
,则该过程放出的热量为___________ J (c和 分别取
分别取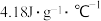 和
和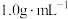 ,忽略水以外各物质吸收的热量,下同)。
,忽略水以外各物质吸收的热量,下同)。
(4)甲同学测量放热反应 的焓变
的焓变 (忽略温度对焓变的影响,下同)。实验结果见下表。
(忽略温度对焓变的影响,下同)。实验结果见下表。
①温度:b___________ c(填“>”“<”或“=”)。
②
___________ (选择表中一组数据计算)。结果表明,该方法可行。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用___________ 。
(1)汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,其中生成NO的能量变化如左下图所示,图中对应反应的热化学方程式为
等污染大气,其中生成NO的能量变化如左下图所示,图中对应反应的热化学方程式为
 与CO反应转化为
与CO反应转化为 和NO过程中的能量变化示意图,该反应的活化能为
和NO过程中的能量变化示意图,该反应的活化能为 混合,则充分反应后放出的热量
混合,则充分反应后放出的热量
(3)热量的测定:取
 NaOH和
NaOH和 盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为
盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为 、
、 ,则该过程放出的热量为
,则该过程放出的热量为 分别取
分别取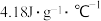 和
和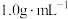 ,忽略水以外各物质吸收的热量,下同)。
,忽略水以外各物质吸收的热量,下同)。(4)甲同学测量放热反应
 的焓变
的焓变 (忽略温度对焓变的影响,下同)。实验结果见下表。
(忽略温度对焓变的影响,下同)。实验结果见下表。| 序号 | 反应试剂 | 体系温度/℃ | ||
| 反应前 | 反应后 | |||
| i | 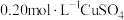 溶液100mL 溶液100mL | 1.20gFe粉 | a | b |
| ii | 0.56gFe粉 | a | c | |
②

(5)化学能可转化为热能,写出其在生产或生活中的一种应用
您最近一年使用:0次
解题方法
9 . 按要求完成下题。
(1)写出H2S的电离方程式:___________ 。
(2)0.1mol/LNH4Cl溶液中各离子浓度大小顺序为___________ 。
(3)pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液显___________ 性。
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___________ 。
(5)常温时的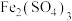 的水溶液
的水溶液
___________ 7(填“>”、“=”、“<”)。原因是___________ (用离子方程式表示)。配制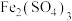 的溶液时,常在溶液中加入一些
的溶液时,常在溶液中加入一些___________ 以抑制其水解。
(6)常温下,pH=10的CH3COONa溶液中,由水电离出的c(OH-)=___________ mol/L。
(7)常温下,0.05mol/LH2SO4溶液的pH=___________ 。
(1)写出H2S的电离方程式:
(2)0.1mol/LNH4Cl溶液中各离子浓度大小顺序为
(3)pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液显
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(5)常温时的
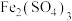 的水溶液
的水溶液
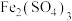 的溶液时,常在溶液中加入一些
的溶液时,常在溶液中加入一些(6)常温下,pH=10的CH3COONa溶液中,由水电离出的c(OH-)=
(7)常温下,0.05mol/LH2SO4溶液的pH=
您最近一年使用:0次
10 .  的资源化利用成为研究热点。一定条件下,
的资源化利用成为研究热点。一定条件下, 催化加氢发生的反应为
催化加氢发生的反应为 。一定条件下,向容积为
。一定条件下,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入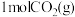 和
和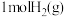 ,分别在温度为
,分别在温度为 、
、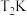 条件下反应,测得反应体系中
条件下反应,测得反应体系中 的物质的量分数随时间的变化关系如图所示。回答下列问题:
的物质的量分数随时间的变化关系如图所示。回答下列问题: 温度下,
温度下, 的平衡转化率
的平衡转化率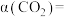
_______  。压缩平衡体系体积,平衡
。压缩平衡体系体积,平衡_______ (“正向移动”“不移动”或“逆向移动”)。若想进一步提高 的平衡转化率,除改变温度外还可以采取的措施是
的平衡转化率,除改变温度外还可以采取的措施是_______ 。
(2)在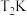 温度下,经
温度下,经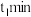 后反应达到平衡。
后反应达到平衡。
①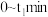 内,用
内,用 表示的反应速率
表示的反应速率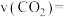
_______  。
。
②在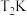 温度下,该反应的平衡常数
温度下,该反应的平衡常数
_______ (用分数表示)。
(3)下图中能正确表示反应 的化学平衡常数
的化学平衡常数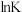 与温度T关系的是
与温度T关系的是_______ (填字母)。 在恒容容器中发生,下列情况下反应一定达到平衡状态的是_______(填字母)。
在恒容容器中发生,下列情况下反应一定达到平衡状态的是_______(填字母)。
 的资源化利用成为研究热点。一定条件下,
的资源化利用成为研究热点。一定条件下, 催化加氢发生的反应为
催化加氢发生的反应为 。一定条件下,向容积为
。一定条件下,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入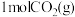 和
和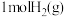 ,分别在温度为
,分别在温度为 、
、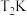 条件下反应,测得反应体系中
条件下反应,测得反应体系中 的物质的量分数随时间的变化关系如图所示。回答下列问题:
的物质的量分数随时间的变化关系如图所示。回答下列问题: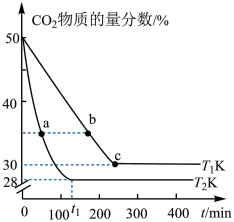
 温度下,
温度下, 的平衡转化率
的平衡转化率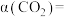
 。压缩平衡体系体积,平衡
。压缩平衡体系体积,平衡 的平衡转化率,除改变温度外还可以采取的措施是
的平衡转化率,除改变温度外还可以采取的措施是(2)在
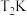 温度下,经
温度下,经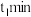 后反应达到平衡。
后反应达到平衡。①
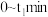 内,用
内,用 表示的反应速率
表示的反应速率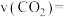
 。
。②在
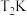 温度下,该反应的平衡常数
温度下,该反应的平衡常数
(3)下图中能正确表示反应
 的化学平衡常数
的化学平衡常数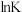 与温度T关系的是
与温度T关系的是a.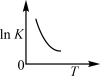 b.
b.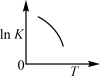 c.
c.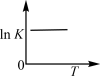 d.
d.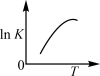
 在恒容容器中发生,下列情况下反应一定达到平衡状态的是_______(填字母)。
在恒容容器中发生,下列情况下反应一定达到平衡状态的是_______(填字母)。| A.容器内的压强不再改变 |
| B.容器内气体密度不再改变 |
C.容器内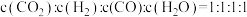 |
D.单位时间内,断开 键的数目和断开 键的数目和断开 键的数目相同 键的数目相同 |
您最近一年使用:0次








 /
/
 /
/ /
/


