1 . 维生素C(C6H8O6,M=176)具有重要生理调节功能,在酸性介质中较为稳定,在碱性溶液中易被空气氧化。维生素C通常用I2标准溶液进行滴定,反应原理是:C6H8O6+I2═C6H6O6+2H++2I﹣。回答下列问题:
(1)I2标准溶液的配制与标定
①配制:配制一定浓度的I2标准溶液。碘水见光易分解,配制好的I2标准溶液应保存在___________ 色试剂瓶中。
②标定:标定碘液的Na2S2O3溶液在酸性条件下不稳定,溶液容易出现浑浊,该反应的离子方程式为___________ ,因此配制时往往调溶液至碱性。用Na2S2O3标准溶液标定①中配制的I2标准溶液,计算得I2标准溶液浓度为0.05000mol•L﹣1。
(2)维生素C含量的测定
准确称取2.000g维生素C药片,磨成粉末,配制成250mL溶液,取25.00mL至锥形瓶,用I2标准溶液进行滴定,用淀粉作指示剂。
①维生素C很容易被氧气氧化,因此需往该待测液中加入___________ 来保存。
A.醋酸溶液 B.硝酸溶液 C.碳酸钠溶液 D.烧碱溶液
②确定时应选择___________ (填“酸式“或“碱式”)滴定管盛装I2标准溶液。滴定终点的现象是___________ 。
③维C含量的计算
实验过程中测得数据如表:
根据以上数据可得,该药片中维C的质量分数为___________ 。
(3)实际测得药片中维生素C含量比说明书中的含量更高,可能的原因是___________(填标号)。
(1)I2标准溶液的配制与标定
①配制:配制一定浓度的I2标准溶液。碘水见光易分解,配制好的I2标准溶液应保存在
②标定:标定碘液的Na2S2O3溶液在酸性条件下不稳定,溶液容易出现浑浊,该反应的离子方程式为
(2)维生素C含量的测定
准确称取2.000g维生素C药片,磨成粉末,配制成250mL溶液,取25.00mL至锥形瓶,用I2标准溶液进行滴定,用淀粉作指示剂。
①维生素C很容易被氧气氧化,因此需往该待测液中加入
A.醋酸溶液 B.硝酸溶液 C.碳酸钠溶液 D.烧碱溶液
②确定时应选择
③维C含量的计算
实验过程中测得数据如表:
| 编号 | 1 | 2 | 3 | 4 |
| V(I2标准溶液)/mL | 20.80 | 20.81 | 21.70 | 20.79 |
(3)实际测得药片中维生素C含量比说明书中的含量更高,可能的原因是___________(填标号)。
| A.盛I2标准溶液的酸式滴定管未进行润洗 |
| B.滴定过程中有少量锥形瓶内液体溅出 |
| C.滴定结束时仰视读数 |
| D.用I2标准溶液滴定时操作过慢 |
您最近一年使用:0次
名校
解题方法
2 . 某汽车安全气囊的产气药主要含有KClO4、Fe2O3、NaHCO3、NaN3等物质。当汽车发生碰撞时,产气药产生大量气体使气囊迅速膨胀,从而起到保护作用。
回答下列问题:
(1)KClO4、Fe2O3、NaHCO3、NaN3四种物质中,属于氧化物的是___________ 。
(2)KClO4是助氧化剂,其中氯元素的化合价为___________ 。
(3)Fe2O3是主氧化剂,与Na发生置换反应,还原产物为___________ 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为___________ 。
(5)NaN3是气体发生剂,受热分解产生N2和Na,N2和Na的物质的量之比为___________ 。
回答下列问题:
(1)KClO4、Fe2O3、NaHCO3、NaN3四种物质中,属于氧化物的是
(2)KClO4是助氧化剂,其中氯元素的化合价为
(3)Fe2O3是主氧化剂,与Na发生置换反应,还原产物为
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
(5)NaN3是气体发生剂,受热分解产生N2和Na,N2和Na的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 现有下列物质:①Na2O2 ②NH4Cl ③HNO3 ④CO2 ⑤铜 ⑥FeCl3溶液 ⑦蔗糖
(1)上述状态的物质中,能导电有_______ (填序号)。
(2)③在水溶液中的电离方程式为_______ 。
(3)制作印刷电路板时⑥腐蚀铜的离子方程式为_______ ,反应中Fe3+被_______ (填“氧化”或“还原”)。
(4)标准状况下,由CO和CO2组成的混合气体33.6L,质量为56.4g,则该混合气体中,CO与CO2的物质的量之比为_______ 。
(5)⑤和③可发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应中若消耗8mol/L的硝酸 100 mL,则转移电子的数目为_______ 。
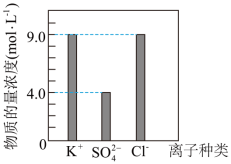
(6)某学习兴趣小组用KCl、K2SO4、NH4Cl固体配制了500mL无土栽培用的营养液。测得该营养液中部分离子的浓度柱状图如图所示,则该营养液中NH4Cl的物质的量为_______ 。
(1)上述状态的物质中,能导电有
(2)③在水溶液中的电离方程式为
(3)制作印刷电路板时⑥腐蚀铜的离子方程式为
(4)标准状况下,由CO和CO2组成的混合气体33.6L,质量为56.4g,则该混合气体中,CO与CO2的物质的量之比为
(5)⑤和③可发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应中若消耗8mol/L的硝酸 100 mL,则转移电子的数目为
(6)某学习兴趣小组用KCl、K2SO4、NH4Cl固体配制了500mL无土栽培用的营养液。测得该营养液中部分离子的浓度柱状图如图所示,则该营养液中NH4Cl的物质的量为

您最近一年使用:0次
名校
解题方法
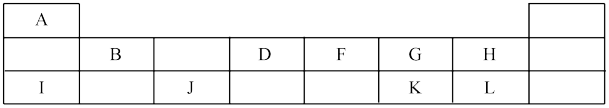
4 . 下表为元素周期表中的短周期元素部分,A~L分别为短周期元素。_______ 。
(2)F、G、H三种元素的原子半径最大的是_______ (填元素名称);元素G、K形成的简单气态氢化物中,稳定性较强的是_______ (填氢化物化学式)。
(3)A~L元素中金属性最强元素的是_______ (填元素符号);请画出表中非金属性最强的元素的原子结构示意图_______ 。
(4)已知I、J的最高价氧化物的水化物能相互反应,其离子方程式为_______ 。
(5)原子序数比元素I大8的元素,其单质及化合物在灼烧时,透过蓝色的钴玻璃,火焰呈_______ 色。
(2)F、G、H三种元素的原子半径最大的是
(3)A~L元素中金属性最强元素的是
(4)已知I、J的最高价氧化物的水化物能相互反应,其离子方程式为
(5)原子序数比元素I大8的元素,其单质及化合物在灼烧时,透过蓝色的钴玻璃,火焰呈
您最近一年使用:0次
2023-12-27更新
|
134次组卷
|
3卷引用:广东省云浮市罗定中学2023-2024学年高一上学期12月月考化学试题
名校
5 . 阅读下列短文:
蛋白质是人类必需的营养物质。蛋白质在 、
、 溶液或酶的作用下,可水解成各种氨基酸。少量的
溶液或酶的作用下,可水解成各种氨基酸。少量的 、
、 能促进蛋白质的溶解,当向蛋白质中加入的上述物质的溶液达到一定浓度时,反而会使蛋白质从溶液中析出。在
能促进蛋白质的溶解,当向蛋白质中加入的上述物质的溶液达到一定浓度时,反而会使蛋白质从溶液中析出。在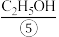 或福尔马林的作用下,蛋白质会失去生理活性。临床上,病人可通过服用生鸡蛋、牛奶或豆浆来解救
或福尔马林的作用下,蛋白质会失去生理活性。临床上,病人可通过服用生鸡蛋、牛奶或豆浆来解救 、汞等重金属盐中毒。蛋白质在人体中代谢的最终产物有
、汞等重金属盐中毒。蛋白质在人体中代谢的最终产物有 、
、 、氮氧化物以及尿素等。
、氮氧化物以及尿素等。
根据所学知识,回答下列问题:
(1)在上述短文标有序号的物质中,属于电解质的有___________ (填序号,下同),属于非电解质的有___________ 。
(2)铁质物件表面易产生铁锈(其主要成分为Fe2O3),可用物质①进行铁件除锈,写出反应的离子方程式:___________ ,在除锈过程中,若有气泡产生,则说明除锈基本完成,写出生成气泡的离子方程式:___________ 。
(3)标准状况下,66g⑦的体积为________ L,它与_________ g⑧含有相同数目的氧原子。
蛋白质是人类必需的营养物质。蛋白质在
 、
、 溶液或酶的作用下,可水解成各种氨基酸。少量的
溶液或酶的作用下,可水解成各种氨基酸。少量的 、
、 能促进蛋白质的溶解,当向蛋白质中加入的上述物质的溶液达到一定浓度时,反而会使蛋白质从溶液中析出。在
能促进蛋白质的溶解,当向蛋白质中加入的上述物质的溶液达到一定浓度时,反而会使蛋白质从溶液中析出。在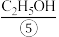 或福尔马林的作用下,蛋白质会失去生理活性。临床上,病人可通过服用生鸡蛋、牛奶或豆浆来解救
或福尔马林的作用下,蛋白质会失去生理活性。临床上,病人可通过服用生鸡蛋、牛奶或豆浆来解救 、汞等重金属盐中毒。蛋白质在人体中代谢的最终产物有
、汞等重金属盐中毒。蛋白质在人体中代谢的最终产物有 、
、 、氮氧化物以及尿素等。
、氮氧化物以及尿素等。根据所学知识,回答下列问题:
(1)在上述短文标有序号的物质中,属于电解质的有
(2)铁质物件表面易产生铁锈(其主要成分为Fe2O3),可用物质①进行铁件除锈,写出反应的离子方程式:
(3)标准状况下,66g⑦的体积为
您最近一年使用:0次
名校
解题方法
6 . 价电子对互斥(简称VSEPR)理论可用于预测简单分子的空间结构。请回答下列问题:
(1)利用价电子对互斥理论推断下列分子或离子的空间结构:
①
_____ ;②
_____ ;③
_____ ;④
_____ ;⑤
_____
(2)利用价电子对互斥理论推断键角的大小:(填“>”“<”或“=”,下同)
①甲醛分子中 的键角
的键角_____ 120°;
②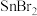 分子中
分子中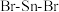 的键角
的键角_____ 120°;
③ 分子中
分子中 的键角
的键角_____ 109°28′。
(3)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据图所示的这两种微粒的球棍模型,写出相应的化学式:

A:_____ ;B:_____ 。
(4)按要求写出第2周期非金属元素组成的中性分子的化学式:平面形分子_____ ,三角锥形分子_____ ,四面体形分子_____ 。
(5)气态氢化物热稳定性 大于
大于 的主要原因是
的主要原因是_____ 。
(6)常温下,在水中的溶解度乙醇大于氯乙烷,原因是_____ 。
(1)利用价电子对互斥理论推断下列分子或离子的空间结构:
①





(2)利用价电子对互斥理论推断键角的大小:(填“>”“<”或“=”,下同)
①甲醛分子中
 的键角
的键角②
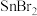 分子中
分子中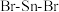 的键角
的键角③
 分子中
分子中 的键角
的键角(3)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据图所示的这两种微粒的球棍模型,写出相应的化学式:

A:
(4)按要求写出第2周期非金属元素组成的中性分子的化学式:平面形分子
(5)气态氢化物热稳定性
 大于
大于 的主要原因是
的主要原因是(6)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
您最近一年使用:0次
名校
解题方法
7 . 完成下列问题。
(1)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
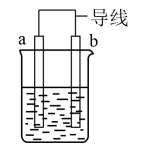
①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为_______ ,当电路中有0.2mol电子通过时,负极的质量减少_______ g。
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置_______ (填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极:_______ 。
(2)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
①锌片上发生的电极反应为_______ ;
②银片上发生的电极反应为_______ 。
③若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:
a.产生氢气的体积(标准状况)为_______ ;
b.通过导线的电量为_______ 。(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C)
(1)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。

①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置
(2)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
①锌片上发生的电极反应为
②银片上发生的电极反应为
③若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:
a.产生氢气的体积(标准状况)为
b.通过导线的电量为
您最近一年使用:0次
2022-04-14更新
|
327次组卷
|
2卷引用:广东省云浮市云安区云安中学2021-2022学年高一下学期第一次统测化学试题
名校
8 . 依据下图中氮元素及其化合物的转化关系,回答问题:
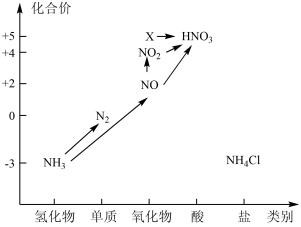
(1)上图中,X的化学式为_______ ,从化合价上看,X具有_______ (填“氧化”或“还原”)性。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_______ 。
②下列试剂不能用于干燥NH3的是_______ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:_______ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:_______ 。
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式:_______ 。工业生产中利用氨水吸收SO2和NO2,原理如下图所示:

NO2被吸收过程的离子方程式是_______ 。

(1)上图中,X的化学式为
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式:

NO2被吸收过程的离子方程式是
您最近一年使用:0次
名校
9 . 已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O
(1)上述反应物As2O3中,As元素显________ 价。
(2)上述反应的还原剂是________ (填化学式),还原产物是________ (填化学式)。
(3) 请用“单线桥法”标出上述反应电子转移的方向和数目:__________________________ 。
(1)上述反应物As2O3中,As元素显
(2)上述反应的还原剂是
(3) 请用“单线桥法”标出上述反应电子转移的方向和数目:
您最近一年使用:0次
名校
解题方法
10 . 已知反应:
①SO2 + 2H2S = 3S↓ + 2H2O
②3SO2+ 2H2O =2H2SO4 + S↓
③2SO2 + O2 = 2SO3
④SO2 + H2O = H2SO3
(1)上述反应中,不属于氧化还原反应的是_____ (填序号),SO2只做还原剂的反应是___ (填序号),SO2只做氧化剂的反应是___ (填序号)。
(2)反应②中,参与反应的氧化剂与还原剂的质量比是________________ 。
(3)写出反应②的离子方程式:_________________________________________ 。
(4)误食亚硝酸钠(NaNO2)会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的,在解毒反应中,Fe3+表现_______ 性(填氧化或还原)。
①SO2 + 2H2S = 3S↓ + 2H2O
②3SO2+ 2H2O =2H2SO4 + S↓
③2SO2 + O2 = 2SO3
④SO2 + H2O = H2SO3
(1)上述反应中,不属于氧化还原反应的是
(2)反应②中,参与反应的氧化剂与还原剂的质量比是
(3)写出反应②的离子方程式:
(4)误食亚硝酸钠(NaNO2)会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的,在解毒反应中,Fe3+表现
您最近一年使用:0次



