名校
1 . 人类文明的发展历程,也是化学物质的认识和发现的历程。
(1)铜原子在基态时价电子排布式为_______ 。已知高温下 比
比 更稳定,试从核外电子排布的角度解释:
更稳定,试从核外电子排布的角度解释:_______ 。
(2)铜与类卤素 反应生成
反应生成 ,
, 中含有
中含有 键的数目为
键的数目为_______ (阿伏加德罗常数的值用 表示)。类卤素
表示)。类卤素 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸 的沸点低于异硫氰酸
的沸点低于异硫氰酸 的沸点,其原因是
的沸点,其原因是_______ 。
(3)硝酸钾中 的空间结构为
的空间结构为_______ 。
(4)6−氨基青霉烷酸的结构如图甲所示,其中有出现 杂化的原子有
杂化的原子有_______ (填写元素符号)。

(5) 、
、 、
、 的沸点由高到低的顺序是
的沸点由高到低的顺序是_______ ,原因是_______ 。
(6) 可与
可与 形成
形成 ,
, 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是_______ 。
(1)铜原子在基态时价电子排布式为
 比
比 更稳定,试从核外电子排布的角度解释:
更稳定,试从核外电子排布的角度解释:(2)铜与类卤素
 反应生成
反应生成 ,
, 中含有
中含有 键的数目为
键的数目为 表示)。类卤素
表示)。类卤素 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸 的沸点低于异硫氰酸
的沸点低于异硫氰酸 的沸点,其原因是
的沸点,其原因是(3)硝酸钾中
 的空间结构为
的空间结构为(4)6−氨基青霉烷酸的结构如图甲所示,其中有出现
 杂化的原子有
杂化的原子有
(5)
 、
、 、
、 的沸点由高到低的顺序是
的沸点由高到低的顺序是(6)
 可与
可与 形成
形成 ,
, 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是
您最近一年使用:0次
2 . 回答下列问题
(1)有机化合物 是一种取代有机氯农药DDT的新型杀虫剂,它含有的官能团有
是一种取代有机氯农药DDT的新型杀虫剂,它含有的官能团有______ 、_______ 、_____ (写名称),它属于________ (填“脂环”或“芳香族”)化合物。
(2)1 mol CH2=CH—CH2OH含________ mol σ键,烯丙醇分子中碳原子的杂化类型为________ 。
(3)乙炔与氢氰酸(HCN)反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中σ键和π键的个数之比为___________ ,分子中处于同一直线上的原子数目最多为_______ 。
(1)有机化合物
 是一种取代有机氯农药DDT的新型杀虫剂,它含有的官能团有
是一种取代有机氯农药DDT的新型杀虫剂,它含有的官能团有(2)1 mol CH2=CH—CH2OH含
(3)乙炔与氢氰酸(HCN)反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中σ键和π键的个数之比为
您最近一年使用:0次
3 . 回答下列问题
(1)指出下列粒子的空间结构
①OF2_______ ;
②BeF2_______ ;
③PF3_______ ;
④SO3_______ 。
(2)在BF3分子中,F-B-F的键角是_______ ,硼原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF4,BF 的空间构型为
的空间构型为_______ 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间构型是_______ ;N2H4分子中氮原子轨道的杂化类型是_______ 。
(4)H+可与H2O形成H3O+,H3O+中氧原子采用_______ 杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为_______ 。
(5)SO 的空间构型是
的空间构型是_______ ,其中硫原子的杂化轨道类型是_______ 。
(1)指出下列粒子的空间结构
①OF2
②BeF2
③PF3
④SO3
(2)在BF3分子中,F-B-F的键角是
 的空间构型为
的空间构型为(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间构型是
(4)H+可与H2O形成H3O+,H3O+中氧原子采用
(5)SO
 的空间构型是
的空间构型是
您最近一年使用:0次
2022-12-20更新
|
566次组卷
|
2卷引用:广东省北京师范大学珠海分校附属外国语学校2021-2022学年高二3月阶段性验收化学试题
解题方法
4 . 按要求填空:
(1)在下列物质中:①NH3、②HC≡CH、③NaOH、④O2、⑤溴化铵(用序号填空)
其中只含有非极性键的是___________ ;只含有极性键的是___________ ;含有离子键、共价键、配位键的是___________ ;
(2)A的原子的2p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,写出该原子价电子的轨道表示式:___________ 。
(3)N≡N的键能为942 kJ•mol﹣1,N﹣N单键的键能为247 kJ•mol﹣1,通过计算说明N2中的______ 键更稳定(填“σ”或“π”)。
(4)在①苯;②CH3OH;③HCHO;④CS2;⑤CCl4五种溶剂中,碳原子采取sp2杂化的分子有___________ (填序号),CS2分子的空间结构是___________ ,CO2与CS2相比,___________ (填化学式)的熔点较高。
(5)苯胺(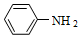 )与甲苯的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣950℃)沸点(110.6℃),原因是
)与甲苯的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣950℃)沸点(110.6℃),原因是___________ 。
(1)在下列物质中:①NH3、②HC≡CH、③NaOH、④O2、⑤溴化铵(用序号填空)
其中只含有非极性键的是
(2)A的原子的2p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,写出该原子价电子的轨道表示式:
(3)N≡N的键能为942 kJ•mol﹣1,N﹣N单键的键能为247 kJ•mol﹣1,通过计算说明N2中的
(4)在①苯;②CH3OH;③HCHO;④CS2;⑤CCl4五种溶剂中,碳原子采取sp2杂化的分子有
(5)苯胺(
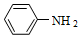 )与甲苯的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣950℃)沸点(110.6℃),原因是
)与甲苯的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣950℃)沸点(110.6℃),原因是
您最近一年使用:0次
解题方法
5 . 回答下列小题
(1)下列物质变化,只与范德华力有关的是___________。
(2)下面是s能级与p能级的原子轨道图:

请回答下列问题:
s电子的原子轨道呈___________ 形,每个s能级有___________ 个原子轨道;
p电子的原子轨道呈___________ 形,每个p能级有___________ 个原子轨道。
(3)Na、Mg、Al第一电离能的由大到小的顺序:___________ 。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列:①2s②3d③4s④3s⑤4p⑥3p
轨道能量由低到高排列顺序是___________ 。
(5)乙炔HC≡CH中C原子以___________ 方式杂化,实验室中一般用CaC2以水反应制取,同时生成一种碱;写出CaC2以水反应的化学方程式___________ 。
(6)用电子式表示CaCl2的形成过程:___________ 。
(1)下列物质变化,只与范德华力有关的是___________。
| A.干冰熔化 | B.乙酸汽化 | C.乙醇溶于水 | D.碘溶于四氯化碳 |

请回答下列问题:
s电子的原子轨道呈
p电子的原子轨道呈
(3)Na、Mg、Al第一电离能的由大到小的顺序:
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列:①2s②3d③4s④3s⑤4p⑥3p
轨道能量由低到高排列顺序是
(5)乙炔HC≡CH中C原子以
(6)用电子式表示CaCl2的形成过程:
您最近一年使用:0次
解题方法
6 .
(1)对于A.MgO;B.He;C.NH3;D.CaO;E.干冰;F.Ar五种物质:
①熔沸点最低的是________ ;液态时能导电的是________ (填字母编号)。
②上述物质的晶体中,属于离子晶体且熔点最高的是_______________ (填字母编号)。
③上述物质的晶体熔化时,所克服的微粒间的作用力与冰熔化时所克服的作用力类型完全相同的是______ (填字母编号)。
(2)已知熔融的BeCl2不导电,则BeCl2属于______ 晶体,中心原子的杂化类型为______ 。
(3)氮、磷、砷在农药、肥料等农业生产方面有广泛的应用。请回答相关问题:氨水是一种速效氮肥,氨水中含有配位键的粒子有H3O+和X,则X的离子符号为_________________ ,X离子中形成的配位键中提供孤电子对的原子是________________ 。
(1)对于A.MgO;B.He;C.NH3;D.CaO;E.干冰;F.Ar五种物质:
①熔沸点最低的是
②上述物质的晶体中,属于离子晶体且熔点最高的是
③上述物质的晶体熔化时,所克服的微粒间的作用力与冰熔化时所克服的作用力类型完全相同的是
(2)已知熔融的BeCl2不导电,则BeCl2属于
(3)氮、磷、砷在农药、肥料等农业生产方面有广泛的应用。请回答相关问题:氨水是一种速效氮肥,氨水中含有配位键的粒子有H3O+和X,则X的离子符号为
您最近一年使用:0次
7 . 维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。请回答下列问题:

(1)以下关于维生素C的说法正确的是_______ (填字母)。
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是_______ (填字母)。
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为_______ 。
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是_______ ,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(5)维生素C是一种易溶于水的有机物,主要原因是_______ 。

(1)以下关于维生素C的说法正确的是
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是
(5)维生素C是一种易溶于水的有机物,主要原因是
您最近一年使用:0次
解题方法
8 .  是环境友好材料,能光催化降解有机物。回答下列问题:
是环境友好材料,能光催化降解有机物。回答下列问题:
(1)基态Ti原子核外电子占据的最高能层符号为___________ ,占据该能层电子的电子云形状是___________ ,价电子中未成对电子个数为___________ 。
(2)纳米 催化处理污水的一个实例如图所示。
催化处理污水的一个实例如图所示。

化合物甲的分子中采取 杂化方式的碳原子个数为
杂化方式的碳原子个数为___________ ,化合物乙中C、N、O元素的第一电离能由大到小的顺序是___________ 。
(3)香豆素( )是一种天然香料,能被
)是一种天然香料,能被 光降解,香豆素的分子式为
光降解,香豆素的分子式为___________ ,写出在加热条件下其与足量NaOH溶液反应的化学方程式___________ 。
 是环境友好材料,能光催化降解有机物。回答下列问题:
是环境友好材料,能光催化降解有机物。回答下列问题:(1)基态Ti原子核外电子占据的最高能层符号为
(2)纳米
 催化处理污水的一个实例如图所示。
催化处理污水的一个实例如图所示。
化合物甲的分子中采取
 杂化方式的碳原子个数为
杂化方式的碳原子个数为(3)香豆素(
 )是一种天然香料,能被
)是一种天然香料,能被 光降解,香豆素的分子式为
光降解,香豆素的分子式为
您最近一年使用:0次
名校
9 . 芳香族化合物与生活生产密切相关。芳香胺是多种染料产品的中间体,也是农药、除草剂和多种橡胶防老剂的主要原料,常用1-硝基萘制备。
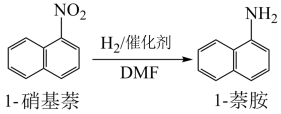

(1)溶剂DMF中含氧官能团的名称为_______ ,C原子的杂化类型有_______ ,1molDMF中所含有的σ键数目为_______ ,分子中第一电离能最大的元素是_______ 。
(2)实验室可将萘(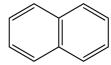 )与硝酸混合加热到46~48℃制备1-硝基萘,反应方程式为
)与硝酸混合加热到46~48℃制备1-硝基萘,反应方程式为_______ ,反应类型为_______ 。
(3)1-萘胺的水溶性比1-硝基萘的强,原因是_______ 。
(4)甲苯是常见的重要化工原料,常用于工业生产一种烈性炸药TNT,写出此反应的方程式_______ 。


(1)溶剂DMF中含氧官能团的名称为
(2)实验室可将萘(
 )与硝酸混合加热到46~48℃制备1-硝基萘,反应方程式为
)与硝酸混合加热到46~48℃制备1-硝基萘,反应方程式为(3)1-萘胺的水溶性比1-硝基萘的强,原因是
(4)甲苯是常见的重要化工原料,常用于工业生产一种烈性炸药TNT,写出此反应的方程式
您最近一年使用:0次
名校
解题方法
10 . 第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。回答下列问题:
(1)钒(V)及其化合物广泛应用于工业催化、新材料等领域。
①周期表中铬位于钒旁边,基态铬原子的价层电子排布图为_______ 。
② 是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:

则 分子中σ键和π键数目之比为
分子中σ键和π键数目之比为_______ 。 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。 与
与 的空间构型相同,其中V原子的杂化方式为
的空间构型相同,其中V原子的杂化方式为_______ 。
(2)①科学研究表明用 作光催化剂可处理废水中的
作光催化剂可处理废水中的 ,则
,则 的电子式为
的电子式为_______ 。
② 是一种储氢材料。基态B原子核外电子的运动状态有
是一种储氢材料。基态B原子核外电子的运动状态有_______ 种。
(3)甘氨酸亚铁络合物[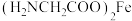 ]广泛用于缺铁性贫血的预防和治疗。
]广泛用于缺铁性贫血的预防和治疗。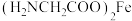 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为_______ (用元素符号表示)。
(4)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是_______ 分子(填“极性”或“非极性”)。
(1)钒(V)及其化合物广泛应用于工业催化、新材料等领域。
①周期表中铬位于钒旁边,基态铬原子的价层电子排布图为
②
 是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
则
 分子中σ键和π键数目之比为
分子中σ键和π键数目之比为 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。 与
与 的空间构型相同,其中V原子的杂化方式为
的空间构型相同,其中V原子的杂化方式为(2)①科学研究表明用
 作光催化剂可处理废水中的
作光催化剂可处理废水中的 ,则
,则 的电子式为
的电子式为②
 是一种储氢材料。基态B原子核外电子的运动状态有
是一种储氢材料。基态B原子核外电子的运动状态有(3)甘氨酸亚铁络合物[
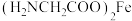 ]广泛用于缺铁性贫血的预防和治疗。
]广泛用于缺铁性贫血的预防和治疗。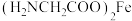 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为(4)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是
您最近一年使用:0次



