名校
1 . 按下列要求填空
(1)基态某原子的最外层电子排布式是 ,推断该元素位于第
,推断该元素位于第_____ 周期第____ 族,在元素周期表中属于____ 区。
(2)基态某原子的价层电子排布式为 ,在元素周期表中属于
,在元素周期表中属于_______ 区。
(3) 杂化类型为
杂化类型为_______ ,VSEPR模型为_______ ,离子空间构型为_______ 。
(1)基态某原子的最外层电子排布式是
 ,推断该元素位于第
,推断该元素位于第(2)基态某原子的价层电子排布式为
 ,在元素周期表中属于
,在元素周期表中属于(3)
 杂化类型为
杂化类型为
您最近一年使用:0次
名校
解题方法
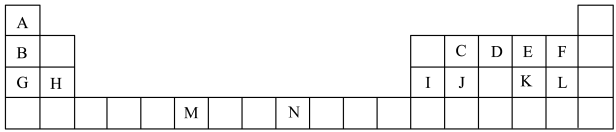
2 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)表中元素,电负性最强的是___________ (填元素符号),J的元素名称为___________ 。N基态原子核外能级上有___________ 未成对电子。
(2)D元素原子的价电子排布图为___________ ,核外有___________ 种不同运动状态的电子。
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是___________ (填“极性”或“非极性”)分子。
(4)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是___________ (填字母)。
(1)表中元素,电负性最强的是
(2)D元素原子的价电子排布图为
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是
(4)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是
a.  b. CH4 c.CH2=CHCH3 d. CH3CH2C≡CH
b. CH4 c.CH2=CHCH3 d. CH3CH2C≡CH
您最近一年使用:0次
3 . 回答下列问题。
(1)①比较键长大小:C-H___________ N-H___________ H-O(用“>”或“<”填空)。
②比较键能大小:C-H___________ N-H___________ H-O(用“>”或“<”填空)。
(2)乙烯分子中的碳原子均采取___________ 杂化,碳原子与氢原子形成σ键,两碳原子之间形成双键(1个___________ 键和1个___________ 键)。
(3)乙烯分子中的所有原子都位于___________ ,相邻两个键之间的夹角约为___________ 。
(4)铁原子的价层电子排布式为:___________ 。
(1)①比较键长大小:C-H
②比较键能大小:C-H
(2)乙烯分子中的碳原子均采取
(3)乙烯分子中的所有原子都位于
(4)铁原子的价层电子排布式为:
您最近一年使用:0次
解题方法
4 . 回答下列问题。
(1)基态N原子的电子排布式为___________ 。基态P原子中,电子占据的最高能级原子轨道形状为___________ 。
(2)H2O中心原子杂化轨道类型为___________ ,说明H2O沸点大于H2S的原因___________ 。
(3)基态Ca原子价层电子由4s2状态变化为4s14p1状态所得原子光谱为___________ (填“发射”或“吸收”)光谱。
(4)下列氧原子电子排布图表示的状态中,能量最高的是___________ (填标号,下同),能量最低的是___________ 。
A.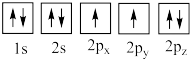 B.
B.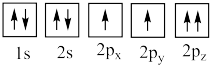
C. D.
D.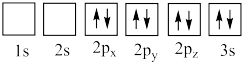
(1)基态N原子的电子排布式为
(2)H2O中心原子杂化轨道类型为
(3)基态Ca原子价层电子由4s2状态变化为4s14p1状态所得原子光谱为
(4)下列氧原子电子排布图表示的状态中,能量最高的是
A.
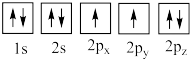 B.
B.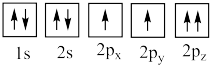
C.
 D.
D.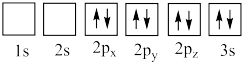
您最近一年使用:0次
2024-03-22更新
|
476次组卷
|
2卷引用:广东省普宁市勤建学校2023-2024学年高二下学期第一次月考化学试题
23-24高二上·广东深圳·期末
名校
5 . 根据所学知识,回答下列问题:
(1)Cu的简化电子排布式为___________ 。Fe2+的价电子轨道表示式为___________ 。
(2)乙炔分子中σ键与π键个数之比为___________ 。
(3)吡啶( )是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的
)是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的 大π键,由此可知,吡啶中N原子的价层孤电子对占据
大π键,由此可知,吡啶中N原子的价层孤电子对占据___________ 轨道。
(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为___________ 。
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为___________ 。
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为___________ 。
(1)Cu的简化电子排布式为
(2)乙炔分子中σ键与π键个数之比为
(3)吡啶(
 )是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的
)是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的 大π键,由此可知,吡啶中N原子的价层孤电子对占据
大π键,由此可知,吡啶中N原子的价层孤电子对占据(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 氮、氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有___________ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为___________ 。
(2)氟气可以用于制取惰性强于 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。
① 分子的空间结构为
分子的空间结构为___________ 。
②S、P、Si的第一电离能由大到小的顺序为___________ 。
(3)Na与N形成的 可用于汽车的安全气囊中,其中阴离子的空间结构为
可用于汽车的安全气囊中,其中阴离子的空间结构为___________ 。
(4)键角比较:
___________  (填“>”或“<”),其原因为
(填“>”或“<”),其原因为___________ 。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取惰性强于
 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。①
 分子的空间结构为
分子的空间结构为②S、P、Si的第一电离能由大到小的顺序为
(3)Na与N形成的
 可用于汽车的安全气囊中,其中阴离子的空间结构为
可用于汽车的安全气囊中,其中阴离子的空间结构为(4)键角比较:

 (填“>”或“<”),其原因为
(填“>”或“<”),其原因为
您最近一年使用:0次
名校
7 . 氨基乙酸铜被广泛应用于染料、涂料、塑料和电池等领域,其化学式为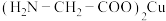 ,结构如图所示。
,结构如图所示。
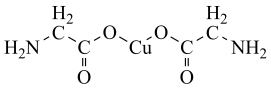
(1)基态 原子的电子排布式为
原子的电子排布式为_______ , 位于元素周期表中
位于元素周期表中_______ 区元素(填“s、p、d、ds和f”其中一个)。
(2)氨基乙酸铜中碳原子的杂化方式有_______ 、_______ ,该分子中有_______ 个 键。
键。
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其价电子自旋磁量子数的代数和为
原子,其价电子自旋磁量子数的代数和为_______ 。
(4) 原子的第一电离能比
原子的第一电离能比 原子的
原子的_______ (填“大”或“小”),其原因是_______ 。
(5)氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中 的VSEPR模型名称为
的VSEPR模型名称为_______ ,氯乙酸的酸性大于乙酸的原因是_______ 。
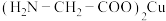 ,结构如图所示。
,结构如图所示。
(1)基态
 原子的电子排布式为
原子的电子排布式为 位于元素周期表中
位于元素周期表中(2)氨基乙酸铜中碳原子的杂化方式有
 键。
键。(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其价电子自旋磁量子数的代数和为
原子,其价电子自旋磁量子数的代数和为(4)
 原子的第一电离能比
原子的第一电离能比 原子的
原子的(5)氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中
 的VSEPR模型名称为
的VSEPR模型名称为
您最近一年使用:0次
解题方法
8 . Ⅰ.醛、酮在有机合成中是非常重要的中间体。
(1)甲醛所含元素的电负性由小到大的顺序为___________ (用元素符号表示),基态O原子的价层电子轨道表示式为___________ 。
(2)甲醛分子中碳原子的杂化轨道类型为___________ ,甲醛沸点(19.5℃)低于甲醇沸点(64.8℃),其原因是___________ 。
(3)醛、酮的羰基能和一些极性试剂(如HCN)发生加成反应。写出丙酮与HCN在一定条件下发生加成反应的化学方程式为___________ 。
Ⅱ.构建碳骨架在有机合成中是非常重要的一环。
(4)已知共轭二烯与含有双键的化合物相互作用,能生成六元环状化合物,例如 ,在一定条件下,
,在一定条件下,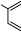 和
和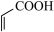 能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式
能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式___________ 。
(1)甲醛所含元素的电负性由小到大的顺序为
(2)甲醛分子中碳原子的杂化轨道类型为
(3)醛、酮的羰基能和一些极性试剂(如HCN)发生加成反应。写出丙酮与HCN在一定条件下发生加成反应的化学方程式为
Ⅱ.构建碳骨架在有机合成中是非常重要的一环。
(4)已知共轭二烯与含有双键的化合物相互作用,能生成六元环状化合物,例如
 ,在一定条件下,
,在一定条件下,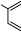 和
和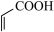 能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式
能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式
您最近一年使用:0次
解题方法
9 . 铁是一种重要的元素,在成人体中的含量达44~5g,铁的配合物在有机合成、催化等领域中发挥重要作用。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),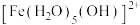 、
、 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。
(1)铁元素位于元素周期表的第___________ 周期第___________ 族。
(2) 中,中心离子为
中,中心离子为___________ ,配位原子是___________ ,配位数为___________ 。
(3)加入NaCl溶液后,溶液又变为黄色的原因:___________ (用离子方程式表示)。
Ⅱ. 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。
(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有___________ ;推测维生素C在水中的溶解性:___________ (填“难溶于水”或“易溶于水”)。
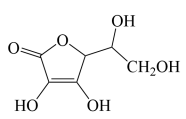
(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
②___________ 、___________ ;
③___________ 、___________ 、___________ 。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如
 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),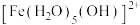 、
、 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。(1)铁元素位于元素周期表的第
(2)
 中,中心离子为
中,中心离子为(3)加入NaCl溶液后,溶液又变为黄色的原因:
Ⅱ.
 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有

(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
| 序号 | 结构特征 | 可反应的试剂 | 反应类型 |
| ① |  |  | 加成反应 |
| ② | 氧化反应 | ||
| ③ |
③
您最近一年使用:0次
解题方法
10 . 硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的价电子排布图为:___________ ;B、N、H的电负性由大到小的顺序为___________ 。
(2)科学家合成了一种含硼阴离子 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为___________ ,该结构中共有___________ 种不同化学环境的氧原子。
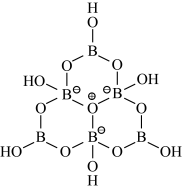
(3) 与
与 结合形成固态化合物
结合形成固态化合物 ,该物质在
,该物质在 时熔化电离出
时熔化电离出 和一含硼阴离子
和一含硼阴离子___________ (填离子符号); 空间构型为
空间构型为___________ 。
(1)基态硼原子的价电子排布图为:
(2)科学家合成了一种含硼阴离子
 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为
(3)
 与
与 结合形成固态化合物
结合形成固态化合物 ,该物质在
,该物质在 时熔化电离出
时熔化电离出 和一含硼阴离子
和一含硼阴离子 空间构型为
空间构型为
您最近一年使用:0次



