名校
解题方法
1 . 火箭发射时可以用肼( )作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题:
)作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题: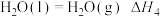 。
。
(1)由图可知,
______ (填“ ”或“
”或“ ”)0,理由为
”)0,理由为_____________ 。
(2)基态氮原子的电子排布式为______ 。
(3)0.1mol 分子中含有
分子中含有______ mol极性共价键, 分子中氮原子的杂化方式为
分子中氮原子的杂化方式为______ 。
(4) 分子中,
分子中, 键和
键和 键的数目之比为
键的数目之比为______ 。
(5)稳定性:
______ (填“ ”或“
”或“ ”)
”) 。
。
(6)由图可知,每转移0.2mol电子,消耗 的体积为
的体积为______ L(标准状况下)。
(7)表示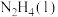 燃烧热的热化学方程式为
燃烧热的热化学方程式为______________ (焓变用含 和
和 的代数式表示)。
的代数式表示)。
 )作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题:
)作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题: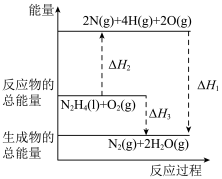
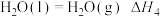 。
。(1)由图可知,

 ”或“
”或“ ”)0,理由为
”)0,理由为(2)基态氮原子的电子排布式为
(3)0.1mol
 分子中含有
分子中含有 分子中氮原子的杂化方式为
分子中氮原子的杂化方式为(4)
 分子中,
分子中, 键和
键和 键的数目之比为
键的数目之比为(5)稳定性:

 ”或“
”或“ ”)
”) 。
。(6)由图可知,每转移0.2mol电子,消耗
 的体积为
的体积为(7)表示
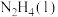 燃烧热的热化学方程式为
燃烧热的热化学方程式为 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钴、钙等多种化学物质。请回答下列问题:
(1)科学家常利用仪器进行___________ 实验来区分晶体硼和无定形硼,二者之间的关系互为___________ 。第二周期元素的第一电离能按由小到大的顺序排列,B元素排在第___________ 位,其基态能量最高的能级电子云轮廓图为___________ 形。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为___________ ,Si原子的杂化类型为___________ 。 的几何构型为正八面体形,Co在中心。
的几何构型为正八面体形,Co在中心。 中,1个Co提供
中,1个Co提供___________ 个空轨道。该配位离子的作用力为___________ (填序号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
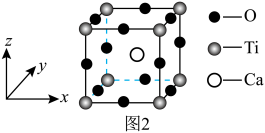
(4)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。与Ti紧邻的Ca有___________ 个。晶胞中Ca原子坐标参数为___________ 。
(1)科学家常利用仪器进行
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为

 的几何构型为正八面体形,Co在中心。
的几何构型为正八面体形,Co在中心。 中,1个Co提供
中,1个Co提供A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
(4)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。与Ti紧邻的Ca有
您最近一年使用:0次
名校
3 . 按要求回答下列问题:
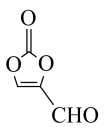
(1)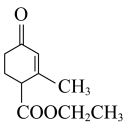 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为___________ 。
(2)某有机物结构如图所示,下列说法正确的是___________ (填序号)。
③分子中C原子的杂化方式为 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子
(3)TiO2是环境友好材料,能光催化降解有机物。纳米TiO2催化处理污水的一个实例如图所示。___________ ;化合物乙中有___________ 个手性碳原子。
(4)有A、B两种烃,已知:
( )B完全燃烧的产物
)B完全燃烧的产物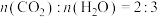 。
。
( )A是B分子中的氢原子全部被甲基取代后的产物;A遇
)A是B分子中的氢原子全部被甲基取代后的产物;A遇 的
的 溶液不褪色,其一氯代物只有一种。
溶液不褪色,其一氯代物只有一种。
①写出B与溴在光照下的反应方程式___________ (只写一取代)。
②A的结构简式为___________ ,系统命名为___________ 。
(1)
 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为(2)某有机物结构如图所示,下列说法正确的是
③分子中C原子的杂化方式为
 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子(3)TiO2是环境友好材料,能光催化降解有机物。纳米TiO2催化处理污水的一个实例如图所示。

(4)有A、B两种烃,已知:
(
 )B完全燃烧的产物
)B完全燃烧的产物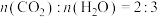 。
。(
 )A是B分子中的氢原子全部被甲基取代后的产物;A遇
)A是B分子中的氢原子全部被甲基取代后的产物;A遇 的
的 溶液不褪色,其一氯代物只有一种。
溶液不褪色,其一氯代物只有一种。①写出B与溴在光照下的反应方程式
②A的结构简式为
您最近一年使用:0次
名校
4 . 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为___________ ;As的第一电离能比Se的第一电离能大的原因为___________ 。
(2) 中心原子的杂化类型是:
中心原子的杂化类型是:___________ , 的立体构型是
的立体构型是___________ 。
(3) 属于
属于___________ (填“极性”或“非极性”)分子;比较 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:___________ 。
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为___________ ;若该晶胞密度为ρg⋅cm ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为___________ 。
(1)基态硒原子的价层电子排布式为
(2)
 中心原子的杂化类型是:
中心原子的杂化类型是: 的立体构型是
的立体构型是(3)
 属于
属于 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为
 ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为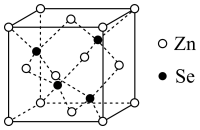
您最近一年使用:0次
2024-05-03更新
|
388次组卷
|
2卷引用:广东省茂名市高州中学2023-2024学年高二下学期期中考试化学试题
解题方法
5 . 硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的价电子排布图为:___________ ;B、N、H的电负性由大到小的顺序为___________ 。
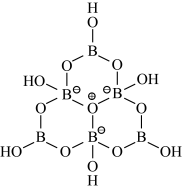
(2)科学家合成了一种含硼阴离子 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为___________ ,该结构中共有___________ 种不同化学环境的氧原子。
(3) 与
与 结合形成固态化合物
结合形成固态化合物 ,该物质在
,该物质在 时熔化电离出
时熔化电离出 和一含硼阴离子
和一含硼阴离子___________ (填离子符号); 空间构型为
空间构型为___________ 。
(1)基态硼原子的价电子排布图为:
(2)科学家合成了一种含硼阴离子
 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为
(3)
 与
与 结合形成固态化合物
结合形成固态化合物 ,该物质在
,该物质在 时熔化电离出
时熔化电离出 和一含硼阴离子
和一含硼阴离子 空间构型为
空间构型为
您最近一年使用:0次
6 . 已知元素 是组成物质
是组成物质 的其中一种元素。元素
的其中一种元素。元素 的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号
的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号 至
至 表示)如表所示:
表示)如表所示:
(1)元素 是
是___________ (填元素符号)。
(2)基态氮原子核外有___________ 种不同运动状态的电子,有___________ 种能量不同的电子。
(3) 中,电负性最大的元素是
中,电负性最大的元素是___________ (填元素符号), 的
的___________ 杂化轨道与 的
的 轨道形成
轨道形成___________ 键。
 是组成物质
是组成物质 的其中一种元素。元素
的其中一种元素。元素 的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号
的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号 至
至 表示)如表所示:
表示)如表所示: |  |  |  | |
电离能 | 578 | 1817 | 2745 | 11578 |
 是
是(2)基态氮原子核外有
(3)
 中,电负性最大的元素是
中,电负性最大的元素是 的
的 的
的 轨道形成
轨道形成
您最近一年使用:0次
解题方法
7 . 根据杂化轨道理论可以判断分子的空间结构,试根据相关知识填空:
(1)一种有机化合物的结构简式如下:

该分子中有___________ 个sp2杂化碳原子;___________ 个sp3杂化碳原子;
(2)SCN-与NO 的结构相同,微粒呈
的结构相同,微粒呈___________ 形,中心原子都采取___________ 杂化。
(3)CO 、NO
、NO 等微粒具有相同的原子个数,空间结构呈
等微粒具有相同的原子个数,空间结构呈___________ 形,中心原子都采取___________ 杂化。
(4)元素As与N同族。预测As的氢化物分子的立体结构为___________ ,其沸点比NH3的___________ (填“高”或“低”),其判断理由是___________ 。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________ 。
(1)一种有机化合物的结构简式如下:

该分子中有
(2)SCN-与NO
 的结构相同,微粒呈
的结构相同,微粒呈(3)CO
 、NO
、NO 等微粒具有相同的原子个数,空间结构呈
等微粒具有相同的原子个数,空间结构呈(4)元素As与N同族。预测As的氢化物分子的立体结构为
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
您最近一年使用:0次
解题方法
8 . 按要求回答下面问题。
(1)键的极性对物质化学性质有影响,据此比较:① 、②
、② 、③
、③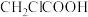 、④
、④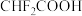 酸性由强到弱顺序是
酸性由强到弱顺序是_______ (用序号表示)。
(2) 分子内①
分子内① 键、②分子间的范德华力和③氢键从弱到强依次为
键、②分子间的范德华力和③氢键从弱到强依次为_______ (用序号表示)。 可与
可与 形成
形成 ,
, 是三角锥空间构型。
是三角锥空间构型。 中O原子采用的杂化方式为
中O原子采用的杂化方式为_______ 。
(3) 是一种无色液体,其结构如图1所示。根据“相似相溶规则”
是一种无色液体,其结构如图1所示。根据“相似相溶规则” 在水中的溶解度
在水中的溶解度_______ (填“>、<、=”)其在 中的溶解度。
中的溶解度。 是一种强氧化剂,与硫酸酸化的
是一种强氧化剂,与硫酸酸化的 溶液反应放出气体,氧化性强弱关系:
溶液反应放出气体,氧化性强弱关系:
_______  (填“>、<、=”)。
(填“>、<、=”)。

(4) 是一种极弱的二元酸,
是一种极弱的二元酸, 与过量的
与过量的 反应的化学方程式是
反应的化学方程式是_______ 。
(5)在图2中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素氢化物沸点的是曲线_______ ,同一族中第三、四、五周期元素的氢化物沸点依次升高,其原因是_______ 。

(1)键的极性对物质化学性质有影响,据此比较:①
 、②
、② 、③
、③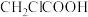 、④
、④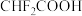 酸性由强到弱顺序是
酸性由强到弱顺序是(2)
 分子内①
分子内① 键、②分子间的范德华力和③氢键从弱到强依次为
键、②分子间的范德华力和③氢键从弱到强依次为 可与
可与 形成
形成 ,
, 是三角锥空间构型。
是三角锥空间构型。 中O原子采用的杂化方式为
中O原子采用的杂化方式为(3)
 是一种无色液体,其结构如图1所示。根据“相似相溶规则”
是一种无色液体,其结构如图1所示。根据“相似相溶规则” 在水中的溶解度
在水中的溶解度 中的溶解度。
中的溶解度。 是一种强氧化剂,与硫酸酸化的
是一种强氧化剂,与硫酸酸化的 溶液反应放出气体,氧化性强弱关系:
溶液反应放出气体,氧化性强弱关系:
 (填“>、<、=”)。
(填“>、<、=”)。
(4)
 是一种极弱的二元酸,
是一种极弱的二元酸, 与过量的
与过量的 反应的化学方程式是
反应的化学方程式是(5)在图2中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素氢化物沸点的是曲线

您最近一年使用:0次
解题方法
9 . 回答下列问题:
(1)有机化合物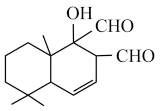 是一种取代有机氯农药DDT的新型杀虫剂,它含有的官能团有
是一种取代有机氯农药DDT的新型杀虫剂,它含有的官能团有_______ 、_______ 、_______ (写名称),它的分子式为_______ ,它属于_______ (填“脂环”或“芳香族”)化合物。
(2) 含
含_______  键,烯丙醇分子中碳原子的杂化类型为
键,烯丙醇分子中碳原子的杂化类型为_______ 。
(3)0.2mol某烃A在氧气中完全燃烧后,生成 和
和 各1.2mol,烃A的分子式为
各1.2mol,烃A的分子式为_______ 。
(1)有机化合物
 是一种取代有机氯农药DDT的新型杀虫剂,它含有的官能团有
是一种取代有机氯农药DDT的新型杀虫剂,它含有的官能团有(2)
 含
含 键,烯丙醇分子中碳原子的杂化类型为
键,烯丙醇分子中碳原子的杂化类型为(3)0.2mol某烃A在氧气中完全燃烧后,生成
 和
和 各1.2mol,烃A的分子式为
各1.2mol,烃A的分子式为
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)Cd与Zn同族且相邻,写出基态Cd原子的价层电子排布式:___________ 。
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为___________ 。
(3)O和S处于同一主族,第一电离能较大的是___________ 。 和
和 分子中的键角较大的是
分子中的键角较大的是___________ ,键长较短的是___________ 。单质硫与热的 浓溶液反应的产物之一为
浓溶液反应的产物之一为 ,
,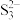 的空间构型为
的空间构型为___________ 。
(4)已知多个相邻且平行的p轨道重叠则形成大 键,分子中的大
键,分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子的大
键的电子数(如苯分子的大 键可表示为
键可表示为 )。吡咯(
)。吡咯(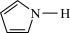 )中所有原子共平面。则吡咯分子中的大
)中所有原子共平面。则吡咯分子中的大 键应表示为
键应表示为___________ 。吡咯分子中N原子的杂化类型为___________ ,1mol吡咯分子中含有___________  键,
键,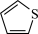 噻吩的沸点为84℃,吡咯(
噻吩的沸点为84℃,吡咯(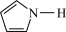 )的沸点在129-131℃之间,吡洛沸点较高,其原因是
)的沸点在129-131℃之间,吡洛沸点较高,其原因是___________ 。
(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度: ,则下列物质酸性由强到弱的顺序是___________(填序号)。
,则下列物质酸性由强到弱的顺序是___________(填序号)。
(6) 是离子晶体,其形成过程中的能量变化如图(a)所示。
是离子晶体,其形成过程中的能量变化如图(a)所示。
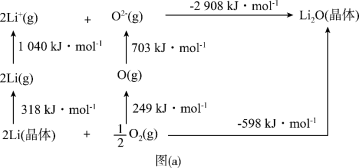
可知,Li原子的第一电离能为_______  ,
, 键键能为
键键能为_______  。
。
(1)Cd与Zn同族且相邻,写出基态Cd原子的价层电子排布式:
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为(3)O和S处于同一主族,第一电离能较大的是
 和
和 分子中的键角较大的是
分子中的键角较大的是 浓溶液反应的产物之一为
浓溶液反应的产物之一为 ,
,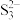 的空间构型为
的空间构型为(4)已知多个相邻且平行的p轨道重叠则形成大
 键,分子中的大
键,分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子的大
键的电子数(如苯分子的大 键可表示为
键可表示为 )。吡咯(
)。吡咯(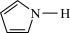 )中所有原子共平面。则吡咯分子中的大
)中所有原子共平面。则吡咯分子中的大 键应表示为
键应表示为 键,
键, 噻吩的沸点为84℃,吡咯(
噻吩的沸点为84℃,吡咯(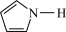 )的沸点在129-131℃之间,吡洛沸点较高,其原因是
)的沸点在129-131℃之间,吡洛沸点较高,其原因是(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度:
 ,则下列物质酸性由强到弱的顺序是___________(填序号)。
,则下列物质酸性由强到弱的顺序是___________(填序号)。A. | B. |
C. | D.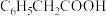 |
 是离子晶体,其形成过程中的能量变化如图(a)所示。
是离子晶体,其形成过程中的能量变化如图(a)所示。
可知,Li原子的第一电离能为
 ,
, 键键能为
键键能为 。
。
您最近一年使用:0次



