解题方法
1 . 铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___ ,Zn的基态原子能级最高的电子的电子云轮廓图形状为___ 。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___ 。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___ mol,其阴离子中心原子的杂化方式是___ ,NH3的沸点高于PH3的原因是___ 。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___ 。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___ ,其中Fe的配位数为___ 。
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加 德罗常数的值,则晶胞的密度为___ g·cm-3(列出计算式即可)。

(1)Fe2+电子排布式为
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加 德罗常数的值,则晶胞的密度为

您最近一年使用:0次
2020-06-28更新
|
1995次组卷
|
4卷引用:2021年高考化学押题预测卷(广东卷)(01)
(已下线)2021年高考化学押题预测卷(广东卷)(01)2021年广东省高考化学试卷变式题11-21重庆市江津中学、实验中学等七校2020届高三下学期6月联考(三诊)理科综合化学试题(已下线)2021年高考全国乙卷化学试题变式题
解题方法
2 . 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳原子的电子排布图为___ 。
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为___ 。
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是___ ,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为____ 。
③氨是___ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___ ,氨的沸点高于PH3,原因是___ 。
(3)镍元素基态原子的价电子排布式为___ ,3d能级上的未成对电子数为___ 。
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是___ 。
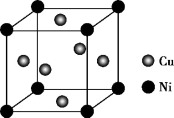
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=___ nm。
(1)基态碳原子的电子排布图为
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是
③氨是
(3)镍元素基态原子的价电子排布式为
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=

您最近一年使用:0次
2020-02-12更新
|
793次组卷
|
3卷引用:2021年广东省高考化学试卷变式题11-21
2019·广东广州·二模
3 . 钛的化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)基态Ti原子的未成对电子数是________ ,基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式________ 。
(2)钛卤化物的熔点和沸点如下表所示,TiCl4、TiBr4、TiI4熔沸点依次升高的原因是________ ;TiF4熔点反常的原因是________ 。

(3)Ti可形成配合物[Ti(urea)6](ClO4)3,urea表示尿素,其结构如下图所示:

①配合物中Ti化合价为________ 。
②尿素中C原子的杂化轨道类型为________ 。
③ClO4-的立体构型为________ 。
(4)下图为具有较高催化活性材料金红石的晶胞结构,其化学式为________ ;已知该晶体的密度为ρg·cm-3,Ti、O原子半径分别为a pm和b pm,阿伏伽德罗常数的值为N,则金 A红石晶体的空间利用率为________ (列出计算式)。

(1)基态Ti原子的未成对电子数是
(2)钛卤化物的熔点和沸点如下表所示,TiCl4、TiBr4、TiI4熔沸点依次升高的原因是

(3)Ti可形成配合物[Ti(urea)6](ClO4)3,urea表示尿素,其结构如下图所示:

①配合物中Ti化合价为
②尿素中C原子的杂化轨道类型为
③ClO4-的立体构型为
(4)下图为具有较高催化活性材料金红石的晶胞结构,其化学式为

您最近一年使用:0次
2019·广东·三模
4 . 杯芳烃一般是指由亚甲基桥连苯酚单元所构成的大环化合物,因其结构像一个酒杯而被称为杯芳烃。如对叔丁基杯[4]芳烃芳烃、硫或氮杂环杯芳烃等有关。

(1)一种氮杂环杯芳烃的结构如图a所示该分子中氮原子的杂化方式为___________ 。
(2)图b为对叔丁基杯[4]芳烃由4个羟基构成杯底分子内存在的作用力是___________ 。
a离子键 b.共价键 c.氢键 d.分子间作用力
(3)杯芳烃可用于某些ⅢB族元素金属离子如La3+及Sc3+的萃取,基态Sc2+核外电子排布式为_____________________ 。
(4)不同大小的杯芳烃一个重要作用是识别中性分子或离子,如CHCl3、苯、C60、CO32-、SCN-、N3-等微粒可被不同的杯芳烃识别。下列说法正确的是___________ (填字母)
A.图a、图b分子所含元素电负性大小顺序为O>N>C>H
B.SCN-、N3-与CO2互为等电子体因此均为直线形
C.由图c知C60分子中σ键与π键的个数比是1︰1
D.图c分子的晶体常态下不导电,但铯掺杂的C60固体呈现出金属性和超导性
(5)观察C60晶胞(如图c所示),回答下列问题:
①已知图c中A、B点的原子坐标分别为A(0,0,0);B(0,1/2,1/2),那么D点的原子坐标为:______________________
②与每个C60分子距离最近且相等的C60分子有___________ 个,已知C60晶体中C的原子半径为77pm,则晶体中原子的空间利用率为:______________________ 。(列出计算式即可)
(6)碳纳米管(如右图)是另一种奇特的碳结构,其中碳原子以sp2杂化,相比sp3杂化,sp2杂化中s轨道成分比较大,使碳纳米管具有高强度的性质,碳纳米管的熔点是已知材料中最高的;碳纳米管上碳原子的p电子形成大范围的离域π键,共轭效应显著。请结合碳纳米管的结构特点提出其可能的用途:_________________________________ 。(至少答两条)


(1)一种氮杂环杯芳烃的结构如图a所示该分子中氮原子的杂化方式为
(2)图b为对叔丁基杯[4]芳烃由4个羟基构成杯底分子内存在的作用力是
a离子键 b.共价键 c.氢键 d.分子间作用力
(3)杯芳烃可用于某些ⅢB族元素金属离子如La3+及Sc3+的萃取,基态Sc2+核外电子排布式为
(4)不同大小的杯芳烃一个重要作用是识别中性分子或离子,如CHCl3、苯、C60、CO32-、SCN-、N3-等微粒可被不同的杯芳烃识别。下列说法正确的是
A.图a、图b分子所含元素电负性大小顺序为O>N>C>H
B.SCN-、N3-与CO2互为等电子体因此均为直线形
C.由图c知C60分子中σ键与π键的个数比是1︰1
D.图c分子的晶体常态下不导电,但铯掺杂的C60固体呈现出金属性和超导性
(5)观察C60晶胞(如图c所示),回答下列问题:
①已知图c中A、B点的原子坐标分别为A(0,0,0);B(0,1/2,1/2),那么D点的原子坐标为:
②与每个C60分子距离最近且相等的C60分子有
(6)碳纳米管(如右图)是另一种奇特的碳结构,其中碳原子以sp2杂化,相比sp3杂化,sp2杂化中s轨道成分比较大,使碳纳米管具有高强度的性质,碳纳米管的熔点是已知材料中最高的;碳纳米管上碳原子的p电子形成大范围的离域π键,共轭效应显著。请结合碳纳米管的结构特点提出其可能的用途:

您最近一年使用:0次
解题方法
5 . 硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________ ,VO43-的几何构型为________ .
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为_______ ,该药物中S原子的杂化方式是_______ .所含第二周期元素第一电离能按由大到小顺序的排列是___________ .
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________ .
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____ .
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______ 。图4 为该晶胞的俯视图,该晶胞的密度为________ g/cm3 (列出计算式即可)。

(1)基态钒原子的外围电子轨道表达式为
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为

您最近一年使用:0次
2018-01-24更新
|
601次组卷
|
3卷引用:广东省佛山市普通高中2018届高三教学质量检测(一)化学试题
名校
6 . 硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为_____ (填字母)nm。
A.435 B.500 C.580 D.605 E.700
(2)元素S和Ca中,第一电离能较大的是_____ (填元素符号),其基态原子核外电子排布式为__________________ 。
(3)通过X射线衍射实验发现,石膏(CaSO4• 2H2O)中存在SO42-离子。SO42-离子的几何构型为_________________ ,中心原子的杂化形式为_________________ 。
(4) 基态Ca原子中,核外电子占据最高能层的符号是______ ,占据该能层电子的电子云轮廓图形状为_______________ 。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是_____________________________ 。
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρ g • cm-3,则晶胞结构中最近的两个Ca2+间的距离为_______________________________ nm (列算式即可,用NA表示阿伏伽德罗常数的数值),与Ca2+紧邻O22-的个数为______ 。

(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为
A.435 B.500 C.580 D.605 E.700
(2)元素S和Ca中,第一电离能较大的是
(3)通过X射线衍射实验发现,石膏(CaSO4• 2H2O)中存在SO42-离子。SO42-离子的几何构型为
(4) 基态Ca原子中,核外电子占据最高能层的符号是
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρ g • cm-3,则晶胞结构中最近的两个Ca2+间的距离为

您最近一年使用:0次
2017-09-15更新
|
411次组卷
|
4卷引用:广东省茂名市2018届高三五大联盟学校9月份联考化学试题
2013·辽宁·二模
7 . 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5 ℃,沸点为117 ℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式:_________________________ 。
(2)CH3COCH3分子中含有________ 个π键,含有________ 个σ键。
(3)固态氯化铬酰属于________ 晶体,丙酮中碳原子的杂化方式为_____________ ,二硫化碳属于________ (填“极性”或“非极性”)分子。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有____________ 键。
(5)金属铬的晶胞如图所示,一个晶胞中含有________ 个铬原子。

信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5 ℃,沸点为117 ℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式:
(2)CH3COCH3分子中含有
(3)固态氯化铬酰属于
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有
(5)金属铬的晶胞如图所示,一个晶胞中含有

您最近一年使用:0次
2013-09-02更新
|
873次组卷
|
3卷引用:2017届广东省清远市第三中学高三下学期第一次模拟考试理综化学试卷



