铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___ ,Zn的基态原子能级最高的电子的电子云轮廓图形状为___ 。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___ 。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___ mol,其阴离子中心原子的杂化方式是___ ,NH3的沸点高于PH3的原因是___ 。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___ 。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___ ,其中Fe的配位数为___ 。
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加 德罗常数的值,则晶胞的密度为___ g·cm-3(列出计算式即可)。

(1)Fe2+电子排布式为
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加 德罗常数的值,则晶胞的密度为

2020·重庆·三模 查看更多[4]
重庆市江津中学、实验中学等七校2020届高三下学期6月联考(三诊)理科综合化学试题(已下线)2021年高考化学押题预测卷(广东卷)(01)(已下线)2021年高考全国乙卷化学试题变式题2021年广东省高考化学试卷变式题11-21
更新时间:2020-06-28 09:38:14
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】W、X、Y、Z是原子序数依次增大的同一周期元素,原子序数均小于18,W、X是金属元素,Y、Z是非金属元素。
(1)已知:W、X各自的氧化物对应的水化物可以反应生成盐和水,写出X的氧化物与过量氢氧化钠溶液反应的离子方程式____________________________________ 。
(2)W与Y可形成化合物W2Y,该化合物水溶液呈碱性,用离子方程式解释其原因:
____________________________________________________________________ 。
(3)Y的某氧化物通入Z单质的水溶液中,发生反应生成两种强酸的化学方程式为:
_______________________________________________________________________ 。
(4)写出Z-离子的核外电子排布式:_________________________________________ 。
(5)W、X、Y、Z四种元素简单离子的半径由小到大的顺序是
______ <______ <______ <_______ (写离子符号)。
(1)已知:W、X各自的氧化物对应的水化物可以反应生成盐和水,写出X的氧化物与过量氢氧化钠溶液反应的离子方程式
(2)W与Y可形成化合物W2Y,该化合物水溶液呈碱性,用离子方程式解释其原因:
(3)Y的某氧化物通入Z单质的水溶液中,发生反应生成两种强酸的化学方程式为:
(4)写出Z-离子的核外电子排布式:
(5)W、X、Y、Z四种元素简单离子的半径由小到大的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】比较下列多电子原子的原子轨道的能量高低.
(1)2s________ 3s (2)2s ________ 3d (3)3d ________ 4s
(4)4f________ 6f (5)3px ________ 3pz (填“>”或“<”或“=”)。
(1)2s
(4)4f
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置___________________ ;Se基态原子价电子排布图为_____________ 。元素锌、硫和硒第一电离能较大的是________ (填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为_______ ;H2SeO4的酸性比H2SeO3强,原因是_______ 。
(3)气态SeO3分子的立体构型为_______ ;下列与SeO3互为等电子体的有_________ (填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为______ (填元素符号);该晶胞中硒原子所处空隙类型为_____ (填“立方体”“正四面体”或“正八面体”);若该晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏伽德罗常数的数值,则晶胞参数a为_______ nm。

(1)锌在周期表中的位置
(2)Na2SeO3分子中Se原子的杂化类型为
(3)气态SeO3分子的立体构型为
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】钛、铁、砷、硒、锌等元素的单质及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_______ ,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有________ 种。
(2)铁的第三电离能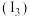 、第四电离能
、第四电离能 分别为
分别为 和
和 ,
, 远大于
远大于 的原因是
的原因是______________________ 。
(3) 离子可用于
离子可用于 的检验,其对应的酸有两种,分别为硫氰酸
的检验,其对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸 。
。
①写出与 互为等电子体的一种微粒
互为等电子体的一种微粒_________  分子或离子
分子或离子 ;
;
②异硫氰酸的沸点比硫氰酸沸点高的原因是_______________ 。
(4)成语“信口雌黄”中的雌黄分子式为 ,分子结构如图1所示,As原子的杂化方式为
,分子结构如图1所示,As原子的杂化方式为_______________ 。

(5)离子化合物 的晶胞结构如图2所示。一个晶胞含有的
的晶胞结构如图2所示。一个晶胞含有的 键有
键有__________ 个。

(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为____________  填元素符号
填元素符号 ;该晶胞中硒原子所处空隙类型为
;该晶胞中硒原子所处空隙类型为____________  填“立方体”、“正四面体”或“正八面体”
填“立方体”、“正四面体”或“正八面体” ,该种空隙的填充率为
,该种空隙的填充率为____________ ;若该晶胞密度为 ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为 。用
。用 代表阿伏加 德罗常数的数值,则晶胞参数a为
代表阿伏加 德罗常数的数值,则晶胞参数a为____________ nm。

(1)基态Ti原子中,最高能层电子的电子云轮廓形状为
(2)铁的第三电离能
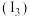 、第四电离能
、第四电离能 分别为
分别为 和
和 ,
, 远大于
远大于 的原因是
的原因是(3)
 离子可用于
离子可用于 的检验,其对应的酸有两种,分别为硫氰酸
的检验,其对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸 。
。①写出与
 互为等电子体的一种微粒
互为等电子体的一种微粒 分子或离子
分子或离子 ;
;②异硫氰酸的沸点比硫氰酸沸点高的原因是
(4)成语“信口雌黄”中的雌黄分子式为
 ,分子结构如图1所示,As原子的杂化方式为
,分子结构如图1所示,As原子的杂化方式为
(5)离子化合物
 的晶胞结构如图2所示。一个晶胞含有的
的晶胞结构如图2所示。一个晶胞含有的 键有
键有
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为
 填元素符号
填元素符号 ;该晶胞中硒原子所处空隙类型为
;该晶胞中硒原子所处空隙类型为 填“立方体”、“正四面体”或“正八面体”
填“立方体”、“正四面体”或“正八面体” ,该种空隙的填充率为
,该种空隙的填充率为 ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为 。用
。用 代表阿伏加 德罗常数的数值,则晶胞参数a为
代表阿伏加 德罗常数的数值,则晶胞参数a为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】百余种不同的元素,是构成大千世界中所有物质的“基石”。科学家们根据元素的性质递变规律、电子排布规律等对元素进行编排设计元素周期表。请根据所学内容回答下列问题:
(1)地壳中含量最多的元素的基态原子的轨道表示式是___________ ,能量最高的电子所在的轨道呈___________ 形。
(2) 、
、 是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是
是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是___________ 。
(3)研究发现,正离子的颜色与未成对电子数有关。例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是___________ 。
(4)当原子、分子或离子内有单电子存在时,能被外磁场吸引,表现出顺磁性。则铬元素的基态原子是否具有磁性?填___________ (填“有”或“无”)该元素在元素周期表中的位置:第___________ 周期,第___________ 族,该周期共有___________ 种元素。
(5)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。下表中列出了第三周期的几种元素的部分性质:
预测X值的区间:___________ ;上表中五种元素的第一电离能由大到小的顺序是___________ 。(写元素符号)
(6)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。基态 原子的外围电子排布式为
原子的外围电子排布式为___________ ; 位于周期表中
位于周期表中___________ 区,基态 、
、 离子中未成对的电子数之比为
离子中未成对的电子数之比为___________ 。
(7) 和
和 的第一电离能:
的第一电离能: ,原因是
,原因是___________ 。
(8)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是___________。
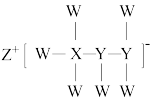
(1)地壳中含量最多的元素的基态原子的轨道表示式是
(2)
 、
、 是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是
是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是(3)研究发现,正离子的颜色与未成对电子数有关。例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是(4)当原子、分子或离子内有单电子存在时,能被外磁场吸引,表现出顺磁性。则铬元素的基态原子是否具有磁性?填
(5)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。下表中列出了第三周期的几种元素的部分性质:
| 元素编号 | a | b | c | d | e |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 主要化合价 |  , , |  , , |  , , |  |  |
(6)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。基态
 原子的外围电子排布式为
原子的外围电子排布式为 位于周期表中
位于周期表中 、
、 离子中未成对的电子数之比为
离子中未成对的电子数之比为(7)
 和
和 的第一电离能:
的第一电离能: ,原因是
,原因是(8)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是___________。
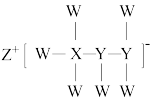
| A.该化合物中,W、X、Y之间均为共价键 |
| B.Z的单质既能与水反应,也可与甲醇反应 |
| C.Y的最高化合价氧化物的水化物为强酸 |
D.X的氟化物 中原子均为8电子稳定结构 中原子均为8电子稳定结构 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】第四周期中的18种元素具有重要的用途。
(1)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则GeBr4晶体类型为_________ ,中心原子的杂化类型为_________ 。
(2)第四周期VA-ⅦA族的元素中,电负性由大到小的顺序为(用元素符号表示)_________ 。
(3)金属镍在材料科学上也有重要作用,它易形成配合物,如:Ni(CO)4、[Ni (NH3)6]2+等。写出一种与配体CO互为等电子体的阴离子_________ (用化学式表示);配体NH3分子的空间构型为_________ 。
(4)基态原子Ti有_________ 种能量不同的电子,基态Ti3+的未成对电子有_________ 个。
(5)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为_________ 。
(1)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则GeBr4晶体类型为
(2)第四周期VA-ⅦA族的元素中,电负性由大到小的顺序为(用元素符号表示)
(3)金属镍在材料科学上也有重要作用,它易形成配合物,如:Ni(CO)4、[Ni (NH3)6]2+等。写出一种与配体CO互为等电子体的阴离子
(4)基态原子Ti有
(5)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)若某原子在处于能最最低状态时,外围电子排布为4d15s2,则下列说法正确的是___ (填标号)
A.该元戴原子处于能量最低状态时,原子中共有3个未成对电子
B.该元载原子核外共有5个电子层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层其有3个电子
(2)下列说法正确的是_______ (填标号)
A.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
B.H2O是一种非常稳定的化合物,这是由于氢键所致
C.H2O分子中两个O-H键的键角为180°
D.所有分子中都含有共价键
(3)根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为____ (填标号)
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
A.该元戴原子处于能量最低状态时,原子中共有3个未成对电子
B.该元载原子核外共有5个电子层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层其有3个电子
(2)下列说法正确的是
A.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
B.H2O是一种非常稳定的化合物,这是由于氢键所致
C.H2O分子中两个O-H键的键角为180°
D.所有分子中都含有共价键
(3)根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】常用CH3CHO+NaOH+2Cu(OH)2 CH3COONa+Cu2O↓+3H2O检验醛类。
CH3COONa+Cu2O↓+3H2O检验醛类。
(1)Cu2+基态核外电子排布式为___ 。
(2)CH3COONa中碳原子轨道的杂化类型是___ ,1molCH3COONa中含有σ键的数目为___ 。
(3)与OH-离子互为等电子体的阴离子为__ 。
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为__ 。
(5)Cu2O晶体结构可能是___ (填字母)。
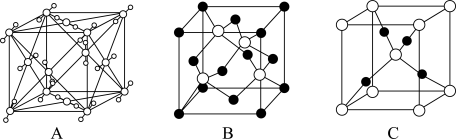
(6)SO32-的空间构型为__ 。
 CH3COONa+Cu2O↓+3H2O检验醛类。
CH3COONa+Cu2O↓+3H2O检验醛类。(1)Cu2+基态核外电子排布式为
(2)CH3COONa中碳原子轨道的杂化类型是
(3)与OH-离子互为等电子体的阴离子为
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为
(5)Cu2O晶体结构可能是

(6)SO32-的空间构型为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】分析晶体与非晶体具有的性质:
(1)下图是冰块熔化过程中温度随时间的变化图像。分析图像可知,冰块熔化过程持续___________ min,此过程需___________ (填“吸热”或“放热”),温度___________ (填“升高”“不变”或“降低”)。所以,冰是___________ (填“晶体”或“非晶体”),区分晶体与非晶体的重要依据是___________ 。

(2)甲为石墨晶体,甲说明晶体具有___________ ;乙说明晶体具有各向异性而非晶体具有___________ ;丙说明晶体的内部微粒排列规范___________ 而非晶体内部微粒排列无序。

(3)如图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。

①在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的氧离子、钙离子、钛离子各有___________ 个、___________ 个、___________ 个。
②该晶体结构中,元素氧、钛、钙的离子个数比是___________ ,该物质的化学式可表示为___________ 。
(1)下图是冰块熔化过程中温度随时间的变化图像。分析图像可知,冰块熔化过程持续

(2)甲为石墨晶体,甲说明晶体具有

(3)如图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。

①在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的氧离子、钙离子、钛离子各有
②该晶体结构中,元素氧、钛、钙的离子个数比是
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
名校
【推荐2】硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为_______ ,该能层具有的原子轨道数为________ 、电子数为___________ 。
(2)硅主要以硅酸盐、___________ 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以___________ 相结合,其晶胞中共有8个原子,其中在面心位置贡献__________ 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________________________________ 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______ 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________ 。
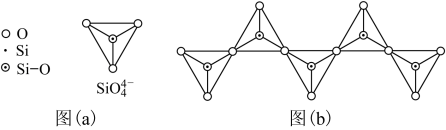
(6)在硅酸盐中,SiO 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______ ,Si与O的原子数之比为_________ ,化学式为__________________ 。
(1)基态Si原子中,电子占据的最高能层符号为
(2)硅主要以硅酸盐、
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
(6)在硅酸盐中,SiO
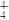 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸汽的密度是H2的36倍,其分子式为___________ 。
(2)立方烷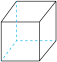 的六氯代物有
的六氯代物有___________ 种。
(3)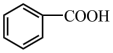 中含有的官能团名称为
中含有的官能团名称为___________ 。
(4) 其系统命名法名称应为
其系统命名法名称应为___________ 。
(5)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以表示成 :其中•表示氧原子,中心◯表示硅原子,其俯视图为
:其中•表示氧原子,中心◯表示硅原子,其俯视图为 。
。
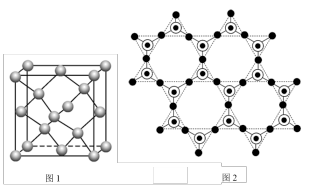
① 晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在
晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在 之间插入O原子而形成。
之间插入O原子而形成。
推测 晶胞中含有
晶胞中含有___________ 个O原子。
②蒙脱石散中的“(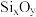 )”是一种大片层状的多硅酸根,其可能结构如图2所示,则
)”是一种大片层状的多硅酸根,其可能结构如图2所示,则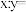
___________ 。
(1)烷烃A在同温、同压下蒸汽的密度是H2的36倍,其分子式为
(2)立方烷
 的六氯代物有
的六氯代物有(3)
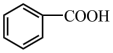 中含有的官能团名称为
中含有的官能团名称为(4)
 其系统命名法名称应为
其系统命名法名称应为(5)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以表示成
 :其中•表示氧原子,中心◯表示硅原子,其俯视图为
:其中•表示氧原子,中心◯表示硅原子,其俯视图为 。
。
①
 晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在
晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在 之间插入O原子而形成。
之间插入O原子而形成。推测
 晶胞中含有
晶胞中含有②蒙脱石散中的“(
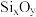 )”是一种大片层状的多硅酸根,其可能结构如图2所示,则
)”是一种大片层状的多硅酸根,其可能结构如图2所示,则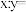
您最近一年使用:0次

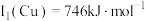 ,Fe第一电离能
,Fe第一电离能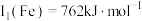 ,则
,则
 (填“>”、“=”或“<”),其主要原因是
(填“>”、“=”或“<”),其主要原因是 和
和 的中心原子的杂化轨道类型分别为
的中心原子的杂化轨道类型分别为 和
和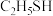 的酸性:
的酸性:

