1 . 桂皮中含有肉桂醛( ),是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。
),是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。
(1)1mol醛基含有的电子数目_______ 。
(2)肉桂醛分子中共平面的原子最多有_______ 个,碳原子的杂化方式为_______ 。
(3)某同学为检验肉桂醛中含有的官能团,做如下实验:
步骤2中发生的化学方程式为:_______ ;步骤3中空白处的基本操作是:_______ 。
(4)肉桂醛有多种同分异构体,写出符合下列条件的同分异构体的结构简式_______ 。
①遇 溶液呈现紫色 ②核磁共振氢谱有4组峰,且峰面积比为1∶2∶2∶3。
溶液呈现紫色 ②核磁共振氢谱有4组峰,且峰面积比为1∶2∶2∶3。
(5) 是工业合成肉桂醛的主要原料;工业合成的路线如下:
是工业合成肉桂醛的主要原料;工业合成的路线如下:

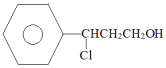
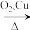 X
X
 ,X的结构简式为
,X的结构简式为_______ ,该流程中设计Ⅰ、Ⅱ两步的目的是_______ 。
 ),是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。
),是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。(1)1mol醛基含有的电子数目
(2)肉桂醛分子中共平面的原子最多有
(3)某同学为检验肉桂醛中含有的官能团,做如下实验:
| 步骤 | 操作 |
| 1 | 向试管中加入10%的氢氧化钠溶液2mL,边振荡边滴入2%的硫酸铜溶液4-6滴; |
| 2 | 向试管中再加入少量肉桂醛,加热充分反应,出现砖红色沉淀; |
| 3 | 取实验后试管中的清液少许,加入_______,溶液褪色。 |
(4)肉桂醛有多种同分异构体,写出符合下列条件的同分异构体的结构简式
①遇
 溶液呈现紫色 ②核磁共振氢谱有4组峰,且峰面积比为1∶2∶2∶3。
溶液呈现紫色 ②核磁共振氢谱有4组峰,且峰面积比为1∶2∶2∶3。(5)
 是工业合成肉桂醛的主要原料;工业合成的路线如下:
是工业合成肉桂醛的主要原料;工业合成的路线如下:


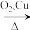 X
X
 ,X的结构简式为
,X的结构简式为
您最近一年使用:0次
名校
2 . 随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是 )为原料经合成气(主要成分为
)为原料经合成气(主要成分为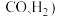 制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁
制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁 等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1) 中铁的化合价为0,写出铁原子的基态电子排布式:
中铁的化合价为0,写出铁原子的基态电子排布式:_______ 。
(2)与 互为等电子体的分子和离子分别为
互为等电子体的分子和离子分别为_____ 和_______ (各举一种即可,填化学式), 分子的电子式为
分子的电子式为_______ , 分子的结构式可表示成
分子的结构式可表示成_______ 。
(3)在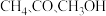 中,碳原子采取
中,碳原子采取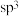 杂化的分子有
杂化的分子有_______ 。
(4) 分子中,
分子中,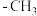 中的碳原子采用杂化
中的碳原子采用杂化_______ 方式,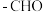 中的碳原子采取杂化方式
中的碳原子采取杂化方式_______ 。
 )为原料经合成气(主要成分为
)为原料经合成气(主要成分为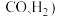 制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁
制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁 等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:(1)
 中铁的化合价为0,写出铁原子的基态电子排布式:
中铁的化合价为0,写出铁原子的基态电子排布式:(2)与
 互为等电子体的分子和离子分别为
互为等电子体的分子和离子分别为 分子的电子式为
分子的电子式为 分子的结构式可表示成
分子的结构式可表示成(3)在
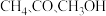 中,碳原子采取
中,碳原子采取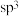 杂化的分子有
杂化的分子有(4)
 分子中,
分子中,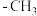 中的碳原子采用杂化
中的碳原子采用杂化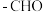 中的碳原子采取杂化方式
中的碳原子采取杂化方式
您最近一年使用:0次
名校
解题方法
3 . 环戊二烯(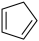 )是一种重要的化工原料
)是一种重要的化工原料
(1)下面是以环戊烷为原料制备环戊二烯的合成路线:
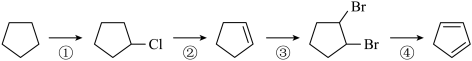
反应①的类型_______ ,反应②的方程式_______
(2)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

Ⅰ.环戊二烯分子中σ键和π键的个数比_______ ;C原子的杂化方式_______ ;环戊二烯与等物质的量的 反应的方程式
反应的方程式_______ ;
Ⅱ.四氢二聚环戊二烯的分子式_______ ;分子中有几个手性碳原子_______ ;四氢二聚环戊二烯与金刚烷的关系是_______ 。(填字母)
a.互为同系物 b、互为同分异构体 c.均为烷烃 d.均为环烃
Ⅲ.金刚烷的一氯代物有_______ 种,二氯代物有_______ 种。
(3)环戊二烯阴离子( ,所有原子共平面)的结构简式如图
,所有原子共平面)的结构简式如图 已知大π键可以用
已知大π键可以用 表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,则
表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,则 中大π键可以表示为
中大π键可以表示为_______ 。
(4)由环戊二烯与Fe(II)形成的二茂铁( )结构如图所示。二茂铁的熔点172℃,100℃以上容易升华,不溶于水,易溶于苯、乙醚。二茂铁中不存在的作用力有
)结构如图所示。二茂铁的熔点172℃,100℃以上容易升华,不溶于水,易溶于苯、乙醚。二茂铁中不存在的作用力有_______ (填标号)
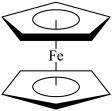
A.配位键 B. σ键 C. π键 D.氢键 E.金属键 F.离子键 G.分子间作用力
 )是一种重要的化工原料
)是一种重要的化工原料(1)下面是以环戊烷为原料制备环戊二烯的合成路线:

反应①的类型
(2)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

Ⅰ.环戊二烯分子中σ键和π键的个数比
 反应的方程式
反应的方程式Ⅱ.四氢二聚环戊二烯的分子式
a.互为同系物 b、互为同分异构体 c.均为烷烃 d.均为环烃
Ⅲ.金刚烷的一氯代物有
(3)环戊二烯阴离子(
 ,所有原子共平面)的结构简式如图
,所有原子共平面)的结构简式如图 已知大π键可以用
已知大π键可以用 表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,则
表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,则 中大π键可以表示为
中大π键可以表示为(4)由环戊二烯与Fe(II)形成的二茂铁(
 )结构如图所示。二茂铁的熔点172℃,100℃以上容易升华,不溶于水,易溶于苯、乙醚。二茂铁中不存在的作用力有
)结构如图所示。二茂铁的熔点172℃,100℃以上容易升华,不溶于水,易溶于苯、乙醚。二茂铁中不存在的作用力有
A.配位键 B. σ键 C. π键 D.氢键 E.金属键 F.离子键 G.分子间作用力
您最近一年使用:0次
解题方法
4 . 随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_____________________ 。
(2)与CO互为等电子体的分子和离子分别为________ 和________ (各举一种即可,填化学式),CO分子的电子式为________ ,CO分子的结构式可表示成________ 。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有___ ,CH3OH的熔、沸点比CH4高,其主要原因是__________ 。
(4)CH3CHO分子中,—CH3中的碳原子采取________ 杂化方式,—CHO中的碳原子采取________ 杂化方式。
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:
(2)与CO互为等电子体的分子和离子分别为
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
(4)CH3CHO分子中,—CH3中的碳原子采取
您最近一年使用:0次
名校
5 . 随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式________ 。
(2)与CO互为等电子体的分子和离子分别为_____ 和_____ (各举一种即可,填化学式),CO分子的结构式可表示成______ 。
(3)CH3OH的熔、沸点比CH4高,其主要原因是______ 。
(4)CH3CHO分子中,—CH3中的碳原子采取______ 杂化方式,—CHO中的碳原子采取______ 杂化方式。
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式
(2)与CO互为等电子体的分子和离子分别为
(3)CH3OH的熔、沸点比CH4高,其主要原因是
(4)CH3CHO分子中,—CH3中的碳原子采取
您最近一年使用:0次
2019-05-10更新
|
274次组卷
|
2卷引用:【全国百强校】贵州省思南中学2018-2019学年高二下学期期中考试化学试题
名校
6 . 苯甲酸常作食品防腐剂。一种合成路线如下:

回答下列问题:
(1)A的分子式为___________ ,B中官能团名称是___________ 。
(2)上述五种有机物属于___________ (填字母)。
a.芳香烃 b.脂环化合物 c.芳香族化合物 d.脂肪烃衍生物
(3)在催化剂作用下,A与足量的 反应生成F,F的一溴代物有
反应生成F,F的一溴代物有___________ 种。
(4)C中碳原子杂化类型是___________ 。
(5)C、D的沸点依次为204.7℃、179℃,二者沸点差异的主要原因是___________ 。
(6) 与E互为
与E互为___________ (填字母)。
a.同位素 b.同素异形体 c.同系物 d.同分异构体

回答下列问题:
(1)A的分子式为
(2)上述五种有机物属于
a.芳香烃 b.脂环化合物 c.芳香族化合物 d.脂肪烃衍生物
(3)在催化剂作用下,A与足量的
 反应生成F,F的一溴代物有
反应生成F,F的一溴代物有(4)C中碳原子杂化类型是
(5)C、D的沸点依次为204.7℃、179℃,二者沸点差异的主要原因是
(6)
 与E互为
与E互为a.同位素 b.同素异形体 c.同系物 d.同分异构体
您最近一年使用:0次
2023-04-28更新
|
326次组卷
|
2卷引用:江西省南昌市等5地2022-2023学年高二下学期4月期中考试化学试题
解题方法
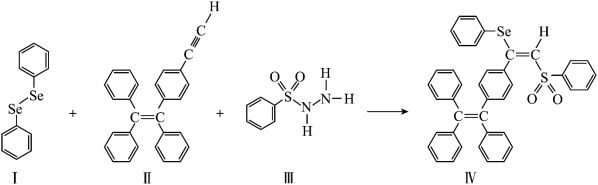
7 . AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)基态硫原子中,核外电子占据最高能层的符号是______ ,硫元素在周期表中位于_____ 区。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为_______ 。
(3)物质Ⅰ为______ (填“极性”或“非极性”)分子。物质Ⅰ、Ⅱ、Ⅲ在水中溶解度较大的是_____ (填序号),原因是___________ 。
(4)每个物质Ⅲ分子中采取 杂化的原子有
杂化的原子有___ 个。
(1)基态硫原子中,核外电子占据最高能层的符号是
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为(3)物质Ⅰ为
(4)每个物质Ⅲ分子中采取
 杂化的原子有
杂化的原子有
您最近一年使用:0次
名校
8 . 结晶玫瑰是具有强烈玫瑰香气的香料,可通过如图所示反应路线合成(部分反应条件略去):
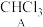 +
+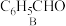
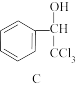

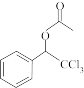 (结晶玫瑰)
(结晶玫瑰)
(1)A 的类别是___________ ,能与 Cl2反应生成 A 的烷烃是___________ (填名称);
(2)1mol B 在氧气中充分燃烧生成 CO2和 H2O,所需氧气是___________ mol;B 中所含的-CHO中碳原子的杂化方式是___________ ;
(3)C 含有的官能团名称有___________ ;
(4)结晶玫瑰的分子式是___________ ,它是手性分子,请在答题卡相应框图中将手性碳原子用*号标识出来______ 。
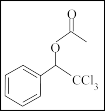
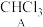 +
+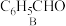


 (结晶玫瑰)
(结晶玫瑰)(1)A 的类别是
(2)1mol B 在氧气中充分燃烧生成 CO2和 H2O,所需氧气是
(3)C 含有的官能团名称有
(4)结晶玫瑰的分子式是

您最近一年使用:0次
2022-04-29更新
|
250次组卷
|
2卷引用:广东省广州市育才中学2021-2022学年高二下学期期中考试化学试题
解题方法
9 . 对氨基苯甲酸和邻氨基苯甲酸分别用于防晒剂和制造药物,某小组以甲苯为主要原料进行合成,设计流程如下图。
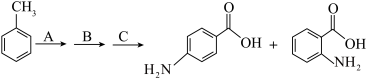
已知:i.羧基使苯环上与羧基处于间位的氢原子易被取代
ii .苯胺中的氨基易被氧化
iii.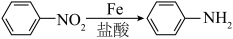
(1)基态N原子的电子有___________ 种运动状态。
(2)氨基苯甲酸中C=O中O原子的杂化方式是___________ 。
(3)组成氨基苯甲酸的4种元素的电负性由大到小的顺序是___________ 。
(4)对氨基苯甲酸和邻氨基苯甲酸的沸点分别是339.9℃和311.9℃,沸点不同的原因是___________ 。
(5)甲同学认为邻氨基苯甲酸可以形成“内盐”,请从化学键的角度解释“内盐”中离子键的形成过程___________ 。
(6)步骤A的反应条件___________ ;步骤C中生成1 mol对氨基苯甲酸电子转移___________ mol。

已知:i.羧基使苯环上与羧基处于间位的氢原子易被取代
ii .苯胺中的氨基易被氧化
iii.
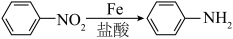
(1)基态N原子的电子有
(2)氨基苯甲酸中C=O中O原子的杂化方式是
(3)组成氨基苯甲酸的4种元素的电负性由大到小的顺序是
(4)对氨基苯甲酸和邻氨基苯甲酸的沸点分别是339.9℃和311.9℃,沸点不同的原因是
(5)甲同学认为邻氨基苯甲酸可以形成“内盐”,请从化学键的角度解释“内盐”中离子键的形成过程
(6)步骤A的反应条件
您最近一年使用:0次
10 . 氮及其化合物与人类生产、生活息息相关。 回答下列问题:
(1)前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为____________________________________________________________ 。
(2)N2F2分子中氮原子的杂化方式是_____________ ,1molN2F2含有_____________ mol σ键。
(3)NH3的键角_____________ H2O的键角(填“<”“ >”或“=”),原因是_____________ 。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1molNH4BF4含有_____________ mol配位键。
(5)安全气囊的设计原理为6NaN3+Fe2O3 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①等电子体的原理是原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,其具有许多相近的性质。写出两种与N3-互为等电子体的分子或离子_____________ ;
②Na2O的晶胞结构如下图所示,晶胞边长为566pm,晶胞中氧离子的配位数为_____________ ,Na2O晶体的密度为_____________ g·cm-3(只要求列算式,不必计算出结果)。
(1)前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为
(2)N2F2分子中氮原子的杂化方式是
(3)NH3的键角
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1molNH4BF4含有
(5)安全气囊的设计原理为6NaN3+Fe2O3
 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。①等电子体的原理是原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,其具有许多相近的性质。写出两种与N3-互为等电子体的分子或离子
②Na2O的晶胞结构如下图所示,晶胞边长为566pm,晶胞中氧离子的配位数为

您最近一年使用:0次



