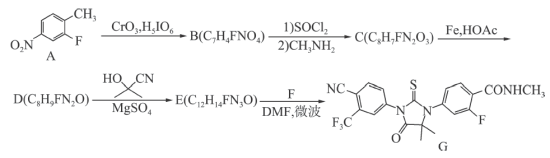
1 . 根据抑制癌细胞增殖药物的恩杂鲁胺 的两条合成路线,回答下列问题。
的两条合成路线,回答下列问题。
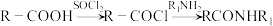 ;
;②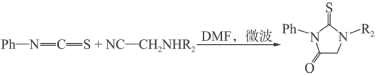 。
。
(2)
 反应的化学方程式为
反应的化学方程式为路线二:
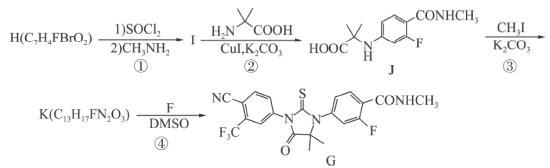
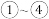 中仅发生取代反应的是
中仅发生取代反应的是
您最近一年使用:0次
2 . 氮及其化合物与人类生产、生活息息相关。 回答下列问题:
(1)前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为____________________________________________________________ 。
(2)N2F2分子中氮原子的杂化方式是_____________ ,1molN2F2含有_____________ mol σ键。
(3)NH3的键角_____________ H2O的键角(填“<”“ >”或“=”),原因是_____________ 。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1molNH4BF4含有_____________ mol配位键。
(5)安全气囊的设计原理为6NaN3+Fe2O3 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①等电子体的原理是原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,其具有许多相近的性质。写出两种与N3-互为等电子体的分子或离子_____________ ;
②Na2O的晶胞结构如下图所示,晶胞边长为566pm,晶胞中氧离子的配位数为_____________ ,Na2O晶体的密度为_____________ g·cm-3(只要求列算式,不必计算出结果)。
(1)前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为
(2)N2F2分子中氮原子的杂化方式是
(3)NH3的键角
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1molNH4BF4含有
(5)安全气囊的设计原理为6NaN3+Fe2O3
 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。①等电子体的原理是原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,其具有许多相近的性质。写出两种与N3-互为等电子体的分子或离子
②Na2O的晶胞结构如下图所示,晶胞边长为566pm,晶胞中氧离子的配位数为

您最近一年使用:0次
解题方法
3 . 以 、
、 等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是___________ 。
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁锌分子为平面结构,其结构如图,分子中各元素第一电离能由大到小顺序是___________ ,N原子的杂化轨道类型为___________ 。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是___________ 。

(3)金属Zn表面的氧化锌能溶于氨水,能促进锌与氨水反应生成以氨为配体,配位数为4的配离子,写出Zn与氨水反应的离子方程式___________ 。
(4) 晶体中部分O原子被N原子替代后可以改善半导体的性能,
晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是___________ 。
(5)下图为某 晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。abcd为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。abcd为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面___________ 。

 、
、 等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁锌分子为平面结构,其结构如图,分子中各元素第一电离能由大到小顺序是
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(3)金属Zn表面的氧化锌能溶于氨水,能促进锌与氨水反应生成以氨为配体,配位数为4的配离子,写出Zn与氨水反应的离子方程式
(4)
 晶体中部分O原子被N原子替代后可以改善半导体的性能,
晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是(5)下图为某
 晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。abcd为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。abcd为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
名校
4 . 研究发现,在 低压合成甲醇反应(
低压合成甲醇反应(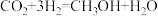 )中,
)中, 氧化物负载的
氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1) 和
和 分子中
分子中 原子的杂化形式分别为
原子的杂化形式分别为__________ 和__________ 。
(2)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____ ,原因是_____ 。
(3)硝酸锰是制备上述反应催化剂的原料,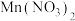 中的化学键除了
中的化学键除了 键外,还存在
键外,还存在__________ 。
 低压合成甲醇反应(
低压合成甲醇反应(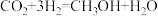 )中,
)中, 氧化物负载的
氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:(1)
 和
和 分子中
分子中 原子的杂化形式分别为
原子的杂化形式分别为(2)在
 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为(3)硝酸锰是制备上述反应催化剂的原料,
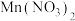 中的化学键除了
中的化学键除了 键外,还存在
键外,还存在
您最近一年使用:0次
2020-04-10更新
|
467次组卷
|
4卷引用:第2章 化学键与分子间作用力——C挑战区模拟高考(鲁科版选修3)
第2章 化学键与分子间作用力——C挑战区模拟高考(鲁科版选修3)(已下线)小题36 分子结构与性质(价层电子对互斥理论、杂化轨道理论、配合物) ——备战2021年高考化学经典小题考前必刷(全国通用)第一~二节综合拔高练2广东省东莞市东华高级中学2022-2023学年高二下学期3月月考化学试题
5 . (1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇的结构简式为 。请回答下列问题:
。请回答下列问题:
①基态镍原子的价电子排布式为________ 。
② 键,烯丙醇分子中碳原子的杂化类型是
键,烯丙醇分子中碳原子的杂化类型是__________ 。
(2)乙炔是有机合成的一种重要原料。实验室可用 与水反应得到乙炔。
与水反应得到乙炔。
①将乙炔通入 溶液中生成
溶液中生成 红棕色沉淀。基态
红棕色沉淀。基态 的核外电子排布式为
的核外电子排布式为____ 。
②乙炔与 反应可得丙烯腈(
反应可得丙烯腈( ),丙烯腈分子中碳原子的的杂化轨道类型是
),丙烯腈分子中碳原子的的杂化轨道类型是_______ ,分子中含有 键的数目为
键的数目为___________ 。
 。请回答下列问题:
。请回答下列问题:①基态镍原子的价电子排布式为
②
 键,烯丙醇分子中碳原子的杂化类型是
键,烯丙醇分子中碳原子的杂化类型是(2)乙炔是有机合成的一种重要原料。实验室可用
 与水反应得到乙炔。
与水反应得到乙炔。①将乙炔通入
 溶液中生成
溶液中生成 红棕色沉淀。基态
红棕色沉淀。基态 的核外电子排布式为
的核外电子排布式为②乙炔与
 反应可得丙烯腈(
反应可得丙烯腈( ),丙烯腈分子中碳原子的的杂化轨道类型是
),丙烯腈分子中碳原子的的杂化轨道类型是 键的数目为
键的数目为
您最近一年使用:0次
6 . 铁及其化合物用途非常广泛,如二茂铁可用作火箭燃料添加剂,铁酸锶用于直流电机永久陶瓷磁铁。用环戊二烯钠法制备二茂铁(如图)的原理为C5H6+NaOH→C5H5Na+H2O;2C5H5Na+FeCl2→(C5H5)2Fe+2NaCl。

(1)铁元素的基态价电子排布式为________________ 。
(2)基态Na原子中,核外电子占据的最高能级的符号是________ ,占据该能层电子的电子云轮廓图形状为________ 。Na和K属于同一主族,但金属Na的熔点比金属K高,原因是______________ 。
(3)(C5H5)2Fe中阴离子 中的σ键总数为
中的σ键总数为____ 个。分子中的大π键可用符号II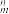 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ ),则
),则 中的大π键应表示为
中的大π键应表示为________________ 。
(4)用二乙胺法合成二茂铁的原料有(C2H5)2NH、FeCl2·4H2O及C5H6。(C2H5)2NH分子中采用sp3杂化的原子是________ ;FeCl2·4H2O是一种配合物,其结构如图所示,Fe2+与配体之间形成的化学键称为____________ 。

(5)铁酸锶的晶胞结构如下图所示:

①晶胞中距离最近的两个氧原子的距离为________ cm(列出计算表达式即可)。
②该晶体的密度为_____________ g·cm-3(列出计算表达式即可)。

(1)铁元素的基态价电子排布式为
(2)基态Na原子中,核外电子占据的最高能级的符号是
(3)(C5H5)2Fe中阴离子
 中的σ键总数为
中的σ键总数为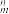 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ ),则
),则 中的大π键应表示为
中的大π键应表示为(4)用二乙胺法合成二茂铁的原料有(C2H5)2NH、FeCl2·4H2O及C5H6。(C2H5)2NH分子中采用sp3杂化的原子是

(5)铁酸锶的晶胞结构如下图所示:

①晶胞中距离最近的两个氧原子的距离为
②该晶体的密度为
您最近一年使用:0次



