名校
解题方法
1 . 有A、B、C、D四种主族元素,原子序数依次增大,A元素原子 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:
(1)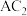 分子中含有
分子中含有___________ 个 键,属于
键,属于___________ (填“极性”或“非极性”)分子。
(2)B的简单气态氢化物的立体构型为___________ , 原子采用
原子采用___________ 杂化。
(3)写出 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:___________ 。
(4)C元素的电负性___________ (填“>”“<”或“=”)D元素的电负性,用一个化学方程式表示:___________ 。
 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:(1)
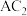 分子中含有
分子中含有 键,属于
键,属于(2)B的简单气态氢化物的立体构型为
 原子采用
原子采用(3)写出
 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:(4)C元素的电负性
您最近一年使用:0次
2023-05-02更新
|
122次组卷
|
3卷引用:河北省衡水市武强中学2023-2024学年高三上学期期中考试化学试题
解题方法
2 . 简要回答或计算。
(1)Bi2Cl 离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型
离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型______ 。
(2)在液氨中,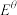 (Na+/Na)=-1.89V,
(Na+/Na)=-1.89V,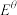 (Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因
(Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因_______ 。
(3)将Pb加到氨基钠的液氨溶液中,先生成白色沉淀Na4Pb,随后转化为Na4Pb9(绿色)而溶解。在此溶液中插入两块铅电极,通直流电,当1.0mol电子通过电解槽时,在哪个电极(阴极或阳极)上沉积出铅____ ?写出沉积铅的量____ 。
(4)下图是某金属氧化物的晶体结构示意图。图中,小球代表金属原子,大球代表氧原子,细线框处是其晶胞。
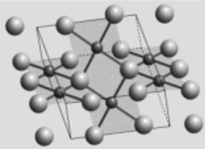
①写出金属原子的配位数(m)和氧原子的配位数(n):_______ 。
②写出晶胞中金属原子数(p)和氧原子数(q):________ 。
③写出该金属氧化物的化学式(金属用M表示)__________ 。
(5)向含[cis-Co(NH3)4(H2O)2]3+的溶液中加入氨水,析出含{Co[Co(NH3)4(OH)2]3}6+的难溶盐。{Co[Co(NH3)4(OH)2]3}6+是以羟基为桥键的多核络离子,具有手性。画出其结构____________ 。
(6)向K2Cr2O7和NaCl的混合物中加入浓硫酸制得化合物X(154.9g·mol-1)。X为暗红色液体,沸点117°C,有强刺激性臭味,遇水冒白烟,遇硫燃烧。X分子有两个相互垂直的镜面,两镜面的交线为二重旋转轴。写出X的化学式并画出其结构式___________ 。
(7)实验得到一种含钯化合物Pd[CxHyNz](ClO4)2,该化合物中C和H的质量分数分别为30.15%和5.06%。将此化合物转化为硫氰酸盐Pd[CxHyNz](SCN)2,则C和H的质量分数分别为40.46%和5.94%。通过计算确定Pd[CxHyNz](ClO4)2的组成___________ 。
(8)甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键。甲烷与空气按一定比例混合,氧气的利用率为85%,计算汽车尾气中O2、CO2、H2O和N2的体积比________ 。(空气中O2和N2体积比按21:79计;设尾气中CO2的体积为1)。
(1)Bi2Cl
 离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型
离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型(2)在液氨中,
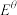 (Na+/Na)=-1.89V,
(Na+/Na)=-1.89V,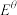 (Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因
(Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因(3)将Pb加到氨基钠的液氨溶液中,先生成白色沉淀Na4Pb,随后转化为Na4Pb9(绿色)而溶解。在此溶液中插入两块铅电极,通直流电,当1.0mol电子通过电解槽时,在哪个电极(阴极或阳极)上沉积出铅
(4)下图是某金属氧化物的晶体结构示意图。图中,小球代表金属原子,大球代表氧原子,细线框处是其晶胞。

①写出金属原子的配位数(m)和氧原子的配位数(n):
②写出晶胞中金属原子数(p)和氧原子数(q):
③写出该金属氧化物的化学式(金属用M表示)
(5)向含[cis-Co(NH3)4(H2O)2]3+的溶液中加入氨水,析出含{Co[Co(NH3)4(OH)2]3}6+的难溶盐。{Co[Co(NH3)4(OH)2]3}6+是以羟基为桥键的多核络离子,具有手性。画出其结构
(6)向K2Cr2O7和NaCl的混合物中加入浓硫酸制得化合物X(154.9g·mol-1)。X为暗红色液体,沸点117°C,有强刺激性臭味,遇水冒白烟,遇硫燃烧。X分子有两个相互垂直的镜面,两镜面的交线为二重旋转轴。写出X的化学式并画出其结构式
(7)实验得到一种含钯化合物Pd[CxHyNz](ClO4)2,该化合物中C和H的质量分数分别为30.15%和5.06%。将此化合物转化为硫氰酸盐Pd[CxHyNz](SCN)2,则C和H的质量分数分别为40.46%和5.94%。通过计算确定Pd[CxHyNz](ClO4)2的组成
(8)甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键。甲烷与空气按一定比例混合,氧气的利用率为85%,计算汽车尾气中O2、CO2、H2O和N2的体积比
您最近一年使用:0次
3 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2, H2与Mg在一定条件下制得储氢物质X。
回答问题: .
(1) Al在周期表中的位置______________ 。基态Zn的价层电子排布式___________ 。
(2)水分了中氧原子的杂化轨道类型_______________ 。
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有_________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是___________________ 。
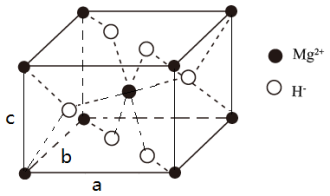
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为______________ , X的储氢质量分数是______________ ,c= ___________ pm (列出计算式即可)。
回答问题: .
(1) Al在周期表中的位置
(2)水分了中氧原子的杂化轨道类型
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为

您最近一年使用:0次
2020-10-12更新
|
4071次组卷
|
5卷引用:2020年海南省高考化学试卷(新高考)
2020年海南省高考化学试卷(新高考)(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)2020年海南卷化学高考真题变式题15-19北京市第一六一中学2021-2022学年高三上学期期中考试化学试题
4 . 维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。请回答下列问题:

(1)以下关于维生素C的说法正确的是_______ (填字母)。
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是_______ (填字母)。
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为_______ 。
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是_______ ,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(5)维生素C是一种易溶于水的有机物,主要原因是_______ 。

(1)以下关于维生素C的说法正确的是
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是
(5)维生素C是一种易溶于水的有机物,主要原因是
您最近一年使用:0次
解题方法
5 . 根据所学物质结构知识,回答下列问题:
(1)氮元素是植物生长所需的元素,常见氮肥有铵盐(NH4+)、尿素 (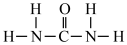 )等,NH4+中H-N-H键角
)等,NH4+中H-N-H键角_______ (填“>”“<”或“=”)。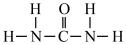 中N-C-N键角。
中N-C-N键角。
(2)硫元素和人类的生存与发展联系密切,在战国时期,我国的炼丹家们就开始了对硫单质及含硫化合物的研究应用。硫单质有多种同素异形体,其中一种单质分子(S8)的结构为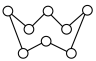 ,其熔点和沸点要比二氧化硫的高很多,主要原因为
,其熔点和沸点要比二氧化硫的高很多,主要原因为___________ 。气态三氧化硫以单分子形式存在,其分子的立体构型为____ 形,实验测得三种氧化物的熔沸点如下,推测固态三氧化硫的分子式为____________ 。
(3)在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O;Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:
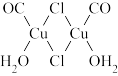
①H2O中氧原子的杂化方式为_____________ ;
②该配合物中,CO作配体时配位原子是C而不是O的原因是______________ 。
(1)氮元素是植物生长所需的元素,常见氮肥有铵盐(NH4+)、尿素 (
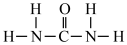 )等,NH4+中H-N-H键角
)等,NH4+中H-N-H键角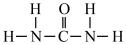 中N-C-N键角。
中N-C-N键角。(2)硫元素和人类的生存与发展联系密切,在战国时期,我国的炼丹家们就开始了对硫单质及含硫化合物的研究应用。硫单质有多种同素异形体,其中一种单质分子(S8)的结构为
 ,其熔点和沸点要比二氧化硫的高很多,主要原因为
,其熔点和沸点要比二氧化硫的高很多,主要原因为| P4O10 | 三氧化硫 | Cl2O7 | |
| 熔点 | 613K | 289K | 182K |
| 沸点 | 633K | 317K | 355K |
(3)在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O;Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:

①H2O中氧原子的杂化方式为
②该配合物中,CO作配体时配位原子是C而不是O的原因是
您最近一年使用:0次
名校
6 . [化学——选修3:物质结构与性质]
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)e原子的价层电子排布图为____________
(2)晶体d、晶体da晶体ac2的熔点由高到低的顺序为____________ (用化学用语表示,下同),a、b、c三种元素的第一电离能由大到小的顺序为________________________ 。
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为____________ ,bc3-离子的空间构型为____________ 。
(4)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体。请写出得到深蓝色透明溶液的离子方程式________________________ ,析出深蓝色晶体时加入乙醇的作用是________________________ 。
(5)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为____________ g·cm3。(用含NA、r的表达式表示)

周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)e原子的价层电子排布图为
(2)晶体d、晶体da晶体ac2的熔点由高到低的顺序为
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为
(4)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体。请写出得到深蓝色透明溶液的离子方程式
(5)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为

您最近一年使用:0次
2020-09-09更新
|
426次组卷
|
3卷引用:【市级联考】四川省内江市2019届高三上学期第一次模拟考试理科综合化学试题
解题方法
7 . 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳原子的电子排布图为___ 。
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为___ 。
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是___ ,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为____ 。
③氨是___ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___ ,氨的沸点高于PH3,原因是___ 。
(3)镍元素基态原子的价电子排布式为___ ,3d能级上的未成对电子数为___ 。
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是___ 。
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=___ nm。
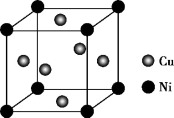
(1)基态碳原子的电子排布图为
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是
③氨是
(3)镍元素基态原子的价电子排布式为
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=

您最近一年使用:0次
2020-02-12更新
|
793次组卷
|
3卷引用:2021年广东省高考化学试卷变式题11-21
2019高三上·全国·专题练习
解题方法
8 . (1)醛基中碳原子的轨道杂化类型是__________ 。
(2)NO2-离子的立体构型是___________ 。
(3)现有H、N、O、 S、Cu几种元素,回答下列问题。
①氢元素和N、O、 S、Cu等元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_____ ;分子中既含有极性共价键、又含有非极性共价键的化合物是______ (填化学式,写出两种)。
②这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_______ ;酸根呈三角锥结构的酸是_______ 。(填化学式)
(4)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中O原子采用_____ 杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_______ 。
(2)NO2-离子的立体构型是
(3)现有H、N、O、 S、Cu几种元素,回答下列问题。
①氢元素和N、O、 S、Cu等元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为
②这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
(4)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中O原子采用
您最近一年使用:0次
2018高三上·全国·专题练习
9 . (1)醛基中碳原子的轨道杂化类型是__________ 。
(2)现有H、N、O、 S、Cu几种元素,回答下列问题。
①氢元素和N、O、 S、Cu等元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_____ ;分子中既含有极性共价键、又含有非极性共价键的化合物是______ (填化学式,写出两种)。
②这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_______ (填化学式);酸根呈三角锥结构的酸是_______ (填化学式)。
(3)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中O原子采用_____ 杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_______ 。
(2)现有H、N、O、 S、Cu几种元素,回答下列问题。
①氢元素和N、O、 S、Cu等元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为
②这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
(3)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中O原子采用
您最近一年使用:0次
名校
10 . X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________ 。
(2)X、Y、Z、W四种元素中,电负性最大的是_________ (填元素符号,下同);同周期元素中,第一电高能介于Y 和Z之间的有__________________ 。
(3)Y 和W的氯化物熔点高的是______ (填化学式),原因是_____________________ ;与Z的低价氯化物互为等电子体的离子是_______ (填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________ ,分子中氮原子的杂化类型有___________________ 。

(5)已知WX的密度为3.25 g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____ 个WX,说明在形成晶体时,半径大的粒子先进行了_______ 方式的堆积,晶胞中距离W最近的X有_____ 个。
(1)Q的基态原子的价层电子排布式为
(2)X、Y、Z、W四种元素中,电负性最大的是
(3)Y 和W的氯化物熔点高的是
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是

(5)已知WX的密度为3.25 g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有
您最近一年使用:0次
2018-05-01更新
|
438次组卷
|
3卷引用:湖南省长沙市雅礼中学、河南省实验中学2018届高三联考理科综合化学试题



