名校
1 . 锰及其化合物用途非常广泛。回答下列问题:
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是___________ 。
(2)基态Mn原子的价电子排布式为_________ ,未成对电子数为_____ 个。
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是____________ 。
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________ 。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____ ,该分子中碳原子的杂化方式为_______ ;C、H、N的电负性从大到小的顺序为________ 。
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是_________ 。
(6)某种含锰特殊材料的晶胞结构如下图所示:
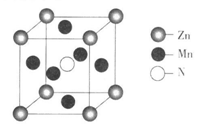
若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为____ ( 列出代数式即可)。
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是
(2)基态Mn原子的价电子排布式为
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是
(6)某种含锰特殊材料的晶胞结构如下图所示:

若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为
您最近一年使用:0次
2018-05-17更新
|
386次组卷
|
2卷引用:【全国市级联考】河南省安阳市2018届高三第三次模拟考试理综化学试题
11-12高三下·上海浦东新·阶段练习
2 . 人体中含量位于前6名的元素依次是:氧、碳、X、氮、钙、磷。根据要求用以上元素完成下列填空:
(1)X是_______ (写元素符号,下同)。能量最高的亚层电子云呈球形的元素有________ 。
(2)形成化合物种类最多的元素的最简氢化物的电子式为_________ ;该分子为非极性分子的原因是________________________________ 。
(3)能证明C、N、O非金属性递变规律的事实是____________ 。
a.最高价氧化物对应水化物的酸性 b.单质与H2反应的难易程度
c.NO2、CO2和C3N4中元素的化合价 d.气态氢化物的稳定性
(4)氮元素的另一种气态氢化物肼可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的。肼燃烧时的能量变化如图所示,则该反应的热化学方程式为_____________ 。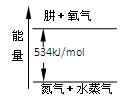
(1)X是
(2)形成化合物种类最多的元素的最简氢化物的电子式为
(3)能证明C、N、O非金属性递变规律的事实是
a.最高价氧化物对应水化物的酸性 b.单质与H2反应的难易程度
c.NO2、CO2和C3N4中元素的化合价 d.气态氢化物的稳定性
(4)氮元素的另一种气态氢化物肼可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的。肼燃烧时的能量变化如图所示,则该反应的热化学方程式为

您最近一年使用:0次
名校
解题方法
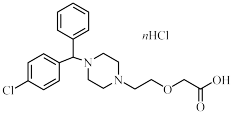
3 . 盐酸左西替利嗪是一种用于治疗荨麻疹的药物。其部分说明书如下:
(1)在左西替利嗪中添加盐酸的目的是___________ ;药品成分中n的值为___________ 。
(2)市售的普通盐酸西替利嗪片也能治疗荨麻疹,而本品仍对西替利嗪的对映体进行分离,其可能原因是___________ 。请在下图中用:“·”标出具有手性的碳原子。___________
| 盐酸左西替利嗪说明书 【成分】本品为西替利嗪的R型对映体,在过量盐酸中结晶制得。 【性状】本品外观是白色或类白色的片剂,易溶于水。
|
(2)市售的普通盐酸西替利嗪片也能治疗荨麻疹,而本品仍对西替利嗪的对映体进行分离,其可能原因是

| A.西替利嗪中,有9个碳原子与氮原子的杂化方式相同 |
| B.将西替利嗪溶于水,形成内盐 |
| C.两个苯环上的12个碳原子共平面 |
| D.分子内含有羧基和酯基 |
您最近一年使用:0次
4 . 氮、碳、硼元素形成的化合物具有独特的结构。请回答:
(1)固态的N2O5为离子晶体(阴阳离子中所含原子个数均不超过4个),其阳离子的空间结构名称为___________ ,阴离子中氮原子的杂化方式为___________ 。
(2)比较酸性强弱:
___________  (填“>”、“<”),请说明理由
(填“>”、“<”),请说明理由___________ 。
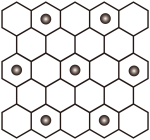
(3)当石墨被过量的K处理后(未反应的金属被汞洗出),K+离子在石墨层间嵌入,K+层在石墨层的投影如图所示。该钾石墨晶体的化学式是___________ ,晶体类型是___________ 。不正确 的是___________。
(5)硼砂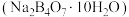 与NaOH的混合溶液中加入H2O2可以制备
与NaOH的混合溶液中加入H2O2可以制备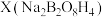 ,已知X的阴离子
,已知X的阴离子 只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式
只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式___________ 。
(1)固态的N2O5为离子晶体(阴阳离子中所含原子个数均不超过4个),其阳离子的空间结构名称为
(2)比较酸性强弱:

 (填“>”、“<”),请说明理由
(填“>”、“<”),请说明理由(3)当石墨被过量的K处理后(未反应的金属被汞洗出),K+离子在石墨层间嵌入,K+层在石墨层的投影如图所示。该钾石墨晶体的化学式是
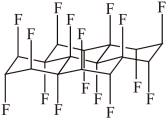
| A.与石墨相比,(CF)x导电性增强 | B.与石墨相比,(CF)x抗氧化性增强 |
| C.(CF)x中C—F的键长比C—C短 | D.1mol(CF)x中含有2x mol共价单键 |
(5)硼砂
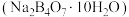 与NaOH的混合溶液中加入H2O2可以制备
与NaOH的混合溶液中加入H2O2可以制备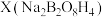 ,已知X的阴离子
,已知X的阴离子 只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式
只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式
您最近一年使用:0次
5 . 铝是常见金属,其合金、化合物在生产生活中有重要应用。请回答:
(1)能量最低的激发态 的核外电子排布式是
的核外电子排布式是___________ 。
(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法不正确 的是___________ 。
A. 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2
B.化学键中离子键成分的百分数: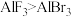
C. 分子中有6对共用电子对
分子中有6对共用电子对
D. 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构
②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是___________ 。
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是___________ 。
(3)AlP 晶胞结构如下图所示:
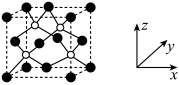
①磷化铝晶胞沿着 y轴的投影图为_________ (填选项字母)。
A. B.
B.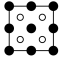 C.
C.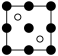 D.
D.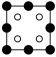
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为_________ g∙cm−3( 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
(1)能量最低的激发态
 的核外电子排布式是
的核外电子排布式是(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法
A.
 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2B.化学键中离子键成分的百分数:
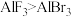
C.
 分子中有6对共用电子对
分子中有6对共用电子对D.
 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是
(3)AlP 晶胞结构如下图所示:

①磷化铝晶胞沿着 y轴的投影图为
A.
 B.
B. C.
C. D.
D.
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为
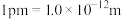 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
您最近一年使用:0次
名校
解题方法
6 . ⅤA族元素(N、P、As、Sb、Bi等)在生活中占有重要地位。请回答:
(1)叠氮酸根离子 的空间结构名称为
的空间结构名称为___________ ;中心氮原子的杂化轨道类型是___________ ;叠氮化钠 用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和
用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和 ,
, 不稳定而分解的原因是
不稳定而分解的原因是___________ 。
(2)实验室测得分子式为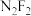 的化合物有两种不同的熔点和沸点:
的化合物有两种不同的熔点和沸点:
B的结构式为___________ 。
(3)已知P可以与Cl形成多种化合物,如: 、
、 、
、 等,下列说法
等,下列说法不正确 的是___________。
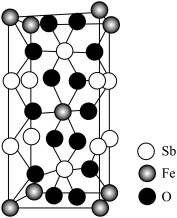
(4)Fe、Sb与O形成的某化合物晶体的晶胞如图。该化合物的化学式为___________ 。
(1)叠氮酸根离子
 的空间结构名称为
的空间结构名称为 用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和
用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和 ,
, 不稳定而分解的原因是
不稳定而分解的原因是(2)实验室测得分子式为
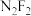 的化合物有两种不同的熔点和沸点:
的化合物有两种不同的熔点和沸点:| 熔点/℃ | 沸点/℃ | |
| A |  | 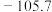 |
| B |  | 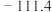 |
(3)已知P可以与Cl形成多种化合物,如:
 、
、 、
、 等,下列说法
等,下列说法A.微粒半径: |
| B.同周期中第一电离能小于P的元素有4种 |
C.根据电负性差异, 的水解产物为 的水解产物为 和 和 |
D.已知 以 以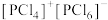 的形式存在,熔融时不导电,可推测熔融时 的形式存在,熔融时不导电,可推测熔融时 可能转化为 可能转化为 |

您最近一年使用:0次
2023-08-08更新
|
561次组卷
|
3卷引用:浙江省杭州市强基联盟2023届高三下学期2月统测化学试题
2023高三·全国·专题练习
7 . 回答下列问题:

(1)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________ 。
A.在I中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是________ 。

(1)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次
2023高三·全国·专题练习
8 . 氮的化合物种类繁多,应用广泛。与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
(1)下列说法不正确 的是_______ 。
(2)氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为______ 。
(3)给出H+的能力:NH3_______ [CuNH3]2+(填“>”或“<”),理由是_______ 。
(1)下列说法
| A.能量最低的激发态N原子的电子排布式:1s22s12p33s1 |
| B.化学键中离子键成分的百分数:Ca3N2>Mg3N2 |
| C.最简单的氮烯分子式:N2H2 |
| D.氮烷中N原子的杂化方式都是sp3 |
(3)给出H+的能力:NH3
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
9 . 填空。
(1)非金属氟化物在生产、生活和科研中应用广泛。
①OF2分子的空间结构为___________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是___________ 。
②Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___________ ,下列对XeF2中心原子杂化方式推断合理的是___________ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。
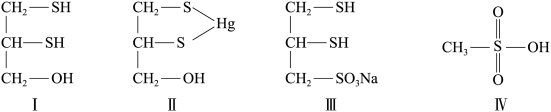
①H2S、CH4、H2O的沸点由高到低顺序为___________ 。
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
③汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是___________ 。
(3)硅和卤素单质反应可以得到SiX4。SiX4的熔、沸点如下表:
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___________ (填化学式),沸点依次升高的原因是___________ ,气态SiX4分子的空间结构是___________ 。
②SiCl4与N甲基咪唑(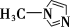 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
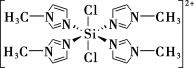
N甲基咪唑分子中碳原子的杂化轨道类型为___________ ,H、C、N的电负性由大到小的顺序为___________ ,1个M2+中含有___________ 个σ键。
(1)非金属氟化物在生产、生活和科研中应用广泛。
①OF2分子的空间结构为
②Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。

①H2S、CH4、H2O的沸点由高到低顺序为
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
③汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是
(3)硅和卤素单质反应可以得到SiX4。SiX4的熔、沸点如下表:
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
②SiCl4与N甲基咪唑(
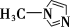 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
N甲基咪唑分子中碳原子的杂化轨道类型为
您最近一年使用:0次
名校
10 . 某化学兴趣小组设计了如图所示装置探究氨的还原性,A为氨气的制备装置。完成下列填空。

(1)下列有关化学用语表示正确的是_______ 。
(2)《天工开物》记载:“凡火药以硝石、硫黄为主,草木灰为辅……而后火药成声”。其中涉及的主要反应为S+2KNO3+3C K2S+3CO2↑+N2↑。下列说法不正确的是
K2S+3CO2↑+N2↑。下列说法不正确的是_______ 。
(3)A中通过加热NH4HCO3固体来制备氨气,除铁架台(含铁夹)和酒精灯外还需用到的是________ (选填下列仪器编号)。

(4)A补充完整后,有同学认为装置在安全性上还存在缺陷,需要在_______ (填编号)连接如图所示装置。

a.A—B间 b.B—C间 c.C—D间 d.D之后
按照改进后的装置进行实验,检验气密性后,先将C处的铂丝加热到红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯继续反应,可观察到的部分现象为:铂丝保持红热,D中溶液变红。
(5)已知NH3与O2反应生成NO与H2O,用单线桥法标出反应的电子转移方向和数目_______ 。
4NH3+5O2 4NO+6H2O
4NO+6H2O
从实验现象可以得出该反应的焓变ΔH_______ 0(选填“>”、“<”或“=”)。
(6)已知D中石蕊溶液变红,原因是_______ (用化学方程式表示)。
(7)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。

下列叙述正确的是_______ 。

(1)下列有关化学用语表示正确的是
A.Ne和N3-的结构示意图均为 | B.过氧化钠的电子式 |
C.氨气的空间填充模型: | D.NH4Br的电子式: |
(2)《天工开物》记载:“凡火药以硝石、硫黄为主,草木灰为辅……而后火药成声”。其中涉及的主要反应为S+2KNO3+3C
 K2S+3CO2↑+N2↑。下列说法不正确的是
K2S+3CO2↑+N2↑。下列说法不正确的是| A.硝石的主要成分是硝酸钾 |
| B.CO2和N2分子中均含有2个σ键 |
| C.第一电离能大小顺序:N>O>S>K |
| D.CO2中心原子采取sp杂化方式 |
(3)A中通过加热NH4HCO3固体来制备氨气,除铁架台(含铁夹)和酒精灯外还需用到的是

(4)A补充完整后,有同学认为装置在安全性上还存在缺陷,需要在

a.A—B间 b.B—C间 c.C—D间 d.D之后
按照改进后的装置进行实验,检验气密性后,先将C处的铂丝加热到红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯继续反应,可观察到的部分现象为:铂丝保持红热,D中溶液变红。
(5)已知NH3与O2反应生成NO与H2O,用单线桥法标出反应的电子转移方向和数目
4NH3+5O2
 4NO+6H2O
4NO+6H2O从实验现象可以得出该反应的焓变ΔH
(6)已知D中石蕊溶液变红,原因是
(7)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。

下列叙述正确的是
| A.雾和霾的分散剂相同 |
| B.HNO3与H2SO4生成无机颗粒物的反应是氧化还原反应 |
| C.NH3是形成无机颗粒物的催化剂 |
| D.雾霾的形成可能与过度施用氮肥有关 |
您最近一年使用:0次