1 . 过氧化钙是重要的化工原料,易溶于酸、难溶于水、乙醇等溶剂,温度在350℃以上容易分解。其主要用作杀菌剂、防腐剂、解酸剂、油类漂白剂等。农业上用作种子及谷物的无毒性消毒剂及鱼池的增氧剂。
(1)过氧化钙工业上常用以下合成路线进行合成。
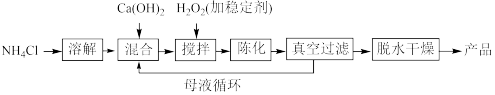
已知:氯化铵的作用是提高Ca2+的浓度。
①反应温度需要控制在常温下产率最高,温度过高或过低都会使产率降低的原因是___________________ ,母液的主要溶质是__________ 。
②整个过程的总化学方程式为_____________________________________________ 。
(2)实验室也可利用反应Ca(s)+O2(g) CaO2(s),在纯氧条件下制取CaO2。其装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2。其装置示意图如下:
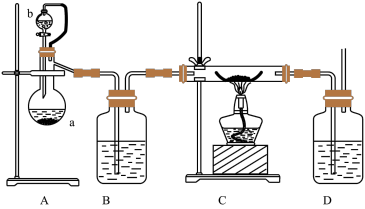
请回答下列问题:
①仪器a的名称为________ ,仪器a上方橡皮管的作用是______________ ,D装置中的试剂为________ 。
②根据完整的实验装置进行实验,实验步骤如下:检验装置的气密性后,装入药品;打开分液漏斗活塞,通入一段时间气体,加热药品;待反应结束后,操作顺序为____________ (填序号);拆除装置,取出产物。
a 停止通入氧气并关闭分液漏斗的活塞 b 熄灭酒精灯 c 反应管冷却至室温
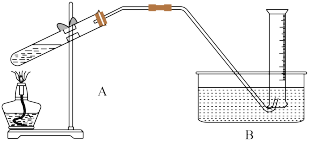
(3)利用如图装置测定反应2CaO2 2CaO+O2↑产品中CaO2含量时,停止反应且冷却至25℃后的装置如图所示。A装置中存在的错误是
2CaO+O2↑产品中CaO2含量时,停止反应且冷却至25℃后的装置如图所示。A装置中存在的错误是___________ ,若B装置直接读数确定25℃、1个标准大气压下气体的体积,则测量结果_______ (填“偏大”、“偏小”或“无影响”)。
(1)过氧化钙工业上常用以下合成路线进行合成。

已知:氯化铵的作用是提高Ca2+的浓度。
①反应温度需要控制在常温下产率最高,温度过高或过低都会使产率降低的原因是
②整个过程的总化学方程式为
(2)实验室也可利用反应Ca(s)+O2(g)
 CaO2(s),在纯氧条件下制取CaO2。其装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2。其装置示意图如下:
请回答下列问题:
①仪器a的名称为
②根据完整的实验装置进行实验,实验步骤如下:检验装置的气密性后,装入药品;打开分液漏斗活塞,通入一段时间气体,加热药品;待反应结束后,操作顺序为
a 停止通入氧气并关闭分液漏斗的活塞 b 熄灭酒精灯 c 反应管冷却至室温
(3)利用如图装置测定反应2CaO2
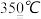 2CaO+O2↑产品中CaO2含量时,停止反应且冷却至25℃后的装置如图所示。A装置中存在的错误是
2CaO+O2↑产品中CaO2含量时,停止反应且冷却至25℃后的装置如图所示。A装置中存在的错误是
您最近一年使用:0次
解题方法
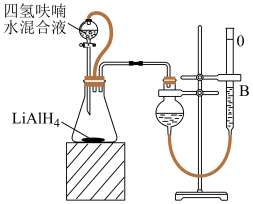
2 . 氢化铝锂 是有机合成中的重要还原剂.某课题组设计实验制备氢化铝锂并测定其纯度.已知:氢化铝锂、氢化锂遇水都剧烈反应.回答下列问题:
是有机合成中的重要还原剂.某课题组设计实验制备氢化铝锂并测定其纯度.已知:氢化铝锂、氢化锂遇水都剧烈反应.回答下列问题:
Ⅰ.制备氢化锂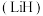 :
:
选择图中的装置制备氢化锂(必要时可重复使用).
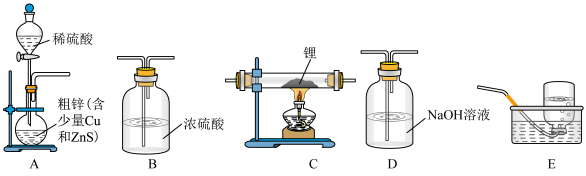
(1)装置 中
中 溶液的作用是
溶液的作用是______________ .
(2)装置的连接顺序(从左至右)为
______________ .
Ⅱ.制备氢化铝锂:1947年,Schlesⅰnger、Bond和Fⅰnholt首次制得氢化铝锂,其流程如下图:
[ 难溶于烃,可溶于乙醚(沸点
难溶于烃,可溶于乙醚(沸点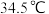 )、四氢呋喃]
)、四氢呋喃]

(3) 能溶于乙醚,和
能溶于乙醚,和 能形成非极性分子
能形成非极性分子 有关,
有关, 所有原子均满足8电子稳定结构,其结构式为
所有原子均满足8电子稳定结构,其结构式为______________ .
(4)氢化锂与无水三氯化铝反应的化学方程式为______________ .
(5)下列说法不正确的是______________(填标号).
(6) (不含
(不含 )纯度可采用如下方法测定(装置如图所示):
)纯度可采用如下方法测定(装置如图所示): ,常压下,准确称取产品
,常压下,准确称取产品 ,记录量气管B起始体积读数
,记录量气管B起始体积读数 ,在分液漏斗中加入过量的四氢呋喃(可减缓
,在分液漏斗中加入过量的四氢呋喃(可减缓 与
与 的反应速率)、水混合液,打开旋塞至滴加完所有液体,关闭旋塞,反应结束后调整量气管
的反应速率)、水混合液,打开旋塞至滴加完所有液体,关闭旋塞,反应结束后调整量气管 ,记录读数为
,记录读数为 ,则:
,则:
① 的质量分数为
的质量分数为______________  (写出计算表达式,用含
(写出计算表达式,用含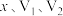 的代数式表达);
的代数式表达);
②恒压分液漏斗的优点有______________ 、______________ .
注:量气管B由碱式滴定管改装; ,常压下气体摩尔体积约为
,常压下气体摩尔体积约为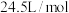 。
。
 是有机合成中的重要还原剂.某课题组设计实验制备氢化铝锂并测定其纯度.已知:氢化铝锂、氢化锂遇水都剧烈反应.回答下列问题:
是有机合成中的重要还原剂.某课题组设计实验制备氢化铝锂并测定其纯度.已知:氢化铝锂、氢化锂遇水都剧烈反应.回答下列问题:Ⅰ.制备氢化锂
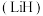 :
:选择图中的装置制备氢化锂(必要时可重复使用).

(1)装置
 中
中 溶液的作用是
溶液的作用是(2)装置的连接顺序(从左至右)为

Ⅱ.制备氢化铝锂:1947年,Schlesⅰnger、Bond和Fⅰnholt首次制得氢化铝锂,其流程如下图:
[
 难溶于烃,可溶于乙醚(沸点
难溶于烃,可溶于乙醚(沸点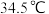 )、四氢呋喃]
)、四氢呋喃]
(3)
 能溶于乙醚,和
能溶于乙醚,和 能形成非极性分子
能形成非极性分子 有关,
有关, 所有原子均满足8电子稳定结构,其结构式为
所有原子均满足8电子稳定结构,其结构式为(4)氢化锂与无水三氯化铝反应的化学方程式为
(5)下列说法不正确的是______________(填标号).
| A.市售乙醚中含少量水,可以加入金属钠,然后蒸馏得无水乙醚 |
| B.一系列操作C涉及过滤操作 |
C.滤渣A的主要成分是 |
D.为提高合成 的速率,可将反应温度提高至 的速率,可将反应温度提高至 |
(6)
 (不含
(不含 )纯度可采用如下方法测定(装置如图所示):
)纯度可采用如下方法测定(装置如图所示): ,常压下,准确称取产品
,常压下,准确称取产品 ,记录量气管B起始体积读数
,记录量气管B起始体积读数 ,在分液漏斗中加入过量的四氢呋喃(可减缓
,在分液漏斗中加入过量的四氢呋喃(可减缓 与
与 的反应速率)、水混合液,打开旋塞至滴加完所有液体,关闭旋塞,反应结束后调整量气管
的反应速率)、水混合液,打开旋塞至滴加完所有液体,关闭旋塞,反应结束后调整量气管 ,记录读数为
,记录读数为 ,则:
,则:
①
 的质量分数为
的质量分数为 (写出计算表达式,用含
(写出计算表达式,用含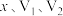 的代数式表达);
的代数式表达);②恒压分液漏斗的优点有
注:量气管B由碱式滴定管改装;
 ,常压下气体摩尔体积约为
,常压下气体摩尔体积约为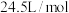 。
。
您最近一年使用:0次
名校
3 . 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如表:
设计实验装置图如图:

(1)A仪器的名称是____ ;图中尾气处理装置不够完善,请你提出改进意见:G、H装置___ 。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:___ ;E中反应的化学方程式:___ 。
(3)C、D中的试剂分别是___ 、____ 。
(4)F的作用是___ 、___ 。
(5)如果在加热E时温度过高,对实验结果的影响是____ 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种)____ ,为了提高S2Cl2的纯度,关键的操作是控制好浓盐酸的滴速不要过快和控制好___ 。
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;300℃以上完全分解;S2Cl2+Cl2 2SCl2 2SCl2 |

(1)A仪器的名称是
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:
(3)C、D中的试剂分别是
(4)F的作用是
(5)如果在加热E时温度过高,对实验结果的影响是
(6)S2Cl2粗品中可能混有的杂质是(填写两种)
您最近一年使用:0次
名校
4 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。

(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
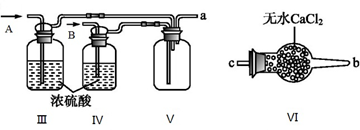
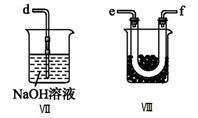
①为了使气体充分反应,从A处进入的气体是____________ (填Cl2或NO)。
②装置连接顺序为a→_______________________ (按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________ 。
④装置Ⅷ的烧杯中盛放的试剂是_____________________ (填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________ 。

(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |


①为了使气体充分反应,从A处进入的气体是
②装置连接顺序为a→
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是
④装置Ⅷ的烧杯中盛放的试剂是
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
2018-03-21更新
|
843次组卷
|
3卷引用:江西省上饶市重点中学2018届高三六校第一次联考理综化学试题



