名校
解题方法
1 . 食盐是日常生活的必需品,也是重要的化工原料。试剂级NaCl可用海盐(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、SO 等杂质)为原料制备。实验室提纯NaCl的流程如图:
等杂质)为原料制备。实验室提纯NaCl的流程如图:
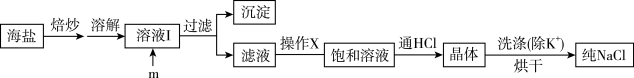
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液I中的Ca2+、Mg2+、Fe3+、 ,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为
,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为_______ 、NaOH、_______ (只填化学式);洗涤除去NaCl晶体表面附带的少量KCl,在提供的试剂中,选用的试剂为_______ 。
(2)操作X为用提纯的NaCl配制500mL 4.00mol/L NaCl溶液,所用的玻璃仪器除烧杯、玻璃棒外还有_______ (填仪器名称)
(3)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
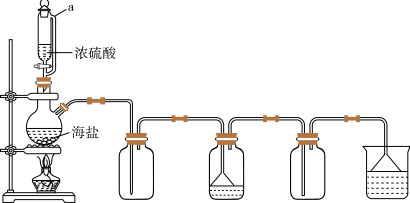
①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是_______ (填编号),相比分液漏斗,选用仪器a的优点是_______ 。
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是_______ 。
(4)设计实验测定NaCl产品中SO 的含量,填写表格。
的含量,填写表格。
 等杂质)为原料制备。实验室提纯NaCl的流程如图:
等杂质)为原料制备。实验室提纯NaCl的流程如图:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液I中的Ca2+、Mg2+、Fe3+、
 ,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为
,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为(2)操作X为用提纯的NaCl配制500mL 4.00mol/L NaCl溶液,所用的玻璃仪器除烧杯、玻璃棒外还有
(3)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是
(4)设计实验测定NaCl产品中SO
 的含量,填写表格。
的含量,填写表格。| 操作 | 目的/结论 | |
| ① | 称取样品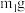 ,加水溶解,加盐酸调至弱酸性,滴加过量c1mol/LBaCl2溶液V1mL ,加水溶解,加盐酸调至弱酸性,滴加过量c1mol/LBaCl2溶液V1mL | 目的: |
| ② | 过滤洗涤,干燥后称得沉淀为m2g | 结论:样品中SO 的质量分数为 的质量分数为 |
您最近一年使用:0次
2021-04-11更新
|
275次组卷
|
3卷引用:上海市青浦区2021届高三等级考二模化学试题
2 . 氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,可由反应:Hg+2NH3+Cl2==Hg(NH2)Cl↓+NH4Cl制备,某学习小组在实验室中利用下列装置制备氯化氨基汞,回答下列问题。
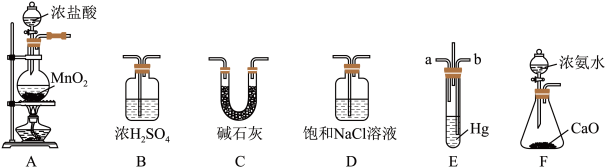
(1)A中发生反应的离子方程式为____________ 。
(2)F中发生反应的化学方程式为_________ 。
(3)盛装碱石灰的仪器名称为________ ,其作用为__________ 。
(4)整个装置的仪器连接顺序为A→________ (装置不能重复使用)。该实验的不足之处是__________ 。
(5)E中短导管a通入的气体是__________ ,导管ab采用长短不同的原因是__________ 。
(6)氯化氨基汞产品中氯化氨基汞的含量测定:称取ag样品,加入水及稀硫酸溶解向溶解后的溶液中加入0.1mol/L KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知Hg2++2I—=HgI2↓(橙红色),HgI2+2I—=HgI42—(无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为__________

(1)A中发生反应的离子方程式为
(2)F中发生反应的化学方程式为
(3)盛装碱石灰的仪器名称为
(4)整个装置的仪器连接顺序为A→
(5)E中短导管a通入的气体是
(6)氯化氨基汞产品中氯化氨基汞的含量测定:称取ag样品,加入水及稀硫酸溶解向溶解后的溶液中加入0.1mol/L KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知Hg2++2I—=HgI2↓(橙红色),HgI2+2I—=HgI42—(无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为
您最近一年使用:0次
2019-05-31更新
|
631次组卷
|
2卷引用:【市级联考】福建省福州市2019届高三第三次质量检测理科综合化学试题
解题方法
3 . 氢化铝锂 是有机合成中的重要还原剂.某课题组设计实验制备氢化铝锂并测定其纯度.已知:氢化铝锂、氢化锂遇水都剧烈反应.回答下列问题:
是有机合成中的重要还原剂.某课题组设计实验制备氢化铝锂并测定其纯度.已知:氢化铝锂、氢化锂遇水都剧烈反应.回答下列问题:
Ⅰ.制备氢化锂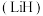 :
:
选择图中的装置制备氢化锂(必要时可重复使用).
(1)装置 中
中 溶液的作用是
溶液的作用是______________ .
(2)装置的连接顺序(从左至右)为
______________ .
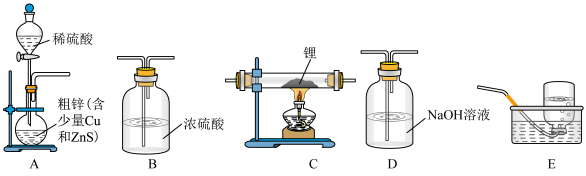
Ⅱ.制备氢化铝锂:1947年,Schlesⅰnger、Bond和Fⅰnholt首次制得氢化铝锂,其流程如下图:
[ 难溶于烃,可溶于乙醚(沸点
难溶于烃,可溶于乙醚(沸点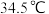 )、四氢呋喃]
)、四氢呋喃]

(3) 能溶于乙醚,和
能溶于乙醚,和 能形成非极性分子
能形成非极性分子 有关,
有关, 所有原子均满足8电子稳定结构,其结构式为
所有原子均满足8电子稳定结构,其结构式为______________ .
(4)氢化锂与无水三氯化铝反应的化学方程式为______________ .
(5)下列说法不正确的是______________(填标号).
(6) (不含
(不含 )纯度可采用如下方法测定(装置如图所示):
)纯度可采用如下方法测定(装置如图所示): ,常压下,准确称取产品
,常压下,准确称取产品 ,记录量气管B起始体积读数
,记录量气管B起始体积读数 ,在分液漏斗中加入过量的四氢呋喃(可减缓
,在分液漏斗中加入过量的四氢呋喃(可减缓 与
与 的反应速率)、水混合液,打开旋塞至滴加完所有液体,关闭旋塞,反应结束后调整量气管
的反应速率)、水混合液,打开旋塞至滴加完所有液体,关闭旋塞,反应结束后调整量气管 ,记录读数为
,记录读数为 ,则:
,则:
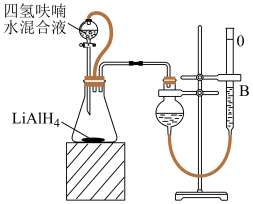
① 的质量分数为
的质量分数为______________  (写出计算表达式,用含
(写出计算表达式,用含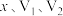 的代数式表达);
的代数式表达);
②恒压分液漏斗的优点有______________ 、______________ .
注:量气管B由碱式滴定管改装; ,常压下气体摩尔体积约为
,常压下气体摩尔体积约为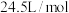 。
。
 是有机合成中的重要还原剂.某课题组设计实验制备氢化铝锂并测定其纯度.已知:氢化铝锂、氢化锂遇水都剧烈反应.回答下列问题:
是有机合成中的重要还原剂.某课题组设计实验制备氢化铝锂并测定其纯度.已知:氢化铝锂、氢化锂遇水都剧烈反应.回答下列问题:Ⅰ.制备氢化锂
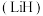 :
:选择图中的装置制备氢化锂(必要时可重复使用).

(1)装置
 中
中 溶液的作用是
溶液的作用是(2)装置的连接顺序(从左至右)为

Ⅱ.制备氢化铝锂:1947年,Schlesⅰnger、Bond和Fⅰnholt首次制得氢化铝锂,其流程如下图:
[
 难溶于烃,可溶于乙醚(沸点
难溶于烃,可溶于乙醚(沸点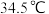 )、四氢呋喃]
)、四氢呋喃]
(3)
 能溶于乙醚,和
能溶于乙醚,和 能形成非极性分子
能形成非极性分子 有关,
有关, 所有原子均满足8电子稳定结构,其结构式为
所有原子均满足8电子稳定结构,其结构式为(4)氢化锂与无水三氯化铝反应的化学方程式为
(5)下列说法不正确的是______________(填标号).
| A.市售乙醚中含少量水,可以加入金属钠,然后蒸馏得无水乙醚 |
| B.一系列操作C涉及过滤操作 |
C.滤渣A的主要成分是 |
D.为提高合成 的速率,可将反应温度提高至 的速率,可将反应温度提高至 |
(6)
 (不含
(不含 )纯度可采用如下方法测定(装置如图所示):
)纯度可采用如下方法测定(装置如图所示): ,常压下,准确称取产品
,常压下,准确称取产品 ,记录量气管B起始体积读数
,记录量气管B起始体积读数 ,在分液漏斗中加入过量的四氢呋喃(可减缓
,在分液漏斗中加入过量的四氢呋喃(可减缓 与
与 的反应速率)、水混合液,打开旋塞至滴加完所有液体,关闭旋塞,反应结束后调整量气管
的反应速率)、水混合液,打开旋塞至滴加完所有液体,关闭旋塞,反应结束后调整量气管 ,记录读数为
,记录读数为 ,则:
,则:
①
 的质量分数为
的质量分数为 (写出计算表达式,用含
(写出计算表达式,用含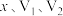 的代数式表达);
的代数式表达);②恒压分液漏斗的优点有
注:量气管B由碱式滴定管改装;
 ,常压下气体摩尔体积约为
,常压下气体摩尔体积约为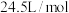 。
。
您最近一年使用:0次
解题方法
4 . 工业上制硫化钡普遍采用两种方法:一种为重晶石( BaSO4)煤粉还原法(将重晶石和无烟煤混合后在1000-1200° C下还原焙烧1~2h);另一种为气体还原法(将重晶石在850-900°C通入氢气进行还原反应)。下列是实验室模拟高温下H2还原重晶石法,装置如下。

回答下列问题:
(1)固体A的名称_______ 。
(2)H2与BaSO4反应生成BaS,写出该反应的化学方程式_______ 。
(3)打开活塞K之后,管式炉升温之前,必须进行的操作为_______ 。
(4)测定BaS质量分数:
取生成物10.00g,溶于蒸馏水后稀释至500mL;取25.00mL溶液于锥形瓶中,再加入10mL2%醋酸溶液及10.00 mL 0.50 mol/L KI3标准溶液(过量),充分振荡、使BaS中的硫元素完全转化为硫单质;向锥形瓶中加入2滴淀粉溶液做指示剂,用0.50mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积10.00mL(滴定反应为: +2
+2 =3I-+
=3I-+ )。
)。
①稀释至500mL所需的玻璃仪器有烧杯、胶头滴管、_______ 和______
②写出KI3与BaS反应的化学方程式_______ 。
③醋酸溶液加多了会导致测定结果偏小,原因可能是_______ 。
④计算样品中BaS(M=169g/mol)质量分数:_______ (保留3位有效数字)。
⑤若用重晶石煤粉还原法制BaS,其产品纯度_______ (填“升高”或“降低” )。

回答下列问题:
(1)固体A的名称
(2)H2与BaSO4反应生成BaS,写出该反应的化学方程式
(3)打开活塞K之后,管式炉升温之前,必须进行的操作为
(4)测定BaS质量分数:
取生成物10.00g,溶于蒸馏水后稀释至500mL;取25.00mL溶液于锥形瓶中,再加入10mL2%醋酸溶液及10.00 mL 0.50 mol/L KI3标准溶液(过量),充分振荡、使BaS中的硫元素完全转化为硫单质;向锥形瓶中加入2滴淀粉溶液做指示剂,用0.50mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积10.00mL(滴定反应为:
 +2
+2 =3I-+
=3I-+ )。
)。①稀释至500mL所需的玻璃仪器有烧杯、胶头滴管、
②写出KI3与BaS反应的化学方程式
③醋酸溶液加多了会导致测定结果偏小,原因可能是
④计算样品中BaS(M=169g/mol)质量分数:
⑤若用重晶石煤粉还原法制BaS,其产品纯度
您最近一年使用:0次
名校
5 . 孔雀石的主要成分为xCuCO3•yCu(OH)2•zH2O,为测定其中CuCO3的质量分数,称取a g样品进行实验。下列实验方案可行的是
| A.充分加热样品,用碱石灰吸收逸出气体,增重b g |
| B.加热至样品质量不再发生变化,称得其质量为b g |
| C.向样品中加入足量的稀盐酸,用排水法收集逸出气体,得b mL气体 |
| D.向样品中加入足量的稀盐酸,充分反应,将生成的气体全部通入到足量Ba(OH)2溶液中,过滤、洗涤、烘干,得b g固体 |
您最近一年使用:0次
2023-04-26更新
|
299次组卷
|
3卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
解题方法
6 . 实验室利用四氯化钛气相氧化法制备二氧化钛,装置如图(部分夹持装置已略去)。已知: 的熔点为-24.1℃,沸点为136.4℃,在潮湿空气中易水解。回答下列问题:
的熔点为-24.1℃,沸点为136.4℃,在潮湿空气中易水解。回答下列问题:

(1)装置C中仪器a的名称为_______ ,实验装置从左到右的连接顺序为_______ ,D装置的作用为_______ ,C装置的加热方式为_______ 。
a.温水浴 b.油浴(100-260℃) c.热水浴 d.沙浴温度(400-600℃)
(2)写出B装置三颈烧瓶内发生反应的化学方程式_______ 。
(3)测定 产品中钛含量的方法是:精确称取0.2000 g样品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含
产品中钛含量的方法是:精确称取0.2000 g样品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含 的溶液。加入金属铝,将
的溶液。加入金属铝,将 全部转化为
全部转化为 ,加入指示剂,用0.1000 mol·L
,加入指示剂,用0.1000 mol·L
 溶液滴定至终点。重复操作2次,消耗0.1000 mol·L
溶液滴定至终点。重复操作2次,消耗0.1000 mol·L
 溶液的平均值为20.00 mL(已知:
溶液的平均值为20.00 mL(已知: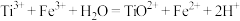 )。
)。
①配制 标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的
标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_______ (填字母代号)。

②滴定时所用的指示剂为_______ ,产品中钛的质量分数为_______ 。
 的熔点为-24.1℃,沸点为136.4℃,在潮湿空气中易水解。回答下列问题:
的熔点为-24.1℃,沸点为136.4℃,在潮湿空气中易水解。回答下列问题:
(1)装置C中仪器a的名称为
a.温水浴 b.油浴(100-260℃) c.热水浴 d.沙浴温度(400-600℃)
(2)写出B装置三颈烧瓶内发生反应的化学方程式
(3)测定
 产品中钛含量的方法是:精确称取0.2000 g样品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含
产品中钛含量的方法是:精确称取0.2000 g样品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含 的溶液。加入金属铝,将
的溶液。加入金属铝,将 全部转化为
全部转化为 ,加入指示剂,用0.1000 mol·L
,加入指示剂,用0.1000 mol·L
 溶液滴定至终点。重复操作2次,消耗0.1000 mol·L
溶液滴定至终点。重复操作2次,消耗0.1000 mol·L
 溶液的平均值为20.00 mL(已知:
溶液的平均值为20.00 mL(已知: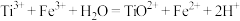 )。
)。①配制
 标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的
标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的
②滴定时所用的指示剂为
您最近一年使用:0次
2023-03-03更新
|
782次组卷
|
3卷引用:山东省济宁市2023届高三一模考试(3月)化学试题
解题方法
7 . 下列实验装置能达到实验目的的是
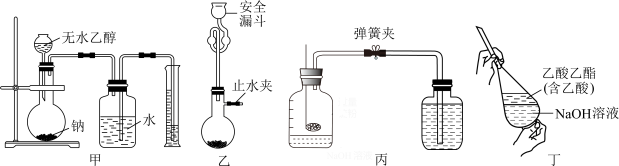
| A.装置甲测定乙醇结构 |
| B.装置乙制取少量CO2 |
| C.装置丙红磷燃烧测定空气中氧气的含量 |
| D.装置丁提纯乙酸乙酯 |
您最近一年使用:0次
2022-05-15更新
|
568次组卷
|
2卷引用:湖北武汉市2022届高三5月第一次模拟考试化学试题
8 . SO2和焦亚硫酸钠(Na2S2O5)可用作食品添加剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为_______ 。欲净化与收集SO2,选择必要装置,按气流方向连接顺序为_______ (填仪器接口的字母编号)。
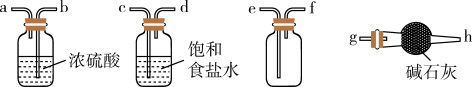
(2)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
已知:2NaHSO3 Na2S2O5+H2O。
Na2S2O5+H2O。
试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(3)某小组利用下列装置测定空气中SO2的含量。
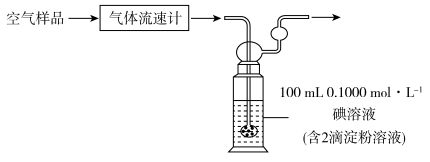
已知该反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI。若空气流速为a m3·min-1,当观察到_______ 时,结束计时,测定耗时t min。假定样品中的SO2可被溶液充分吸收,该空气样品中SO2的含量是_______ mg·m-3。
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为

(2)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
已知:2NaHSO3
 Na2S2O5+H2O。
Na2S2O5+H2O。试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
| II | 取实验I的溶液, | 样品已氧化变质 | |
| III | 另取实验I的溶液, | 样品未完全氧化变质 |

已知该反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI。若空气流速为a m3·min-1,当观察到
您最近一年使用:0次
2022-04-22更新
|
1288次组卷
|
5卷引用:广东省广州市2022届高三下学期二模综合测试化学试题
广东省广州市2022届高三下学期二模综合测试化学试题(已下线)化学-2022年高考押题预测卷01(天津卷)(已下线)押广东卷化学第17题 化学实验综合题-备战2022年高考化学临考题号押题(广东卷)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)超重点10 高考必考元素——氧、硫
9 . 某化学小组同学利用一定浓度的H2O2溶液制备O2,再用O2氧化C2H5OH,并检验氧化产物。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)

(1)甲装置中主要仪器的名称为___________ 。
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至___________ 。欲使反应停止,关闭活塞K1即可,此时装置中的现象是___________ 。
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________ ,此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是___________ 。
(4)丙装置的特点是___________ (填序号)。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)
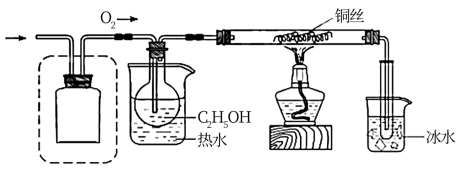
(5)在图中方框内补全干燥装置和干燥剂。___________
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是___________ (填序号),原因是___________ 。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)

(1)甲装置中主要仪器的名称为
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
(4)丙装置的特点是
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)

(5)在图中方框内补全干燥装置和干燥剂。
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
| 实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
| ① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙醛 |
| ② | 新制Cu(OH)2,加热 | 生成砖红色沉淀 | 产物含有乙醛 |
| ③ | 微红色含酚酞的NaOH溶液 | 微红色褪去 | 产物可能含有乙酸 |
您最近一年使用:0次
2021-09-07更新
|
8632次组卷
|
14卷引用:2021年天津高考化学试题变式题13-16
2021年天津高考化学试题变式题13-162021年新高考天津化学高考真题(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点10 综合实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题44 以气体制备为主体的实验-备战2023年高考化学一轮复习考点微专题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型182 综合实验突破天津市南开中学2022-2023学年高三下学期第四次月考化学试题(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)微专题 仪器的组合与创新使用
解题方法
10 . 无水氯化铝是有机化工常用的催化剂,178℃时升华,极易潮解。某化学兴趣小组设计下列不同实验方案制取无水氯化铝。
【实验1】利用置换反应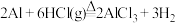 制备少量无水氯化铝,实验装置如图:
制备少量无水氯化铝,实验装置如图:
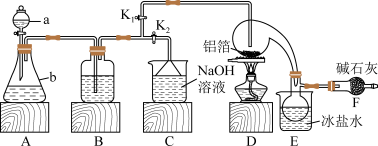
(1)若a、b、B三装置中的试剂均为酸的浓溶液。为了均匀、缓慢产生 气体,将a中液体逐滴加入b中。则a、b、B三个装置中的试剂依次为
气体,将a中液体逐滴加入b中。则a、b、B三个装置中的试剂依次为___________ 、___________ 、___________ 。
(2)实验时,检验装置气密性后,向D装置的曲颈瓶中加入铝箔,连接好装置,接下来有关 、
、 的操作是
的操作是___________ ,然后加热D装置。
(3)F中干燥管内碱石灰的作用是___________ 。
【实验2】仍采用上述装置,将D中固体改用氯化铝晶体( )来制备无水氯化铝。
)来制备无水氯化铝。
(4)此实验仍需通入 气体的原因是
气体的原因是___________ 。
(5)通过实验发现,得到的物质是碱式氯化铝[化学式为 ],测定实验所得产物氯元素的含量,从而确定产物中羟基(-
],测定实验所得产物氯元素的含量,从而确定产物中羟基(- )的含量,实验步骤如下:
)的含量,实验步骤如下:
i.称取 产品置于烧杯中,充分溶解;
产品置于烧杯中,充分溶解;
ii.加入足量硝酸酸化的硝酸银溶液,充分反应后,过滤;
iii.洗涤沉淀,干燥至恒重,称得沉淀质量为 。
。
①若步骤iii的操作中未洗涤、干燥沉淀,将导致测得的羟基(- )含量
)含量___________ (填“偏高”“偏低”或“不变”)。
②若测得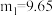 ,
,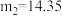 ,则所得产品
,则所得产品 中
中 值为
值为___________ 。
【实验1】利用置换反应
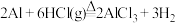 制备少量无水氯化铝,实验装置如图:
制备少量无水氯化铝,实验装置如图:
(1)若a、b、B三装置中的试剂均为酸的浓溶液。为了均匀、缓慢产生
 气体,将a中液体逐滴加入b中。则a、b、B三个装置中的试剂依次为
气体,将a中液体逐滴加入b中。则a、b、B三个装置中的试剂依次为(2)实验时,检验装置气密性后,向D装置的曲颈瓶中加入铝箔,连接好装置,接下来有关
 、
、 的操作是
的操作是(3)F中干燥管内碱石灰的作用是
【实验2】仍采用上述装置,将D中固体改用氯化铝晶体(
 )来制备无水氯化铝。
)来制备无水氯化铝。(4)此实验仍需通入
 气体的原因是
气体的原因是(5)通过实验发现,得到的物质是碱式氯化铝[化学式为
 ],测定实验所得产物氯元素的含量,从而确定产物中羟基(-
],测定实验所得产物氯元素的含量,从而确定产物中羟基(- )的含量,实验步骤如下:
)的含量,实验步骤如下:i.称取
 产品置于烧杯中,充分溶解;
产品置于烧杯中,充分溶解;ii.加入足量硝酸酸化的硝酸银溶液,充分反应后,过滤;
iii.洗涤沉淀,干燥至恒重,称得沉淀质量为
 。
。①若步骤iii的操作中未洗涤、干燥沉淀,将导致测得的羟基(-
 )含量
)含量②若测得
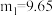 ,
,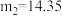 ,则所得产品
,则所得产品 中
中 值为
值为
您最近一年使用:0次



