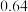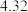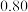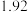解题方法
1 . 某实验小组拟探究铁的化合物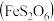 的分解产物,设计如下实验。已知几种物质的物理性质如下表所示。
的分解产物,设计如下实验。已知几种物质的物理性质如下表所示。
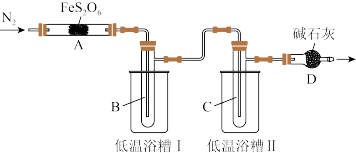
实验装置如图所示 加热和夹持装置省略
加热和夹持装置省略 。
。
回答下列问题:
(1)点燃酒精灯之前,通入一段时间 ,其目的是
,其目的是______________ 。
(2)低温浴槽II控制的温度范围为_____ 。
(3)甲、乙、丙三组分别进行实验,测得相关实验数据如下 不考虑损失且不考虑
不考虑损失且不考虑 的存在,固体已完全分解
的存在,固体已完全分解 :
:
 根据实验数据分析,甲组实验中
根据实验数据分析,甲组实验中 装置得到的纯净固体产物是
装置得到的纯净固体产物是________________  填化学式
填化学式 。
。
 经检测,乙组实验的固体产物为纯净物,写出
经检测,乙组实验的固体产物为纯净物,写出 中发生的化学反应方程式:
中发生的化学反应方程式:_________________ 。
(4)为了进一步分析丙组实验得到的固体纯净物成分,他们取少量固体溶于稀硫酸中,将溶液分成两份,进行如下实验 不考虑
不考虑 的存在
的存在 :
:
根据实验推知,丙组实验中 分解生成的固体产物、
分解生成的固体产物、 、
、 的物质的量之比为
的物质的量之比为_________ 。
(5)为了进一步探究气体产物成分,将 仪器导出的气体通入酸化的
仪器导出的气体通入酸化的 淀粉溶液中,一段时间后,若
淀粉溶液中,一段时间后,若________________________________  填实验现象
填实验现象 ,则说明有
,则说明有 生成。
生成。
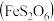 的分解产物,设计如下实验。已知几种物质的物理性质如下表所示。
的分解产物,设计如下实验。已知几种物质的物理性质如下表所示。| 物质 |
|
|
|
熔点 |
|
|
|
沸点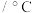 |
|
|
|
 加热和夹持装置省略
加热和夹持装置省略 。
。
回答下列问题:
(1)点燃酒精灯之前,通入一段时间
 ,其目的是
,其目的是(2)低温浴槽II控制的温度范围为
(3)甲、乙、丙三组分别进行实验,测得相关实验数据如下
 不考虑损失且不考虑
不考虑损失且不考虑 的存在,固体已完全分解
的存在,固体已完全分解 :
:
|
| 低温浴槽 | 低温浴槽 | |
甲 |
|
|
|
|
乙 |
|
|
|
|
丙 |
|
|
|
|
 根据实验数据分析,甲组实验中
根据实验数据分析,甲组实验中 装置得到的纯净固体产物是
装置得到的纯净固体产物是 填化学式
填化学式 。
。 经检测,乙组实验的固体产物为纯净物,写出
经检测,乙组实验的固体产物为纯净物,写出 中发生的化学反应方程式:
中发生的化学反应方程式:(4)为了进一步分析丙组实验得到的固体纯净物成分,他们取少量固体溶于稀硫酸中,将溶液分成两份,进行如下实验
 不考虑
不考虑 的存在
的存在 :
:| 实验 | 操作 | 现象 |
 | 在一份溶液中滴加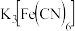 溶液 溶液 | 产生蓝色沉淀 |
 | 在另一份溶液中滴加 溶液 溶液 | 溶液变红色 |
 分解生成的固体产物、
分解生成的固体产物、 、
、 的物质的量之比为
的物质的量之比为(5)为了进一步探究气体产物成分,将
 仪器导出的气体通入酸化的
仪器导出的气体通入酸化的 淀粉溶液中,一段时间后,若
淀粉溶液中,一段时间后,若 填实验现象
填实验现象 ,则说明有
,则说明有 生成。
生成。
您最近一年使用:0次
名校
解题方法
2 . 下图是某同学设计的木炭和浓硫酸反应并检验所得产物的实验装置。
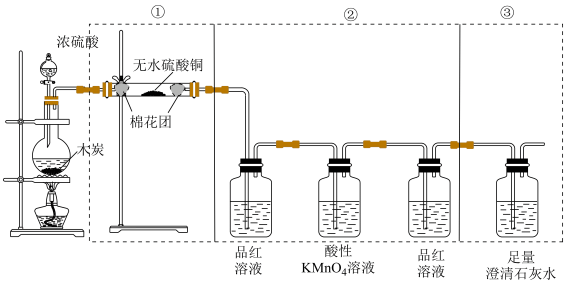
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:___________ 。
(2)②中酸性 溶液的作用是
溶液的作用是___________ ,第二瓶品红溶液的作用是___________ 。
(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是______ ;不能检出的物质是________ 。
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是___________ ;不能检出的物质是___________ 。
(5)有同学希望通过测量③中装置质量的增加来计算反应的木炭的质量,则在②③之间插入一个洗气瓶,其中装___________ (填写试剂名称)。

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(2)②中酸性
 溶液的作用是
溶液的作用是(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是
(5)有同学希望通过测量③中装置质量的增加来计算反应的木炭的质量,则在②③之间插入一个洗气瓶,其中装
您最近一年使用:0次
3 . 某固体混合物,可能含有FeSO4、CuSO4、MgBr2、Na2SO3和KCl中的几种,进行如下实验:
①取样溶于水,得澄清透明溶液
②样品溶液中滴加过量氯水,再滴加过量BaCl2溶液,得白色沉淀1,过滤,将滤液一分为二
③往其中一份滤液中加入CCl4,振荡,溶液分层,上层用淀粉-KI试纸检验呈蓝色,下层呈橙红色
④另一份滤液中加入过量的NaOH,得沉淀2,用盐酸完全溶解沉淀2,滴加Na2S溶液,可见淡黄色浑浊
下列判断不正确的是( )
①取样溶于水,得澄清透明溶液
②样品溶液中滴加过量氯水,再滴加过量BaCl2溶液,得白色沉淀1,过滤,将滤液一分为二
③往其中一份滤液中加入CCl4,振荡,溶液分层,上层用淀粉-KI试纸检验呈蓝色,下层呈橙红色
④另一份滤液中加入过量的NaOH,得沉淀2,用盐酸完全溶解沉淀2,滴加Na2S溶液,可见淡黄色浑浊
下列判断不正确的是( )
| A.沉淀2中既有氢氧化镁也有氢氧化铁 |
| B.固体混合物中一定不存在Na2SO3 |
| C.由淀粉-KI试纸检验呈蓝色可知一定有FeSO4 |
| D.固体混合物中不存在CuSO4 |
您最近一年使用:0次
名校
解题方法
4 . 学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
(1)用离子方程式表示i中品红溶液褪色的原因:______ 。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_______ 。
(3)ⅰ是iii的对比实验,目的是排除iii中______ 造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:

①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_______ 。
②FeCl2溶液的作用是_______ 。由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:

①结合离子方程式解释加入饱和NaCl溶液的目的:_______ 。
②推测品红溶液褪色的速率:实验iii比实验v______ (填“快”或 “慢”)。
实验记录如下:
 | 实验 | 方案和现象 |
| ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
| ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
| ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是
(3)ⅰ是iii的对比实验,目的是排除iii中
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:

①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是
②FeCl2溶液的作用是
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:

①结合离子方程式解释加入饱和NaCl溶液的目的:
②推测品红溶液褪色的速率:实验iii比实验v
您最近一年使用:0次
2020-05-10更新
|
366次组卷
|
5卷引用:北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题
北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市朝阳区2020届高三学业水平等级性考试练习化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究黑龙江省嫩江市高级中学2021届高三上学期模拟考试化学试题北京市海淀区中关村中学2021-2022学年高三上学期10月月考化学试题
5 . 甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2溶液、盐酸四种无色溶液中的一种,现进行了如图所示的实验。
(1)通过上述实验判断出各物质:甲___ 、乙___ 、丙___ 、丁____ 。写出甲与乙反应的离子方程式:___ 。
(2)实验室有一瓶标签破损(如图所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确?_____ (填“正确”或“不正确”)。若正确,请写出相应反应的离子方程式__________ ;若不正确, 请说明可能的结论:_______ (填物质的化学式)。

(1)通过上述实验判断出各物质:甲
(2)实验室有一瓶标签破损(如图所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确?

您最近一年使用:0次
2019-11-15更新
|
113次组卷
|
2卷引用:福建省厦门外国语学校2019-2020学年高一上学期期中考试化学试题
6 . 以下是利用主要成分为Cu2S和Fe2O3的工业废弃固体(其他成分不参与反应)制备有关物质,实验流程如图所示:

回答下列问题:
(1)气体X的化学式为____________________ 。
(2)加入铁粉时发生反应的离子方程式为:2H++Fe Fe2++H2↑、
Fe2++H2↑、______________________ 。
(3)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量绿矾后随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O、___________________ 。
(4)除杂时,需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,则氧化剂及试剂Y可以是__________ (填编号)。
a.H2O2、CuO b.HNO3、Cu(OH)2
c.KMnO4、CuCl2 d.漂白粉、CuCO3
(5)无水硫酸铜受热分解生成氧化铜和气体,受热温度不同气体可能为SO3、SO2和O2中的一种、两种或三种。现设计如下实验测定产生的SO2、SO3和O2的物质的量,并计算各物质的化学计量数,从而确定CuSO4分解的化学方程式(已知实验结束时,硫酸铜完全分解)。

①仪器C的名称是__________ 。
②组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
①→⑨→⑩→⑥→⑤→____ →_____ →_____ →_____ →②(填接口序号)。仪器F的作用是_________ 。
③若某小组称取6.4g无水CuSO4,实验过程中装置C增加的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,请通过计算确定实验条件下CuSO4分解的化学方程式:________________________ 。

回答下列问题:
(1)气体X的化学式为
(2)加入铁粉时发生反应的离子方程式为:2H++Fe
 Fe2++H2↑、
Fe2++H2↑、(3)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量绿矾后随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O、
(4)除杂时,需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,则氧化剂及试剂Y可以是
a.H2O2、CuO b.HNO3、Cu(OH)2
c.KMnO4、CuCl2 d.漂白粉、CuCO3
(5)无水硫酸铜受热分解生成氧化铜和气体,受热温度不同气体可能为SO3、SO2和O2中的一种、两种或三种。现设计如下实验测定产生的SO2、SO3和O2的物质的量,并计算各物质的化学计量数,从而确定CuSO4分解的化学方程式(已知实验结束时,硫酸铜完全分解)。

①仪器C的名称是
②组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
①→⑨→⑩→⑥→⑤→
③若某小组称取6.4g无水CuSO4,实验过程中装置C增加的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,请通过计算确定实验条件下CuSO4分解的化学方程式:
您最近一年使用:0次

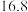

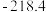

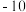
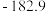
 净增质量
净增质量 净增质量
净增质量