1 . 硫酸镍(NiSO4)是电镀镍工业所用的主要镍盐,易溶于水。下图为某兴趣小组设计的在实验室中制备NiSO4·6H2O的装置。
(1)该小组同学查阅资料发现用镍粉与混酸制备NiSO4成本高,用冶铁尾矿提取的草酸镍(NiC2O4)与硫酸制取NiSO4成本较低。反应原理为:NiC2O4 NiO+CO↑+CO2↑,NiO+H2SO4=NiSO4+H2O(已知PdCl2溶液能够吸收CO)。现加热NiC2O4制备NiO,并检验生成的CO,可能用到的装置如下:
NiO+CO↑+CO2↑,NiO+H2SO4=NiSO4+H2O(已知PdCl2溶液能够吸收CO)。现加热NiC2O4制备NiO,并检验生成的CO,可能用到的装置如下:________ 。
_______→_______→_______→f→_______→_______→_______
②能够说明生成CO的现象有_______ 。
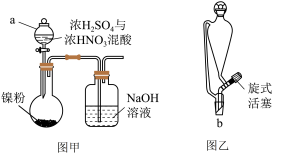
(1)该小组同学查阅资料发现用镍粉与混酸制备NiSO4成本高,用冶铁尾矿提取的草酸镍(NiC2O4)与硫酸制取NiSO4成本较低。反应原理为:NiC2O4
 NiO+CO↑+CO2↑,NiO+H2SO4=NiSO4+H2O(已知PdCl2溶液能够吸收CO)。现加热NiC2O4制备NiO,并检验生成的CO,可能用到的装置如下:
NiO+CO↑+CO2↑,NiO+H2SO4=NiSO4+H2O(已知PdCl2溶液能够吸收CO)。现加热NiC2O4制备NiO,并检验生成的CO,可能用到的装置如下: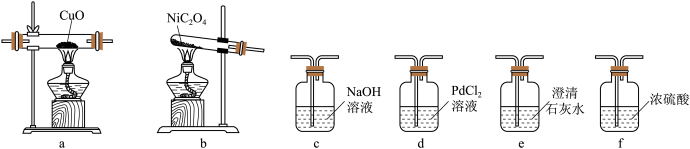
_______→_______→_______→f→_______→_______→_______
②能够说明生成CO的现象有
您最近一年使用:0次
名校
2 . 用如图所示实验装置进行相关实验探究,实验设计合理并能达到实验目的的是
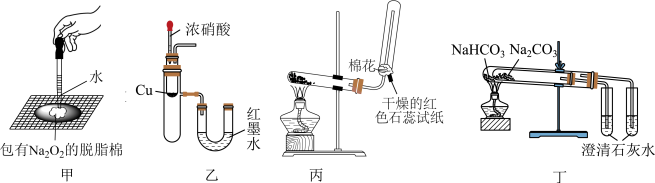

| A.装置甲验证Na2O2与水反应放热 |
| B.装置乙验证Cu与浓硝酸反应的热量变化 |
| C.装置丙制取并收集、检验氨气 |
| D.装置丁比较Na2CO3与NaHCO3的稳定性 |
您最近一年使用:0次
2023-09-15更新
|
389次组卷
|
2卷引用:山东省菏泽一中南京路校区2023-2024学年高一上学期1月月考化学试题
解题方法
3 . 某小组探究Na2CO3和NaHCO3的性质。
(1)探究溶解性。在两支试管中,分别加入约1g Na2CO3和NaHCO3固体,分别加入5mL水,充分振荡后,一支试管中固体有剩余,剩余的固体是______ 。
(2)探究稳定性。按照如图所示装置进行实验(部分夹持装置已略去)。
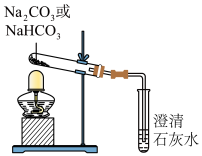
①能够证明Na2CO3的热稳定性强于NaHCO3的证据是______ 。
②NaHCO3受热分解的化学方程式是______ 。
(3)探究与酸的反应。
(4)该小组在探究Na2CO3和NaHCO3的性质时,运用的化学思想方法有______ (填序号)。
a.比较 b.定性与定量相结合
(1)探究溶解性。在两支试管中,分别加入约1g Na2CO3和NaHCO3固体,分别加入5mL水,充分振荡后,一支试管中固体有剩余,剩余的固体是
(2)探究稳定性。按照如图所示装置进行实验(部分夹持装置已略去)。

①能够证明Na2CO3的热稳定性强于NaHCO3的证据是
②NaHCO3受热分解的化学方程式是
(3)探究与酸的反应。
实验步骤 | 实现现象 | 用离子方程式解释现象 |
向盛有Na2CO3溶液的试管中滴加稀盐酸 | 开始无气泡产生,一段时间后产生气泡 | ① ② |
向盛有NaHCO3溶液的试管中滴加稀盐酸 | 立即产生气泡 |
(4)该小组在探究Na2CO3和NaHCO3的性质时,运用的化学思想方法有
a.比较 b.定性与定量相结合
您最近一年使用:0次
4 . 莫尔盐也叫硫酸亚铁铵,是一种重要的化工原料,可作净水剂。在不同温度下其分解产物不同,如图为500℃时隔绝空气加热,探究其分解生成的气体产物的装置。下列说法不正确的是
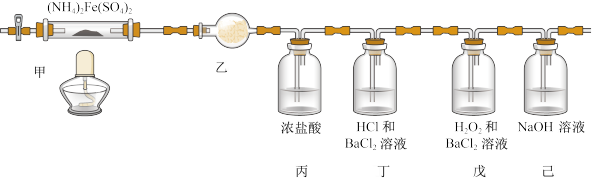

| A.乙装置的干燥管盛装无水硫酸铜检验分解产物中可能含有的水 |
| B.丙中浓盐酸检验可能的分解产物NH3,浓盐酸可用浓硝酸代替 |
| C.若分解产物有SO2,无SO3,则丁装置中无现象,戊装置中有白色沉淀生成 |
| D.己装置吸收实验尾气,防止酸性气体对环境造成污染 |
您最近一年使用:0次
2021-05-11更新
|
1807次组卷
|
4卷引用:山东省济宁市邹城市第二中学2023-2024学年高一下学期3月月考化学试题
名校
5 . 碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是____ 和_____ ;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是_____ 。
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。____ 中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2_____ ;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是____ g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;_____ (填“合理”“不合理”),理由是_____ 。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。
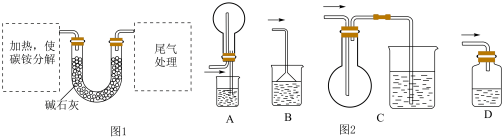
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;
您最近一年使用:0次
2019-10-18更新
|
132次组卷
|
5卷引用:浙江省杭州市富阳区场口中学2023-2024学年高一下学期3月月考化学试题
解题方法
6 . 在古代中国,稀硫酸被称为“绿矾油”。在公元650~683年(唐高宗时),炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》卷九中就记载着“炼石胆取精华法”,即干馏石胆而获得硫酸。
 .目前工业上主要采用接触法制备硫酸:
.目前工业上主要采用接触法制备硫酸:
(1)实验室模拟其中一步反应过程如图装置,V2O5作催化剂时硬质玻璃管内发生的化学方程式为___________ ,b装置中装有浓硫酸,其作用是①___________ ;②___________ ;③控制气流速度,调整气体比例。 .硫酸的性质:某化学学习小组为了探究铁质材料(碳素钢)和浓硫酸反应的产物,利用下列装置进行了如图实验探究活动:
.硫酸的性质:某化学学习小组为了探究铁质材料(碳素钢)和浓硫酸反应的产物,利用下列装置进行了如图实验探究活动:
(2)A装置中装有浓硫酸的仪器名称为___________ ;请写出碳参与反应的化学方程式:___________ 。
(3)实验开始后,能观察到B中品红溶液褪色,C中酸性高锰酸钾溶液褪色。两者褪色的原理是否相同?___________ 。其原因是什么?___________ 。
(4)实验过程中观察到G中黑色固体变为红色、H中无水硫酸铜变蓝色,说明反应产物中有不同于SO2的还原性气体___________ 产生。
(5) 装置内碱石灰的作用
装置内碱石灰的作用___________ 。
 .目前工业上主要采用接触法制备硫酸:
.目前工业上主要采用接触法制备硫酸:(1)实验室模拟其中一步反应过程如图装置,V2O5作催化剂时硬质玻璃管内发生的化学方程式为

 .硫酸的性质:某化学学习小组为了探究铁质材料(碳素钢)和浓硫酸反应的产物,利用下列装置进行了如图实验探究活动:
.硫酸的性质:某化学学习小组为了探究铁质材料(碳素钢)和浓硫酸反应的产物,利用下列装置进行了如图实验探究活动:
(2)A装置中装有浓硫酸的仪器名称为
(3)实验开始后,能观察到B中品红溶液褪色,C中酸性高锰酸钾溶液褪色。两者褪色的原理是否相同?
(4)实验过程中观察到G中黑色固体变为红色、H中无水硫酸铜变蓝色,说明反应产物中有不同于SO2的还原性气体
(5)
 装置内碱石灰的作用
装置内碱石灰的作用
您最近一年使用:0次
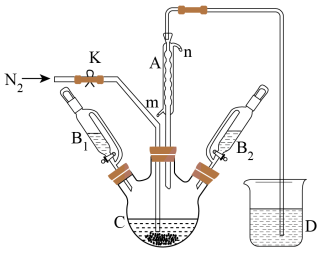
7 . 二茂铁可用作燃料的节能消烟剂、抗爆剂等。某兴趣小组拟用如图所示装置制备二茂铁(电磁搅拌装置、夹持装置略去),反应原理:2KOH+FeCl2+2C5H6(环戊二烯)=Fe(C5H5)2(二茂铁)+2KCl+2H2O。
制备二茂铁的实验步骤如下:
I.在C中加入25gKOH粉末,并加入60mL无冰乙醚,连接好仪器,充分搅拌,然后打开K,通入N2,排尽装置中的空气后,关闭K。
Ⅱ.打开B1的活塞,滴加5.5mL新蒸馏的环戊二烯,搅拌。
Ⅲ.将含一定质量的FeCl2的二甲亚砜溶液25mL由B2缓慢滴入C中,在45min时滴完,再继续搅拌45min,反应完毕。
Ⅳ.拆下仪器C,再向其中加入25mL无水乙醚,搅拌,将液体转移到分液漏斗中,依次用盐酸、水洗涤2~3次,分液得橙黄色溶液。
V.蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
步骤I中检验装置中的空气已排尽的方法是_______ 。
| 物质 | 熔点/°C | 沸点/°C | 密度/(g·cm-3) | 溶解性 |
| 二茂铁 | 173 | 249(100°C时开始升华) | 1.49 | 不溶于水和盐酸,溶于乙醚 |
| 环戊二烯 | -97.2 | 42.5 | 0.87 | 不溶于水,溶于乙醚和乙醇 |
| 乙醚 | -116 | 34.5 | 0.71 | 微溶于水,溶于乙醇 |
| 二甲亚砜 | 18.4 | 189 | 1.10 | 与水互溶,不溶于乙醚 |
I.在C中加入25gKOH粉末,并加入60mL无冰乙醚,连接好仪器,充分搅拌,然后打开K,通入N2,排尽装置中的空气后,关闭K。
Ⅱ.打开B1的活塞,滴加5.5mL新蒸馏的环戊二烯,搅拌。
Ⅲ.将含一定质量的FeCl2的二甲亚砜溶液25mL由B2缓慢滴入C中,在45min时滴完,再继续搅拌45min,反应完毕。
Ⅳ.拆下仪器C,再向其中加入25mL无水乙醚,搅拌,将液体转移到分液漏斗中,依次用盐酸、水洗涤2~3次,分液得橙黄色溶液。
V.蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
步骤I中检验装置中的空气已排尽的方法是
您最近一年使用:0次
名校
8 . 四氯化钛(TiCl4,熔点:-25℃,沸点:136℃)是制备海绵钛和钛白的主要原料, 其实验室制备原理是TiO2(s)+2C(s)+2Cl2(g) TiCl4(g)+2CO(g), 某同学利用如下装置制备
TiCl4(g)+2CO(g), 某同学利用如下装置制备  并验证产物CO。
并验证产物CO。

已知: 遇潮湿空气会发生反应:
遇潮湿空气会发生反应:  。
。
回答下列问题:
(1)写出装置A中制备 的化学反应方程式:
的化学反应方程式: ___________ (注:反应中  被还原为
被还原为  )。
)。
(2)按气流方向从左至右, 上述装置的连接顺序为 A、___________ 、 E。
(3)装置 A 中盛放浓盐酸的仪器名称为___________ , 装置G中盛放的碱石灰的作用是___________ 。
(4)能证明有CO生成的实验现象是___________ 。
(5)产品中 含量测定: 取
含量测定: 取  产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成
产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成  溶液, 取
溶液, 取  所配溶液放入锥形瓶中, 滴加几滴
所配溶液放入锥形瓶中, 滴加几滴  的
的  溶液作指示剂, 用
溶液作指示剂, 用  的
的  溶液滴定至终点, 消耗
溶液滴定至终点, 消耗  溶液
溶液  。已知:
。已知:  是一种深红 色固体; 常温下,
是一种深红 色固体; 常温下,  ,
, 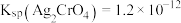 。
。
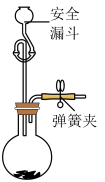
①安全漏斗中的水在本实验中的作用除加水外, 还有___________ 。
②该沉淀滴定终点的判断方法是___________ 。
③该产品纯度为___________ %(保留一位小数)。
 TiCl4(g)+2CO(g), 某同学利用如下装置制备
TiCl4(g)+2CO(g), 某同学利用如下装置制备  并验证产物CO。
并验证产物CO。
已知:
 遇潮湿空气会发生反应:
遇潮湿空气会发生反应:  。
。回答下列问题:
(1)写出装置A中制备
 的化学反应方程式:
的化学反应方程式:  被还原为
被还原为  )。
)。(2)按气流方向从左至右, 上述装置的连接顺序为 A、
(3)装置 A 中盛放浓盐酸的仪器名称为
(4)能证明有CO生成的实验现象是
(5)产品中
 含量测定: 取
含量测定: 取  产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成
产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成  溶液, 取
溶液, 取  所配溶液放入锥形瓶中, 滴加几滴
所配溶液放入锥形瓶中, 滴加几滴  的
的  溶液作指示剂, 用
溶液作指示剂, 用  的
的  溶液滴定至终点, 消耗
溶液滴定至终点, 消耗  溶液
溶液  。已知:
。已知:  是一种深红 色固体; 常温下,
是一种深红 色固体; 常温下,  ,
, 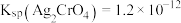 。
。
①安全漏斗中的水在本实验中的作用除加水外, 还有
②该沉淀滴定终点的判断方法是
③该产品纯度为
您最近一年使用:0次
2023-08-24更新
|
314次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高三上学期第二次月考化学试卷



