1 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
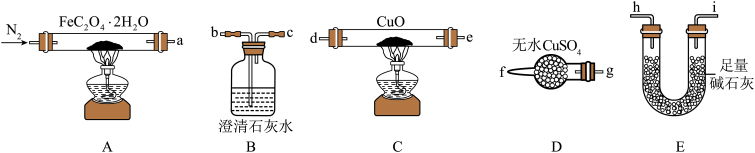
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___ →尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为__ 。
③实验证明了气体产物中含有CO,依据的实验现象为__ 。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是__ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为__ 。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为__ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为__ ;步骤3中加入锌粉的目的为___ 。
(5)若步骤 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将__ (填“偏高”、“偏低”或“不变”)
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:

①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→
②检查装置气密性后,先通入一段时间N2,其目的为
③实验证明了气体产物中含有CO,依据的实验现象为
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为
(5)若步骤
 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
2020-06-12更新
|
1222次组卷
|
3卷引用:实验探究题
名校
解题方法
2 . 甲醛与新制氢氧化铜反应的产物随反应条件改变而有所不同。实验室对该反应在一定条件下所得产物成分进行探究,具体过程如下。
取一定量的 溶液、
溶液、 溶液和甲醛于锥形瓬中,控制温度为40~50℃回流
溶液和甲醛于锥形瓬中,控制温度为40~50℃回流 ,收集到大量气体
,收集到大量气体 ,并有红色沉淀生成。
,并有红色沉淀生成。
(1)①“控制温度为40~50℃”的常用加热方法是___________ 。
②气体 能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是
能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是___________ 。
(2)在探究甲醛的氧化产物时,发现未生成 。为了进一步确定甲醛是否被氧化为
。为了进一步确定甲醛是否被氧化为 ,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成
,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成 ,而
,而 可将银氨溶液还原成银单质)。
可将银氨溶液还原成银单质)。
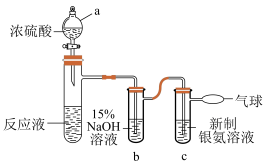
①仪器a的名称是___________ 。
②b中, 溶液的作用是
溶液的作用是___________ 。
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为___________ 。
(3)已知: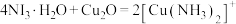 (无色)
(无色) ,
, 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);验证红色沉淀中含
(蓝色);验证红色沉淀中含 ,进行如下实验步骤和现象记录:取样品,
,进行如下实验步骤和现象记录:取样品,___________ ,说明红色固体中含 。
。
(4)若最终测得红色沉淀为 和少量的
和少量的 ,且
,且 的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成
的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成 和气体X的化学方程式
和气体X的化学方程式___________ 。
取一定量的
 溶液、
溶液、 溶液和甲醛于锥形瓬中,控制温度为40~50℃回流
溶液和甲醛于锥形瓬中,控制温度为40~50℃回流 ,收集到大量气体
,收集到大量气体 ,并有红色沉淀生成。
,并有红色沉淀生成。(1)①“控制温度为40~50℃”的常用加热方法是
②气体
 能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是
能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是(2)在探究甲醛的氧化产物时,发现未生成
 。为了进一步确定甲醛是否被氧化为
。为了进一步确定甲醛是否被氧化为 ,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成
,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成 ,而
,而 可将银氨溶液还原成银单质)。
可将银氨溶液还原成银单质)。
①仪器a的名称是
②b中,
 溶液的作用是
溶液的作用是③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
(3)已知:
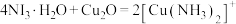 (无色)
(无色) ,
, 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);验证红色沉淀中含
(蓝色);验证红色沉淀中含 ,进行如下实验步骤和现象记录:取样品,
,进行如下实验步骤和现象记录:取样品, 。
。(4)若最终测得红色沉淀为
 和少量的
和少量的 ,且
,且 的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成
的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成 和气体X的化学方程式
和气体X的化学方程式
您最近一年使用:0次
名校
3 . 草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
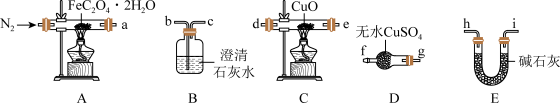
①装置D的名称为______ 。
②按照气流从左到右的方向,上述装置的连接顺序为_____ →尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为_______ 。
④实验证明了气体产物中含有CO,依据的实验现象为______ 。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___ 。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为____ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol·L−1 KMnO4标准液滴定至终点,消耗标准液V1 mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用c mol·L−1 KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为______ 。
(5)草酸亚铁晶体样品的纯度为_____ ;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将______ (填“偏高”、“偏低”或“不变”)。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:

①装置D的名称为
②按照气流从左到右的方向,上述装置的连接顺序为
③实验前先通入一段时间N2,其目的为
④实验证明了气体产物中含有CO,依据的实验现象为
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol·L−1 KMnO4标准液滴定至终点,消耗标准液V1 mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用c mol·L−1 KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为
(5)草酸亚铁晶体样品的纯度为
您最近一年使用:0次
2019-03-26更新
|
1827次组卷
|
9卷引用:重庆市第一中学2020届高三下学期第一次月考理科综合化学试题
名校
解题方法
4 . 高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。

(1)写出高氯酸铵分解的化学方程式__________ 。
(2) 高氯酸铵分解选择的装置是__________ (填字母)。
(3)按气流从左到右,装置的连接顺序是: 分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________ ,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________ 。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________ 。
(7) 某实验室存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________ 。


(1)写出高氯酸铵分解的化学方程式
(2) 高氯酸铵分解选择的装置是
(3)按气流从左到右,装置的连接顺序是: 分解装置→_____→_____→_____→_____→_____。
(4)C中所放的试剂是
(5)能证明有Cl2产生的现象是
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是
(7) 某实验室存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为

您最近一年使用:0次
2018-04-17更新
|
324次组卷
|
4卷引用:重庆2018年普通高等学校招生全国统一考试4月调研测试(理综)化学部



