解题方法
1 . 研究性学习小组的同学们按下图装置进行SO2的制备及性质探究实验。(查阅资料得到SO2气体的制备原理:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O),回答问题:
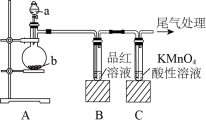
(1)图中a的仪器名称是_______ , 亚硫酸钠应放在_________ (填“a”或“b”)中。
(2)实验过程中,可以观察到装置B中品红溶液_______ (填实验现象),该现象说明SO2具有_____ 性(填“氧化”、“还原”或“漂白”)。
(3)酸性条件下,SO2与KMnO4在发生如下反应:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,使溶液褪色。反应中SO2是________ (填“氧化”、“还原”剂),当0.5 mol SO2参加反应时,转移电子的物质的量是_______ mol。
(4)尾气可采用________ 溶液吸收。

(1)图中a的仪器名称是
(2)实验过程中,可以观察到装置B中品红溶液
(3)酸性条件下,SO2与KMnO4在发生如下反应:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,使溶液褪色。反应中SO2是
(4)尾气可采用
您最近一年使用:0次
2020-08-12更新
|
198次组卷
|
4卷引用:青海省2020年7月普通高中学业水平考试化学试题
(已下线)青海省2020年7月普通高中学业水平考试化学试题青海省2020年7月普通高中学业水平考试化学试题1青海省西宁市北外附属新华联国际学校2021-2022学年高二上学期第一次月考化学(文)试题广西桂林市逸仙中学2021-2022学年高一下学期期中考试 化学试题
2 . 某学习小组设计实验,探究二氧化硫的漂白性和还原性。
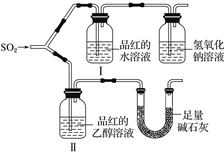
(1)漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
①甲同学作对照实验的目的是_________________________________________ 。
②足量碱石灰的作用是_____________________________________________ 。
甲同学由此得出的实验结论是_________________________________________ 。
(2)还原性
乙同学将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是____________________ ,检验该反应所得含氧酸根离子的方法是___________________________________________________________ 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。资料显示:红棕色为FeSO3 (墨绿色难溶物)与FeCl3 溶液形成的混合色。 则②中红棕色变为浅绿色的原因是_________________________________________________________ 。
乙同学得出的实验结论是二氧化硫可还原三氯化铁。

(1)漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
①甲同学作对照实验的目的是
②足量碱石灰的作用是
甲同学由此得出的实验结论是
(2)还原性
乙同学将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。资料显示:红棕色为FeSO3 (墨绿色难溶物)与FeCl3 溶液形成的混合色。 则②中红棕色变为浅绿色的原因是
乙同学得出的实验结论是二氧化硫可还原三氯化铁。
您最近一年使用:0次
3 . NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究。
【查阅资料】①NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水;③2NaNO3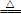 2NaNO2+O2↑,NaNO2热稳定性很高。
2NaNO2+O2↑,NaNO2热稳定性很高。
【实验探究Ⅰ】兴趣小组的同学经讨论设计了如下图所示实验:
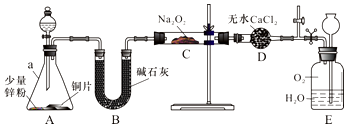
(1)仪器a的名称是___________ ;干燥管D的作用是________ 。
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是_________ 。
(3)若无B装置,后果是_______ 。
(4)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是____________________ 。
【实验探究Ⅱ】 该兴趣小组进一步探究C中生成的白色固体的成分。
(5)提出假设:假设1. 白色固体只有NaNO2;假设2. 白色固体只有_________ ;
假设3. 白色固体是两种物质的混合物。
(6)实验验证:①要证明假设2是否成立,实验操作、现象和结论是____________________ 。
②为证明是假设1还是假设3成立,称取C中生成的白色固体a g置于坩埚中(坩埚质量为c g),用酒精灯加热至质量不再改变,冷却后称得坩埚和剩余固体总质量为b g,假设3成立时b-c的数字范围是____________ 。(用含a的不等式表示)
【查阅资料】①NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水;③2NaNO3
 2NaNO2+O2↑,NaNO2热稳定性很高。
2NaNO2+O2↑,NaNO2热稳定性很高。【实验探究Ⅰ】兴趣小组的同学经讨论设计了如下图所示实验:

(1)仪器a的名称是
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是
(3)若无B装置,后果是
(4)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是
【实验探究Ⅱ】 该兴趣小组进一步探究C中生成的白色固体的成分。
(5)提出假设:假设1. 白色固体只有NaNO2;假设2. 白色固体只有
假设3. 白色固体是两种物质的混合物。
(6)实验验证:①要证明假设2是否成立,实验操作、现象和结论是
②为证明是假设1还是假设3成立,称取C中生成的白色固体a g置于坩埚中(坩埚质量为c g),用酒精灯加热至质量不再改变,冷却后称得坩埚和剩余固体总质量为b g,假设3成立时b-c的数字范围是
您最近一年使用:0次
2016-12-09更新
|
1073次组卷
|
3卷引用:2018届高三一轮复习化学:考点15-过氧化钠性质的多重性



