解题方法
1 . 某小组探究SO2的漂白原理及铜和浓硫酸反应的最低浓度,装置如图所示,部分装置省略。实验发现,装置B中溶液变红色,不褪色;装置C中溶液为红色,装置D中溶液褪色。向烧瓶中加入200mL18.4mol/L浓硫酸,充分反应直至装置A中反应停止。
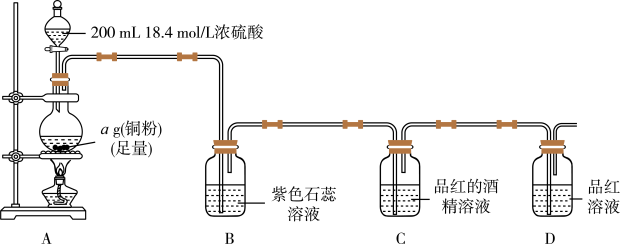
回答下列问题:
(1)装置A中发生反应的化学方程式为_______ 。
(2)根据装置C、D中出现的现象,对漂白品红的粒子提出如下猜想:
猜想1:H2SO3;猜想2:HSO ;猜想3:
;猜想3:_______ 。
针对猜想2设计简单实验探究漂白原理:_______ 。
(3)实验完毕后,甲同学设计如下实验测定剩余硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):

①实验部分操作:(a)调平量气管和烧杯的液面;(b)冷却至室温;(c)读数。
正确的先后操作顺序是_______ (填字母)。
②已知开始时量气管读数为V1mL,最终读数为V2mL(均折合成标准状况)。
则铜与浓硫酸发生反应的最低硫酸浓度为_______ mol/L。
(4)乙同学分析上述实验后,设计如下实验方案:
方案1:过滤、洗涤、低温干燥,称过量铜粉的质量(不考虑副产物)。
方案2:取25mL残留溶液,滴加甲基橙作指示剂,用标准NaOH溶液滴定H2SO4。
丙同学分析上述方案,认为方案_______ (填“1”或“2”)可行。请你帮丙同学分析不可行方案的理由:_______ 。
(5)丁同学采用滴定法测定硫酸最低浓度。取烧杯中剩余混合液20.00mL于锥形瓶中,滴加指示剂,用cmol/L标准EDTA(用Na4Y表示)溶液滴定至终点时消耗滴定液xmL。
已知:滴定反应为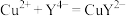 。
。
该浓硫酸的最低浓度为_______ mol/L。若滴定管没有用EDTA溶液润洗,测得结果_______ (填“偏高”“偏低”或“无影响”)。

回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)根据装置C、D中出现的现象,对漂白品红的粒子提出如下猜想:
猜想1:H2SO3;猜想2:HSO
 ;猜想3:
;猜想3:针对猜想2设计简单实验探究漂白原理:
(3)实验完毕后,甲同学设计如下实验测定剩余硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):

①实验部分操作:(a)调平量气管和烧杯的液面;(b)冷却至室温;(c)读数。
正确的先后操作顺序是
②已知开始时量气管读数为V1mL,最终读数为V2mL(均折合成标准状况)。
则铜与浓硫酸发生反应的最低硫酸浓度为
(4)乙同学分析上述实验后,设计如下实验方案:
方案1:过滤、洗涤、低温干燥,称过量铜粉的质量(不考虑副产物)。
方案2:取25mL残留溶液,滴加甲基橙作指示剂,用标准NaOH溶液滴定H2SO4。
丙同学分析上述方案,认为方案
(5)丁同学采用滴定法测定硫酸最低浓度。取烧杯中剩余混合液20.00mL于锥形瓶中,滴加指示剂,用cmol/L标准EDTA(用Na4Y表示)溶液滴定至终点时消耗滴定液xmL。
已知:滴定反应为
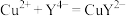 。
。该浓硫酸的最低浓度为
您最近一年使用:0次
2022-12-23更新
|
208次组卷
|
3卷引用:河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)
(已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21) 河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试化学试题 河南省郑州市等3地2022-2023学年高三上学期12月月考化学试题
名校
解题方法
2 . 工业上可以用废铁屑制备活性Fe3O4,流程如下图:
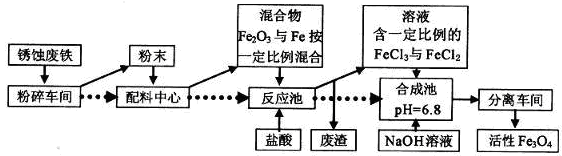
(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________
(2)在合成池里生成Fe3O4的离子方程式为__________________________
(3)假如在反应池中几乎没有气体产生,根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):

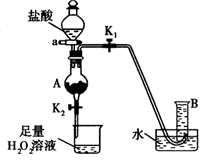
操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
①操作Ⅱ中“……”的内容是______________ ,烧杯中的现象是________________ ,相应的方程式是________________ 、________________ 。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是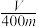 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________ 。

(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是
(2)在合成池里生成Fe3O4的离子方程式为
(3)假如在反应池中几乎没有气体产生,根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):


操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
①操作Ⅱ中“……”的内容是
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是
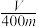 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是
您最近一年使用:0次
2017-07-14更新
|
461次组卷
|
3卷引用:2019年8月10日 《每日一题》2020年高考一轮复习—— 周末培优
(已下线)2019年8月10日 《每日一题》2020年高考一轮复习—— 周末培优福建省福州市闽侯县2016-2017学年高二下学期期末考试化学试题山西大学附中2020届高三上学期第二次模块诊断化学试题



