1 . 草酸(H2C2O4)是一种还原性的二元弱酸(常温下,草酸的电离常数K1=5.4x10-2,K2=5.4x10-5 ),主要存在于菠菜等植物中。
(1)常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,图中c点所示溶液中: 2c( )+2c(
)+2c( )+2c(H2C2O4)=c(Na+)
)+2c(H2C2O4)=c(Na+)

则a点所示溶液中各离子的浓度由大到小的顺序为___________ 。
(2) 中碳元素的化合价是+3价,推测其有还原性。为了验证
中碳元素的化合价是+3价,推测其有还原性。为了验证 与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,Fe3++3 =[Fe(C2O4)3]3- K=1.6×1020
=[Fe(C2O4)3]3- K=1.6×1020
①该小组同学学并未检出反应后的溶液中有Fe2+,从反应原理的角度解释 和Fe3+ 未发生氧化还原反应的可能的原因是
和Fe3+ 未发生氧化还原反应的可能的原因是___________ 。
② 经进一步研究分析,同学们改进了实验方案。设计了如图所示的装置,验证了 的还原性强于Fe2+。
的还原性强于Fe2+。

i.闭合K,电流计指针偏转,一段时间后,取少许左侧溶液,滴加_______ 溶液(填化学式),生成蓝色沉淀,证明左池有Fe2+生成。
ii.写出右池电极反应式:___________ 。
iii.该装置的优点是___________ 。
(1)常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,图中c点所示溶液中: 2c(
 )+2c(
)+2c( )+2c(H2C2O4)=c(Na+)
)+2c(H2C2O4)=c(Na+)
则a点所示溶液中各离子的浓度由大到小的顺序为
(2)
 中碳元素的化合价是+3价,推测其有还原性。为了验证
中碳元素的化合价是+3价,推测其有还原性。为了验证 与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,Fe3++3
 =[Fe(C2O4)3]3- K=1.6×1020
=[Fe(C2O4)3]3- K=1.6×1020①该小组同学学并未检出反应后的溶液中有Fe2+,从反应原理的角度解释
 和Fe3+ 未发生氧化还原反应的可能的原因是
和Fe3+ 未发生氧化还原反应的可能的原因是② 经进一步研究分析,同学们改进了实验方案。设计了如图所示的装置,验证了
 的还原性强于Fe2+。
的还原性强于Fe2+。
i.闭合K,电流计指针偏转,一段时间后,取少许左侧溶液,滴加
ii.写出右池电极反应式:
iii.该装置的优点是
您最近一年使用:0次
名校
2 . 向乙醛溶液中加入含 的物质的量为1
的物质的量为1 的溴水,观察到溴水褪色。对产生该现象的原因有如下3种猜想:①溴水与乙醛发生取代反应;②由于乙醛具有还原性,溴水将乙醛氧化为乙酸;③由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应。
的溴水,观察到溴水褪色。对产生该现象的原因有如下3种猜想:①溴水与乙醛发生取代反应;②由于乙醛具有还原性,溴水将乙醛氧化为乙酸;③由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应。
为探究哪一种猜想正确,某研究性学习小组设计了如下2种实验方案。
方案1:检验褪色后溶液的酸碱性。方案2:测定反应后溶液中的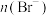 。
。
下列说法正确的是
 的物质的量为1
的物质的量为1 的溴水,观察到溴水褪色。对产生该现象的原因有如下3种猜想:①溴水与乙醛发生取代反应;②由于乙醛具有还原性,溴水将乙醛氧化为乙酸;③由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应。
的溴水,观察到溴水褪色。对产生该现象的原因有如下3种猜想:①溴水与乙醛发生取代反应;②由于乙醛具有还原性,溴水将乙醛氧化为乙酸;③由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应。为探究哪一种猜想正确,某研究性学习小组设计了如下2种实验方案。
方案1:检验褪色后溶液的酸碱性。方案2:测定反应后溶液中的
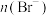 。
。下列说法正确的是
| A.若检验褪色后的溶液显酸性,说明溴水将乙醛氧化成乙酸 |
B.若测得反应后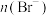 为0 为0 ,说明溴水与乙醛发生加成反应 ,说明溴水与乙醛发生加成反应 |
C.若测得反应后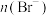 为2 为2 ,说明溴水与乙醛发生取代反应 ,说明溴水与乙醛发生取代反应 |
D.若溴水能将乙醛氧化为乙酸,反应的离子方程式为: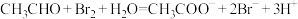 |
您最近一年使用:0次
2023-07-18更新
|
341次组卷
|
4卷引用:山西省名校联合测评2022-2023学年高二下学期7月期末化学试题
3 . 某同学进行下图所示实验。下列相关判断错误的是
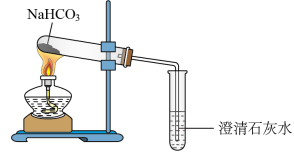

| A.澄清石灰水会变浑浊 |
| B.试管中的剩余物能使澄清石灰水变浑浊 |
| C.加热一段时间后,试管内固体质量不变 |
| D.将碳酸氢钠换成碳酸氢钾实验现象相同 |
您最近一年使用:0次
4 . 某化学兴趣小组的同学们通过以下实验验证同周期元素金属性的递变规律。
(1)请将上表中的空白部分填写完整:①_______ ,②_______ ,③_______ ,④_______ 。
(2)实验3中发生反应的化学方程式是_______ 。
(3)由以上实验现象可以判断,同周期元素随着原子序数的递增,金属性逐渐_______ ,其原因是_______ 。
(4)同学们用打磨过表面的镁条和铝片重新设计实验,对比镁和铝的金属性强弱。
【实验方案】_______ 。
【实验现象】_______ 。
【实验原理】有关反应的离子方程式是_______ (写一个)。
| 实验操作 | 实验现象 | |
| 实验1 | 在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大小的钠放入水中。 | 钠熔化成光亮的小球,浮在水面上来回游动,_______①_______ |
| 实验2 | 取一小段用砂纸打磨过表面的镁条,放到试管中,向试管中加入2mL水,并滴入2滴酚酞溶液。 | 镁条表面产生少量气泡 |
| 实验3 | 将实验2中的试管加热至液体沸腾。 | _______②_______ |
| 实验4 | 取一小段用砂纸打磨过表面的铝片,放到试管中,_______③_______ | _______③_______ |
(2)实验3中发生反应的化学方程式是
(3)由以上实验现象可以判断,同周期元素随着原子序数的递增,金属性逐渐
(4)同学们用打磨过表面的镁条和铝片重新设计实验,对比镁和铝的金属性强弱。
【实验方案】
【实验现象】
【实验原理】有关反应的离子方程式是
您最近一年使用:0次
名校
5 . 用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是


A.若A为浓盐酸B为 ,C中盛有 ,C中盛有 溶液,则C中溶液出现白色沉淀,证明酸性: 溶液,则C中溶液出现白色沉淀,证明酸性: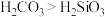 |
B.若A为稀硫酸B为 ,C中盛有 ,C中盛有 溶液,则C中溶液出现白色沉淀,证非金属性: 溶液,则C中溶液出现白色沉淀,证非金属性: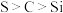 |
C.若A为浓盐酸B为 ,C中盛石蕊试液,则C中溶液先变红后褪色 ,C中盛石蕊试液,则C中溶液先变红后褪色 |
| D.装置D起干燥气体作用 |
您最近一年使用:0次
名校
6 . 亚硫酰氯( )又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。
)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。
【资料】①实验室制备原理:在活性炭催化下,
②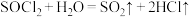 。
。
③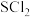 是一种重要的化工试剂,遇水易分解。
是一种重要的化工试剂,遇水易分解。
实验一:制备产品并探究 的性质
的性质
根据图1所示装置设计实验(装置可以重复使用)。
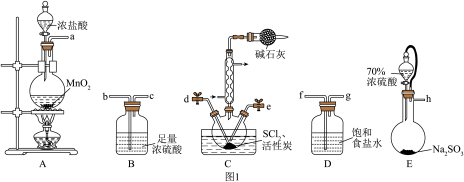
(1)装置接口连接顺序为a→_______ →d、e→_______ →h。
(2)实验室用亚硫酸钠固体与70%硫酸制备 ,不用稀硫酸的原因为
,不用稀硫酸的原因为_______ 。
(3)A装置中发生反应的离子方程式为_______ 。
(4)实验室常用过量NaOH溶液吸收 ,写出反应的离子方程式:
,写出反应的离子方程式:_______ 。
(5)甲同学认为 还可用作由
还可用作由 制取无水
制取无水 的脱水剂,但乙同学认为该实验可能发生副反应使产品不纯。所以乙同学设计如下实验判断副反应的可能性:取少量
的脱水剂,但乙同学认为该实验可能发生副反应使产品不纯。所以乙同学设计如下实验判断副反应的可能性:取少量 于试管中,加入足量
于试管中,加入足量 ,充分反应后向试管中加水溶解,取溶解后的溶液少许于四支试管中,分别进行下列实验,能验证发生副反应的是_______(填选项字母)。
,充分反应后向试管中加水溶解,取溶解后的溶液少许于四支试管中,分别进行下列实验,能验证发生副反应的是_______(填选项字母)。
实验二:测定产品纯度。
利用图2装置测定产品纯度。
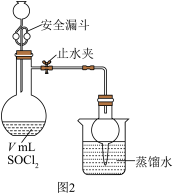
打开止水夹,向安全漏斗中加入足量蒸馏水,待反应完全后,将烧杯中的溶液和烧瓶中的溶液合并,在合并后的溶液中加入足量的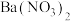 固体,振荡后静置,过滤,将滤液配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,滴几滴
固体,振荡后静置,过滤,将滤液配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,滴几滴 溶液作指示剂,用
溶液作指示剂,用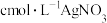 溶液滴定至终点,消耗VmL
溶液滴定至终点,消耗VmL 溶液[已知:常温下,
溶液[已知:常温下, ,
,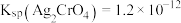 ]。
]。
(6)VmL产品中含_______ mol 。下列情况会使测定结果偏高的是
。下列情况会使测定结果偏高的是_______ (填序号)。
①产品含少量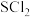 ②滴定管没有用
②滴定管没有用 溶液润洗
溶液润洗
③滴加 指示剂过多 ④合并溶液时,烧瓶中有少量残余液体
指示剂过多 ④合并溶液时,烧瓶中有少量残余液体
 )又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。
)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。【资料】①实验室制备原理:在活性炭催化下,

②
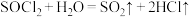 。
。③
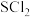 是一种重要的化工试剂,遇水易分解。
是一种重要的化工试剂,遇水易分解。实验一:制备产品并探究
 的性质
的性质根据图1所示装置设计实验(装置可以重复使用)。

(1)装置接口连接顺序为a→
(2)实验室用亚硫酸钠固体与70%硫酸制备
 ,不用稀硫酸的原因为
,不用稀硫酸的原因为(3)A装置中发生反应的离子方程式为
(4)实验室常用过量NaOH溶液吸收
 ,写出反应的离子方程式:
,写出反应的离子方程式:(5)甲同学认为
 还可用作由
还可用作由 制取无水
制取无水 的脱水剂,但乙同学认为该实验可能发生副反应使产品不纯。所以乙同学设计如下实验判断副反应的可能性:取少量
的脱水剂,但乙同学认为该实验可能发生副反应使产品不纯。所以乙同学设计如下实验判断副反应的可能性:取少量 于试管中,加入足量
于试管中,加入足量 ,充分反应后向试管中加水溶解,取溶解后的溶液少许于四支试管中,分别进行下列实验,能验证发生副反应的是_______(填选项字母)。
,充分反应后向试管中加水溶解,取溶解后的溶液少许于四支试管中,分别进行下列实验,能验证发生副反应的是_______(填选项字母)。A.滴加 溶液 溶液 | B.滴加 溶液 溶液 |
C.滴加酸性 溶液 溶液 | D.先滴加稀 ,再滴加 ,再滴加 溶液 溶液 |
实验二:测定产品纯度。
利用图2装置测定产品纯度。

打开止水夹,向安全漏斗中加入足量蒸馏水,待反应完全后,将烧杯中的溶液和烧瓶中的溶液合并,在合并后的溶液中加入足量的
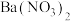 固体,振荡后静置,过滤,将滤液配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,滴几滴
固体,振荡后静置,过滤,将滤液配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,滴几滴 溶液作指示剂,用
溶液作指示剂,用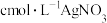 溶液滴定至终点,消耗VmL
溶液滴定至终点,消耗VmL 溶液[已知:常温下,
溶液[已知:常温下, ,
,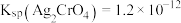 ]。
]。(6)VmL产品中含
 。下列情况会使测定结果偏高的是
。下列情况会使测定结果偏高的是①产品含少量
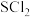 ②滴定管没有用
②滴定管没有用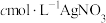 溶液润洗
溶液润洗③滴加
 指示剂过多 ④合并溶液时,烧瓶中有少量残余液体
指示剂过多 ④合并溶液时,烧瓶中有少量残余液体
您最近一年使用:0次
7 . 某化学兴趣小组利用如图装置进行“铁与水蒸气反应”的实验,并检验产物的性质,下列说法正确的是
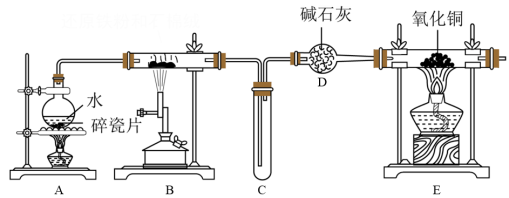

| A.实验时,应先点燃B处的酒精灯,再点燃A处的酒精灯 |
B.B中发生反应的化学方程式是:2Fe+3H2O(g) Fe2O3+3H2↑ Fe2O3+3H2↑ |
| C.B中生成1mol H2时,E处有1mol CuO被还原 |
| D.碱石灰的作用是吸收水蒸气 |
您最近一年使用:0次
2020-06-15更新
|
445次组卷
|
4卷引用:山西省吕梁市孝义市2022-2023学年高一上学期1月期末考试化学试题
山西省吕梁市孝义市2022-2023学年高一上学期1月期末考试化学试题专题9 本专题复习提升-高中化学必修第二册苏教版2019黑龙江省大庆市第四中学2019-2020学年高一上学期第三次月考化学试题(已下线)3.1.1 铁的单质-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)
名校
解题方法
8 . 常温下氯化铁为棕黑色固体,易升华。实验室欲证明H2能在加热的条件下还原FeCl3,设计如下实验。下列说法错误的是
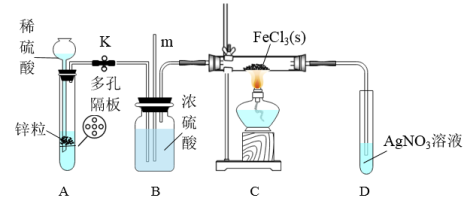

| A.装置A的优点是随开随用,随关随停 |
| B.导管m的作用是平衡压强,观察是否堵塞 |
| C.装置D中产生白色沉淀即可证明H2能还原FeCl3 |
| D.实验结束后,应先熄灭C处酒精灯,待硬质玻璃管冷却后关闭K |
您最近一年使用:0次
2020-01-17更新
|
526次组卷
|
4卷引用:第三章 实验活动2 铁及其化合物的性质 期末备考复习 2023-2024学年高一上学期化学人教版(2019)必修第一册



