解题方法
1 . 回答下列问题。
(1)“服用维生素C,可以使食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有___________ (填“氧化”或“还原”)性。
(2)某实验小组设计下列装置验证过氧化钠能与二氧化碳、水反应,可用在呼吸面具或潜水艇中作氧气源。用下图装置证明过氧化钠可做供氧剂。
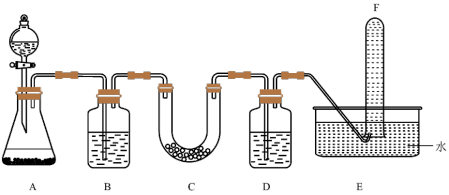
回答下列问题:
①装置A用于实验室制取CO2气体,则发生反应的化学方程式为___________ 。
②仪器B中加入的试剂是饱和NaHCO3溶液,则加入该试剂的作用是___________ 。
③仪器C中装有过氧化钠固体,目的是与CO2、H2O反应,写出Na2O2与H2O反应的化学方程式___________ 。
④仪器D的目的是除去O2中的CO2气体,可以盛装___________ 溶液。
⑤从仪器E中取出试管F,简述检验F中气体是O2的操作及现象___________ 。
(1)“服用维生素C,可以使食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)某实验小组设计下列装置验证过氧化钠能与二氧化碳、水反应,可用在呼吸面具或潜水艇中作氧气源。用下图装置证明过氧化钠可做供氧剂。

回答下列问题:
①装置A用于实验室制取CO2气体,则发生反应的化学方程式为
②仪器B中加入的试剂是饱和NaHCO3溶液,则加入该试剂的作用是
③仪器C中装有过氧化钠固体,目的是与CO2、H2O反应,写出Na2O2与H2O反应的化学方程式
④仪器D的目的是除去O2中的CO2气体,可以盛装
⑤从仪器E中取出试管F,简述检验F中气体是O2的操作及现象
您最近一年使用:0次
2 . 草酸(H2C2O4)是一种还原性的二元弱酸(常温下,草酸的电离常数K1=5.4x10-2,K2=5.4x10-5 ),主要存在于菠菜等植物中。
(1)常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,图中c点所示溶液中: 2c( )+2c(
)+2c( )+2c(H2C2O4)=c(Na+)
)+2c(H2C2O4)=c(Na+)

则a点所示溶液中各离子的浓度由大到小的顺序为___________ 。
(2) 中碳元素的化合价是+3价,推测其有还原性。为了验证
中碳元素的化合价是+3价,推测其有还原性。为了验证 与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,Fe3++3 =[Fe(C2O4)3]3- K=1.6×1020
=[Fe(C2O4)3]3- K=1.6×1020
①该小组同学学并未检出反应后的溶液中有Fe2+,从反应原理的角度解释 和Fe3+ 未发生氧化还原反应的可能的原因是
和Fe3+ 未发生氧化还原反应的可能的原因是___________ 。
② 经进一步研究分析,同学们改进了实验方案。设计了如图所示的装置,验证了 的还原性强于Fe2+。
的还原性强于Fe2+。

i.闭合K,电流计指针偏转,一段时间后,取少许左侧溶液,滴加_______ 溶液(填化学式),生成蓝色沉淀,证明左池有Fe2+生成。
ii.写出右池电极反应式:___________ 。
iii.该装置的优点是___________ 。
(1)常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,图中c点所示溶液中: 2c(
 )+2c(
)+2c( )+2c(H2C2O4)=c(Na+)
)+2c(H2C2O4)=c(Na+)
则a点所示溶液中各离子的浓度由大到小的顺序为
(2)
 中碳元素的化合价是+3价,推测其有还原性。为了验证
中碳元素的化合价是+3价,推测其有还原性。为了验证 与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,Fe3++3
 =[Fe(C2O4)3]3- K=1.6×1020
=[Fe(C2O4)3]3- K=1.6×1020①该小组同学学并未检出反应后的溶液中有Fe2+,从反应原理的角度解释
 和Fe3+ 未发生氧化还原反应的可能的原因是
和Fe3+ 未发生氧化还原反应的可能的原因是② 经进一步研究分析,同学们改进了实验方案。设计了如图所示的装置,验证了
 的还原性强于Fe2+。
的还原性强于Fe2+。
i.闭合K,电流计指针偏转,一段时间后,取少许左侧溶液,滴加
ii.写出右池电极反应式:
iii.该装置的优点是
您最近一年使用:0次
3 . 某实验小组利用下图装置探究二氧化硫在不同条件下与可溶性钡盐溶液的反应情况(煮沸后溶液均冷却至室温再进行实验)。实验时将乙装置的导管分别与A、B、C、D相连。回答下列问题:

(1)利用甲装置可制取二氧化硫,写出该反应的化学方程式:___________ ;若使用98%的浓硫酸替代70%硫酸时反应非常缓慢,其主要原因是___________ 。
(2)将可溶性钡盐煮沸的目的是___________ 。
(3)装置A中溶液始终保持澄清,装置B中溶液出现轻微浑浊,由此得出的结论是________ 。
(4)下图是四个装置中对应的pH变化曲线。
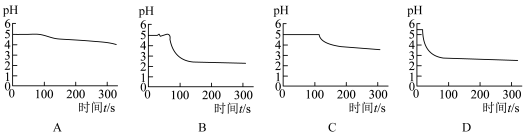
①装置A中pH变化比较平缓,装置B中pH出现骤降现象,试分析装置B中出现骤降的原因:___________ 。
②装置C也出现pH骤降的现象,该现象的出现与___________ (填离子符号)有直接关系。
③装置D中pH的变化程度比装置C中更为明显,说明在二氧化硫与硝酸钡溶液的反应中________ (填物质名称)对pH变化的影响更大。
(5)检验生成的沉淀中是否存在 ,需要的检测试剂有
,需要的检测试剂有___________ 。

(1)利用甲装置可制取二氧化硫,写出该反应的化学方程式:
(2)将可溶性钡盐煮沸的目的是
(3)装置A中溶液始终保持澄清,装置B中溶液出现轻微浑浊,由此得出的结论是
(4)下图是四个装置中对应的pH变化曲线。

①装置A中pH变化比较平缓,装置B中pH出现骤降现象,试分析装置B中出现骤降的原因:
②装置C也出现pH骤降的现象,该现象的出现与
③装置D中pH的变化程度比装置C中更为明显,说明在二氧化硫与硝酸钡溶液的反应中
(5)检验生成的沉淀中是否存在
 ,需要的检测试剂有
,需要的检测试剂有
您最近一年使用:0次
名校
4 .  与
与 的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。

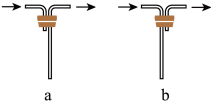
(1)仪器B的名称是___________ ,安装F中导管时,应选用图中的___________ 。
(2)打开B的活塞,A中发生反应生成 ,请将化学方程式配平:
,请将化学方程式配平:___________

为使 在D中被稳定剂充分吸收,滴加稀盐酸的速度宜
在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________ (填“快”或“慢”)。
(3)关闭B的活塞, 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,此时F中溶液的颜色不变,则装置C的作用是
,此时F中溶液的颜色不变,则装置C的作用是___________ 。
(4)已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为___________ ,在 释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___________ 。
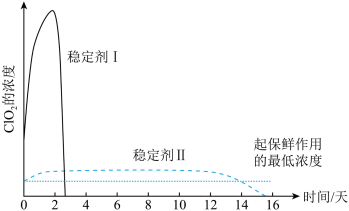
(5)已吸收 气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放 的浓度随时间的变化如下图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
的浓度随时间的变化如下图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是___________ ,原因是___________ 。
 与
与 的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
(1)仪器B的名称是

(2)打开B的活塞,A中发生反应生成
 ,请将化学方程式配平:
,请将化学方程式配平:
为使
 在D中被稳定剂充分吸收,滴加稀盐酸的速度宜
在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(3)关闭B的活塞,
 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,此时F中溶液的颜色不变,则装置C的作用是
,此时F中溶液的颜色不变,则装置C的作用是(4)已知在酸性条件下
 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为 释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
释放实验中,打开E的活塞,D中发生反应,则装置F的作用是(5)已吸收
 气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放 的浓度随时间的变化如下图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
的浓度随时间的变化如下图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
您最近一年使用:0次
解题方法
5 . 在点滴板①②③三个孔穴中分别滴入3滴新制的氯水,再向②③中分别滴入3滴NaBr溶液、NaI溶液;向④⑤两个孔穴中分别滴入3滴溴水,向⑤中滴入3滴NaI溶液。下列关于该实验的说法正确的是


| A.新制氯水中水的电离程度大于纯水的 |
B.①②③可得出氧化性: |
| C.若用久置的氯水进行上述实验,实验现象与原实验现象完全相同 |
| D.上述实验中可以探究同主族元素性质的递变规律 |
您最近一年使用:0次
2023-12-24更新
|
924次组卷
|
4卷引用:山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷
山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷广东省部分名校2023-2024学年高三上学期联合质量检测化学试题(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
6 . 过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行如图所示实验,实验①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列说法不正确的是
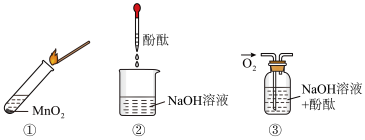
A.过氧化钠与水反应产生的气体为 |
B.过氧化钠与水反应需要 作催化剂 作催化剂 |
| C.实验②、③证明使酚酞褪色的不是氢氧化钠和氧气 |
D.过氧化钠与水反应生成了具有漂白性的 |
您最近一年使用:0次
2023-12-21更新
|
157次组卷
|
2卷引用:山西省大同市2023-2024学年高一上学期12月月考化学试题
7 . 探究氮及其化合物的性质,下列方案设计、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 常温下,将Fe片分别插入稀硝酸和浓硝酸中 | 一段时间后,前者有气体产生,后者无明显现象 | 稀硝酸的氧化性强于浓硝酸 |
| B | 将 样品溶于稀硫酸后,滴加KSCN溶液 样品溶于稀硫酸后,滴加KSCN溶液 | 溶液变红 |  晶体已氧化变质 晶体已氧化变质 |
| C | 向两个同规格烧瓶中分别装入同比例的 和 和 气体,并分别浸泡于热水和冷水中 气体,并分别浸泡于热水和冷水中 | 一段时间后,两烧瓶内颜色深浅不同 | 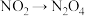 的转化存在限度 的转化存在限度 |
| D | 将盛有 固体的试管加热 固体的试管加热 | 试管底部固体消失,试管口有晶体凝结 |  固体受热易升华 固体受热易升华 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-10更新
|
1426次组卷
|
5卷引用:山西省晋中市平遥县第二中学校2023-2024学年高三上学期适应性训练四理科综合试题
山西省晋中市平遥县第二中学校2023-2024学年高三上学期适应性训练四理科综合试题浙江省温州市普通高中2024届高三上学期第一次适应性考试(一模)化学试题(已下线)热点08 表格型实验方案的设计与评价(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题03 化学实验基础(3大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
8 . 过硫酸钾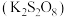 可用作破胶剂、聚合促进剂、氧化剂、分析试剂等,
可用作破胶剂、聚合促进剂、氧化剂、分析试剂等, 时分解。实验室模拟制备过硫酸钾并进行相关探究。回答下列问题:
时分解。实验室模拟制备过硫酸钾并进行相关探究。回答下列问题:
Ⅰ.利用电解法制备过硫酸钾,同时可制备 的方法如下:
的方法如下:

(1)过硫酸钾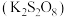 中硫元素处于最高正价。则
中硫元素处于最高正价。则 中过氧键的数目为
中过氧键的数目为_____  。
。
(2)“电解”时发生反应的离子方程式为_____ 。
(3) 为
为_____ (填化学式)。
Ⅱ.某同学预测过硫酸钾的分解产物有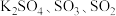 和
和 ,并用下图装置验证分解产物中含有
,并用下图装置验证分解产物中含有 和
和 (夹持及加热仪器已省略)。
(夹持及加热仪器已省略)。
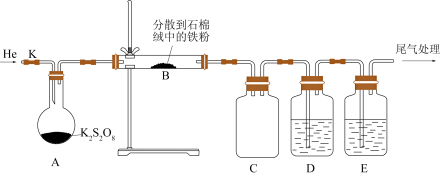
(4)实验时,通入He排尽装置中的空气后,应先加热装置_____ (填“A”或“B”)。
(5)装置B中石棉绒的作用为_____ 。装置D中的试剂为_____ 。
(6)装置E和装置D是否可以调换顺序?_____ (填“是”或“否”),原因是_____ 。
 可用作破胶剂、聚合促进剂、氧化剂、分析试剂等,
可用作破胶剂、聚合促进剂、氧化剂、分析试剂等, 时分解。实验室模拟制备过硫酸钾并进行相关探究。回答下列问题:
时分解。实验室模拟制备过硫酸钾并进行相关探究。回答下列问题:Ⅰ.利用电解法制备过硫酸钾,同时可制备
 的方法如下:
的方法如下:
(1)过硫酸钾
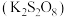 中硫元素处于最高正价。则
中硫元素处于最高正价。则 中过氧键的数目为
中过氧键的数目为 。
。(2)“电解”时发生反应的离子方程式为
(3)
 为
为Ⅱ.某同学预测过硫酸钾的分解产物有
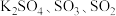 和
和 ,并用下图装置验证分解产物中含有
,并用下图装置验证分解产物中含有 和
和 (夹持及加热仪器已省略)。
(夹持及加热仪器已省略)。
(4)实验时,通入He排尽装置中的空气后,应先加热装置
(5)装置B中石棉绒的作用为
(6)装置E和装置D是否可以调换顺序?
您最近一年使用:0次
名校
解题方法
9 . 为探究氨及铵盐性质,将 晶体装入如图所示
晶体装入如图所示 形三通管两端进行微型实验(无水
形三通管两端进行微型实验(无水 可吸附
可吸附 ,形成
,形成 )。下列说法错误的是
)。下列说法错误的是
 晶体装入如图所示
晶体装入如图所示 形三通管两端进行微型实验(无水
形三通管两端进行微型实验(无水 可吸附
可吸附 ,形成
,形成 )。下列说法错误的是
)。下列说法错误的是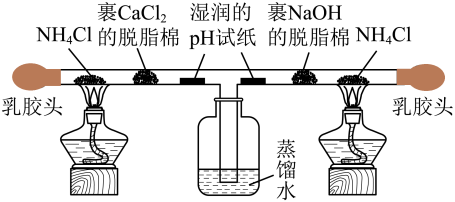
A. 晶体受热分解的化学方程式为 晶体受热分解的化学方程式为 |
B.同时点燃两个酒精灯后,两端湿润的 试纸均有颜色变化 试纸均有颜色变化 |
| C.实验过程中,竖直支管上方未见白烟产生 |
| D.停止加热后可以交替挤压两边乳胶头,使剩余的气体更充分吸收,减少污染 |
您最近一年使用:0次
2023-10-02更新
|
61次组卷
|
3卷引用:山西省怀仁市第一中学校2023-2024学年高三上学期第二次月考理综化学试题
10 . SO2是一种主要的大气污染物。利用高中所学化学知识探究其相关性质,装置图如下,请回答下列问题:
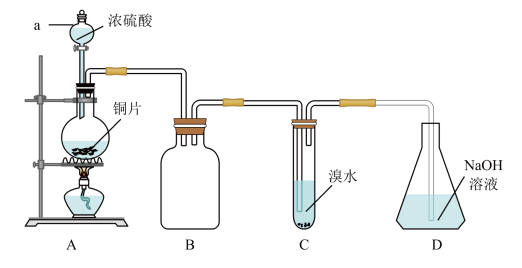
(1)仪器a的名称为_______ ,装置A中发生反应的化学方程式为_______ 。
(2)打开分液漏斗a的旋塞,浓硫酸不能顺利流下,原因可能是_______ ;加热前,圆底烧瓶中无需加入沸石,其原因是_______ 。
(3)装置B的作用是_______ ,装置C中反应的化学方程式_______ 。
(4)探究实验:向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3与NaClO恰好完全反应,此时反应的离子方程式为_______ 。
II.NaHSO3过量;
III.NaClO过量。
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪种情况,请完成下表:
已知: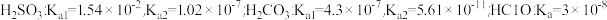

(1)仪器a的名称为
(2)打开分液漏斗a的旋塞,浓硫酸不能顺利流下,原因可能是
(3)装置B的作用是
(4)探究实验:向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3与NaClO恰好完全反应,此时反应的离子方程式为
II.NaHSO3过量;
III.NaClO过量。
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪种情况,请完成下表:
已知:
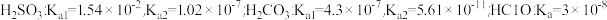
| 序号 | 实验操作 | 现象 | 结论 |
| ① | 加入少量CaCO3粉末 | I或Ⅱ | |
| ② | 滴加少量淀粉-KI溶液,振荡 | 溶液先变蓝后褪色 | |
| ③ | 滴加少量溴水,振荡 | II |
您最近一年使用:0次



