名校
解题方法
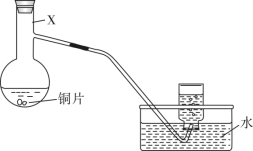
1 . 某小组利用如下装置(夹持装置略),探究浓、稀硝酸与铜反应的气体产物。回答下列问题:___________ 。
(2)请写出稀硝酸与铜反应的离子方程式___________ 。
(3)为节约药品用量,有人建议用具支试管(下图)代替仪器X,用试管代替集气瓶。为方便控制铜与硝酸反应的发生和停止,改进措施是___________ ;用改进后的装置进行铜与浓硝酸反应的实验,具支试管中产生的气体和排水收集到的气体___________ (填“相同”“不相同”)。 ,
, 仅得到一个
仅得到一个 ,稀硝酸与铜反应生成NO,
,稀硝酸与铜反应生成NO, 得到三个
得到三个 ,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较
,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较___________ ;角度二:同一种还原剂能被浓硝酸氧化,不能被稀硝酸氧化。根据角度二设计了如下装置,用以证明浓硝酸和稀硝酸的氧化性强弱关系。 ,目的是
,目的是___________ ;滴加浓硝酸后,当③中为稀硝酸时,其液面上方气体仍为无色;当③中为浓硝酸时,其液面上方气体由无色变为红棕色,反应的化学方程式为___________ 。
(5)有人提出(4)中角度二的验证实验不够简约,可将之前排水集气收集满NO的两支试管用橡胶塞塞紧,为防止气体逸出产生污染,在不取下胶塞的情况下向试管中分别加入稀硝酸、浓硝酸,简述其加入稀硝酸、浓硝酸的方法___________ 。
(2)请写出稀硝酸与铜反应的离子方程式
(3)为节约药品用量,有人建议用具支试管(下图)代替仪器X,用试管代替集气瓶。为方便控制铜与硝酸反应的发生和停止,改进措施是
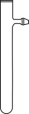
 ,
, 仅得到一个
仅得到一个 ,稀硝酸与铜反应生成NO,
,稀硝酸与铜反应生成NO, 得到三个
得到三个 ,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较
,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较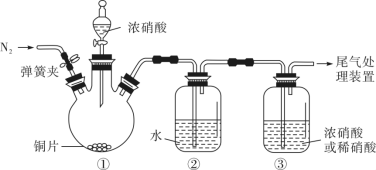
 ,目的是
,目的是(5)有人提出(4)中角度二的验证实验不够简约,可将之前排水集气收集满NO的两支试管用橡胶塞塞紧,为防止气体逸出产生污染,在不取下胶塞的情况下向试管中分别加入稀硝酸、浓硝酸,简述其加入稀硝酸、浓硝酸的方法
您最近一年使用:0次
解题方法
2 . 金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是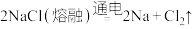 。请完成下列有关单质钠的问题。
。请完成下列有关单质钠的问题。
(1)保存金属钠的正确方法是___________ (填字母)。
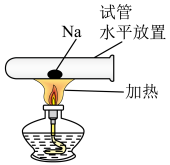
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),生成淡黄色固体,请写出该反应的化学方程式:___________ 。___________ 。
(4)将一小块金属钠投入 溶液中,发生反应的总化学方程式为
溶液中,发生反应的总化学方程式为___________ 。
(5)常温常压下,CO2和过氧化钠反应后,若固体质量增加了28g,反应中消耗的CO2的质量是___________ g。
(6)根据上述实验小组同学猜测过氧化钠可用作呼吸面具、潜水艇等中的供氧剂。请选择适当的化学试剂和实验仪器,用如图所示的实验装置进行实验,以证明过氧化钠可作供氧剂。请回答下列问题。___________ 。
②装置B中盛有饱和NaHCO3溶液,其作用是___________ 。
③装置D中盛放的试剂是___________ ,其目的是___________ 。
④当观察到试管F中收集满气体,为证明收集的气体是O2,还需要进行哪些实验操作?___________ 。
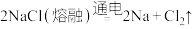 。请完成下列有关单质钠的问题。
。请完成下列有关单质钠的问题。(1)保存金属钠的正确方法是
| A.放在棕色瓶中 | B.放在石蜡油中 | C.放在水中 | D.放在煤油中 |
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),生成淡黄色固体,请写出该反应的化学方程式:
(4)将一小块金属钠投入
 溶液中,发生反应的总化学方程式为
溶液中,发生反应的总化学方程式为(5)常温常压下,CO2和过氧化钠反应后,若固体质量增加了28g,反应中消耗的CO2的质量是
(6)根据上述实验小组同学猜测过氧化钠可用作呼吸面具、潜水艇等中的供氧剂。请选择适当的化学试剂和实验仪器,用如图所示的实验装置进行实验,以证明过氧化钠可作供氧剂。请回答下列问题。
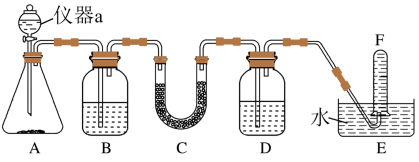
②装置B中盛有饱和NaHCO3溶液,其作用是
③装置D中盛放的试剂是
④当观察到试管F中收集满气体,为证明收集的气体是O2,还需要进行哪些实验操作?
您最近一年使用:0次
3 . 刘丽同学在实验室看到一瓶没有标签的白色粉末,经询问老师得知可能是食盐、碳酸钠或碳酸氢钠。于是她和自己小组的同学们一起对白色粉末的成分进探究。
【作出猜想】
(1)猜想1:可能是食盐 猜想2:可能是_____ 猜想3:可能是_____
【查阅资料】碳酸氢钠的性质:①水溶液呈碱性;②受热易分解;③能和氢氧化钠溶液发生化学反应:NaHCO3+NaOH=Na2CO3+H2O。
【实验探究】
(2)方案如下:
【反思评价】
(3)张伟同学认为通过上述实验还不能确定这种白色粉末就是碳酸钠,他的理由是_____ 。
【继续探究】
(4)小组同学们于是另取了少量白色粉末于试管中,管口塞上带导管的橡胶塞,再将导管通入澄清石灰水中,给试管加热,观察到澄清石灰水未变浑浊,得出该白色粉末是_____ 。
【交流总结】
(5)通过本组同学的探究,作为组长的刘丽同学根据已有的知识及实验情况,总结出了鉴别碳酸钠和碳酸氢钠的如下方法:
①用无色酚酞试液进行鉴别;②用加热的方法进行鉴别;③加入稀盐酸进行鉴别;④加入澄清石灰水进行鉴别。你认为其中可行的是_____ (填序号)。
【拓展延伸】
(6)碳酸氢钠俗称_____ ,在日常生活中用于生产食品,主要起发泡作用,通过上述研究性学习过程,你认为碳酸氢钠除用于食品工业外,在日常生活及实验室中还有哪些应用,试举一例:_____ 。
【作出猜想】
(1)猜想1:可能是食盐 猜想2:可能是
【查阅资料】碳酸氢钠的性质:①水溶液呈碱性;②受热易分解;③能和氢氧化钠溶液发生化学反应:NaHCO3+NaOH=Na2CO3+H2O。
【实验探究】
(2)方案如下:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量白色粉末于试管中,加入足量水溶解,滴加1~2滴无色酚酞试液 | 溶液变红色 | 该白色粉末不是 |
| 取少量该溶液,向其中滴加稀盐酸 | ||
| 再取少量该溶液,向其中滴加澄清石灰水 | 产生白色沉淀 | 该白色粉末是碳酸钠 |
【反思评价】
(3)张伟同学认为通过上述实验还不能确定这种白色粉末就是碳酸钠,他的理由是
【继续探究】
(4)小组同学们于是另取了少量白色粉末于试管中,管口塞上带导管的橡胶塞,再将导管通入澄清石灰水中,给试管加热,观察到澄清石灰水未变浑浊,得出该白色粉末是
【交流总结】
(5)通过本组同学的探究,作为组长的刘丽同学根据已有的知识及实验情况,总结出了鉴别碳酸钠和碳酸氢钠的如下方法:
①用无色酚酞试液进行鉴别;②用加热的方法进行鉴别;③加入稀盐酸进行鉴别;④加入澄清石灰水进行鉴别。你认为其中可行的是
【拓展延伸】
(6)碳酸氢钠俗称
您最近一年使用:0次
名校
4 . 某化学实验小组设计了如图装置制备Fe(OH)2:
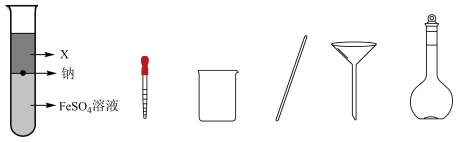
下列叙述错误的是

下列叙述错误的是
| A.配置FeSO4溶液所用的蒸馏水应先煮沸然后密封冷却 |
| B.若需用2.0 ml/LFeSO4溶液配制100 mL 0.1 mo/L FeSO4溶液,需要如图所示的玻璃仪器 |
| C.上层液体X的必须具备的物理性质有:不溶于水,密度小于钠 |
| D.预测实验现象为:产生气泡,钠会在两液体界面上下跳动,溶液层会出现白色胶状沉淀 |
您最近一年使用:0次
名校
解题方法
5 . 还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是
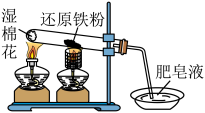

A.方程式为2Fe+3H2O(g) 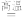 Fe2O3+3H2 Fe2O3+3H2 |
| B.肥皂液的主要作用是检验生成的H2 |
| C.湿棉花的主要作用是冷却试管,防止炸裂 |
| D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来 |
您最近一年使用:0次
6 . 某研究性学习小组查阅资料得知,漂白粉与盐酸溶液反应可制取氯气,化学方程式为 ,他们设计如下装置制取氯气并验证其性质。请回答下列问题:
,他们设计如下装置制取氯气并验证其性质。请回答下列问题:
(1)请用化学方程式表示漂白粉在空气中的漂白原理______ 。
(2)该实验中A部分的装置是_______ (填字母)。

(3)装置B中饱和食盐水的作用是______ 。
(4)装置C中的实验现象是______ 。
(5)实验结束时发现装置E中有色布条并没有褪色,此时取下E装置,加入少量蒸馏水,塞紧塞子振荡,有色布条褪色,写出有色布条褪色的原因是:_______ (用化学方程式和必要的文字说明)。
(6)装置F作用是______ ,实验结束后为了检验溶液中含有 ,请写出实验方案:
,请写出实验方案:______ 。
 ,他们设计如下装置制取氯气并验证其性质。请回答下列问题:
,他们设计如下装置制取氯气并验证其性质。请回答下列问题:
(1)请用化学方程式表示漂白粉在空气中的漂白原理
(2)该实验中A部分的装置是

(3)装置B中饱和食盐水的作用是
(4)装置C中的实验现象是
(5)实验结束时发现装置E中有色布条并没有褪色,此时取下E装置,加入少量蒸馏水,塞紧塞子振荡,有色布条褪色,写出有色布条褪色的原因是:
(6)装置F作用是
 ,请写出实验方案:
,请写出实验方案:
您最近一年使用:0次
解题方法
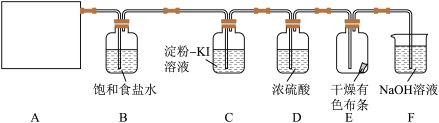
7 . 某同学利用如图所示装置(夹持装置已省略)制备氯气并探究其部分性质。
请回答下列问题:
(1)装置A中发生反应的离子方程式为___________ ;装置B的作用为___________ ;装置C中的试剂为___________ 。
(2)实验开始时,先点燃A处酒精灯,待观察到D中硬质玻璃管内充满黄绿色气体时,再点燃D处酒精灯,目的是___________ 。
(3)装置D中发生反应的化学方程式为___________ 。
(4)将装置E中出来的尾气通入滴有酚酞的NaOH溶液中,发生反应的离子方程式为___________ ;观察到溶液红色褪去,甲同学认为是反应生成了漂白性物质导致的,乙同学则认为是NOH被完全消耗导致的。指导老师做了如下实验对甲、乙同学的猜想进行验证:取适量反应后的溶液于试管1中,加入过量___________ ,溶液无明显现象,证明乙同学猜想错误;另取适量原反应后的溶液于试管2中,加入适量___________ ,溶液变红,证明甲同学猜想正确。(供选择的试剂:稀硫酸、NaOH溶液、紫色石蕊溶液、无色酚酞溶液、氯水)

请回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)实验开始时,先点燃A处酒精灯,待观察到D中硬质玻璃管内充满黄绿色气体时,再点燃D处酒精灯,目的是
(3)装置D中发生反应的化学方程式为
(4)将装置E中出来的尾气通入滴有酚酞的NaOH溶液中,发生反应的离子方程式为
您最近一年使用:0次
2023-12-03更新
|
101次组卷
|
2卷引用:云南省楚雄州2023-2024学年高一上学期期中教育学业质量监测化学试题
8 . 在初中化学“金属的性质”中有如下实验:将无锈铁钉浸入CuSO4溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
【提出问题】Al和CuSO4溶液也能发生化学反应吗?
(1)预测Al能和CuSO4溶液反应,理由是_______ 。
【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。
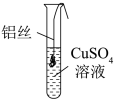
(2)铝丝表面未出现红色物质,原因是_______ (用化学方程式解释)。
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
(3)填写实验报告单:
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为_______ 。
(5)欲加快Al和CuSO4溶液的反应,可加入的物质是_______ (填一种即可)。
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是_______(填序号)。
【提出问题】Al和CuSO4溶液也能发生化学反应吗?
(1)预测Al能和CuSO4溶液反应,理由是
【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。

(2)铝丝表面未出现红色物质,原因是
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
(3)填写实验报告单:
| 序号 | 实验现象 | 结论与解释 |
| ① | 铝丝表面有少量气泡;铝丝周围出现蓝绿色物质 | CuSO4溶液呈弱酸性,与Al反应产生的气体是 |
| ② | 24h后,铝丝仍光亮;48h后,铝丝表面出现少量红色物质 | 红色物质是 |
| ③ | 铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色:两层溶液界面清晰 | 反应生成的Al2(SO4)3为无色;Al2(SO4)3溶液的密度 |
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为
(5)欲加快Al和CuSO4溶液的反应,可加入的物质是
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是_______(填序号)。
| A.食醋 | B.食用油 | C.面粉 | D.咸菜 |
您最近一年使用:0次
名校
解题方法
9 . 某兴趣小组设计如图所示装置制取SO2,研究其性质,并进一步探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。
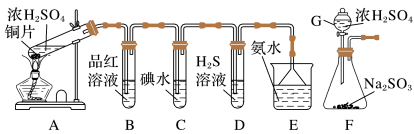
(1)仪器G的名称是___________ 。
(2)写出A中反应的化学方程式___________ 。
(3)装置B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则装置C中反应的离子方程式为___________ 。证明SO2具有氧化性的实验现象是___________ 。
(4)为了实现绿色环保的目标,某同学设计装置F来代替装置A.与装置A相比,装置F的优点是___________ (写出一条即可)。
(5)若选用装置F制取O2可选用的试剂是___________ 。
(6)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。
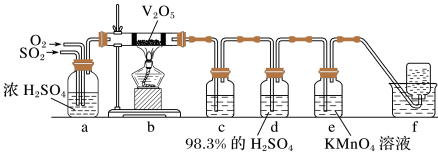
已知:SO3遇水剧烈反应,放出大量的热,产生酸雾。98.3%的H2SO4可以吸收SO3和酸雾。
供选择试剂:蒸馏水、0.5mol·L-1BaCl2溶液、98.3%的H2SO4、2.0mol·L-1NaOH溶液、KMnO4溶液。
①c中应选用的试剂是___________ ,e中试剂的作用是___________ ,f中收集的气体是___________ 。
②甲同学提出用饱和NaHSO3溶液代替98.3%的H2SO4,乙同学提出质疑,认为此方案不可行,请简述乙同学认为不可行的理由:___________ 。

(1)仪器G的名称是
(2)写出A中反应的化学方程式
(3)装置B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则装置C中反应的离子方程式为
(4)为了实现绿色环保的目标,某同学设计装置F来代替装置A.与装置A相比,装置F的优点是
(5)若选用装置F制取O2可选用的试剂是
(6)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。

已知:SO3遇水剧烈反应,放出大量的热,产生酸雾。98.3%的H2SO4可以吸收SO3和酸雾。
供选择试剂:蒸馏水、0.5mol·L-1BaCl2溶液、98.3%的H2SO4、2.0mol·L-1NaOH溶液、KMnO4溶液。
①c中应选用的试剂是
②甲同学提出用饱和NaHSO3溶液代替98.3%的H2SO4,乙同学提出质疑,认为此方案不可行,请简述乙同学认为不可行的理由:
您最近一年使用:0次
名校
解题方法
10 . 某同学在实验室制备氨气,并探究氨气的部分性质。
实验一:制备氨气,探究氨气的溶解性
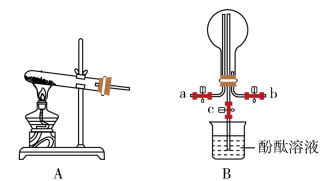
(1)该同学制备氨气的化学方程式为___________ ;B中用圆底烧瓶收集氨气时,请你选择氨气的进气口___________ (填“a”或b)。
(2)若观察到装置B烧瓶内产生了红色喷泉,则说明氨气具有的性质是___________ 和___________ ;你认为引发喷泉的操作应是___________ 。
实验二:探究氨气的还原性
已知: 呈红色固体,在酸性溶液中不稳定:
呈红色固体,在酸性溶液中不稳定: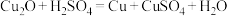 。
。
(3)装置 用于制备氨气,仪器的连接顺序为
用于制备氨气,仪器的连接顺序为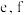 接
接___________ ,装置 的作用是
的作用是___________ 。实验开始前应先通一段时间的 ,其目的是
,其目的是___________ 。
(4)反应结束后装置 中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:
中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:
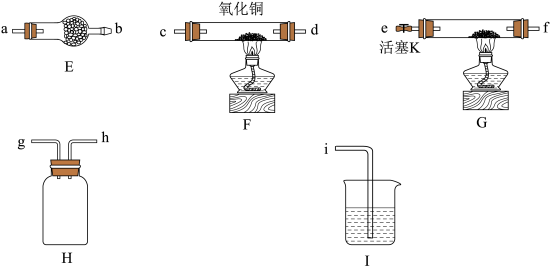
取 红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体
红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体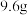 ,则红色固体的成分及其物质的量为
,则红色固体的成分及其物质的量为___________ 。
实验一:制备氨气,探究氨气的溶解性

(1)该同学制备氨气的化学方程式为
(2)若观察到装置B烧瓶内产生了红色喷泉,则说明氨气具有的性质是
实验二:探究氨气的还原性
已知:
 呈红色固体,在酸性溶液中不稳定:
呈红色固体,在酸性溶液中不稳定: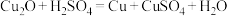 。
。(3)装置
 用于制备氨气,仪器的连接顺序为
用于制备氨气,仪器的连接顺序为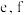 接
接 的作用是
的作用是 ,其目的是
,其目的是
(4)反应结束后装置
 中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:
中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:取
 红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体
红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体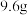 ,则红色固体的成分及其物质的量为
,则红色固体的成分及其物质的量为
您最近一年使用:0次



