名校
解题方法
1 . 苯乙酸铜是合成传感材料、催化剂——纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线:① +2H2O+H2SO4
+2H2O+H2SO4
 +NH4HSO4
+NH4HSO4
②2 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+2H2O
)2Cu+2H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

Ⅰ.三颈烧瓶中加入水,加入浓硫酸,溶液加热至100℃,缓缓滴加40g苯乙腈( )到硫酸溶液中,然后升温至130℃,制得苯乙酸,加适量冷水,分离出苯乙酸粗品。
)到硫酸溶液中,然后升温至130℃,制得苯乙酸,加适量冷水,分离出苯乙酸粗品。
Ⅱ.将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2后过滤,滤液静置一段时间,析出苯乙酸铜晶体。(已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇)
回答下列问题:
(1)在装置中,仪器c的名称是___________ ,其作用是___________ 。
(2)步骤Ⅰ中加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是___________ 。
(3)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________ 。
(4)步骤Ⅱ中将苯乙酸加入到乙醇与水的混合溶剂中,其混合溶剂中乙醇的作用是___________ 。
(5)分离苯乙酸粗品的方法是___________ ,提纯粗苯乙酸的方法是___________ 。若最终得到38 g纯品,则苯乙酸的产率是___________ 。(保留两位有效数字)
 +2H2O+H2SO4
+2H2O+H2SO4
 +NH4HSO4
+NH4HSO4②2
 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+2H2O
)2Cu+2H2O制备苯乙酸的装置示意图如下(加热和夹持装置等略):

Ⅰ.三颈烧瓶中加入水,加入浓硫酸,溶液加热至100℃,缓缓滴加40g苯乙腈(
 )到硫酸溶液中,然后升温至130℃,制得苯乙酸,加适量冷水,分离出苯乙酸粗品。
)到硫酸溶液中,然后升温至130℃,制得苯乙酸,加适量冷水,分离出苯乙酸粗品。Ⅱ.将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2后过滤,滤液静置一段时间,析出苯乙酸铜晶体。(已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇)
回答下列问题:
(1)在装置中,仪器c的名称是
(2)步骤Ⅰ中加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
(3)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
(4)步骤Ⅱ中将苯乙酸加入到乙醇与水的混合溶剂中,其混合溶剂中乙醇的作用是
(5)分离苯乙酸粗品的方法是
您最近一年使用:0次
2021-02-08更新
|
298次组卷
|
2卷引用:重庆八中2020-2021学年高二上学期期末考试化学试题
2 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
 + H2O+H2SO4
+ H2O+H2SO4
 +NH4HSO4
+NH4HSO4
 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________ 。
(2)将a中的溶液加热至100℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器b的作用是_____________________ ;仪器c的名称是______________ ,其作用是___________________________________________ 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________ 。下列仪器中可用于分离苯乙酸粗品的是________________ (填标号)。
(3)提纯粗苯乙酸的方法是_____________ ,最终得到44 g纯品,则苯乙酸的产率是________ 。
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________ 。
 + H2O+H2SO4
+ H2O+H2SO4
 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
(2)将a中的溶液加热至100℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器b的作用是
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
| A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2019-01-30更新
|
3809次组卷
|
18卷引用:重庆市主城区七校2019-2020学年高二下学期期末联考化学试题
重庆市主城区七校2019-2020学年高二下学期期末联考化学试题2015-2016学年陕西西安铁一中学高二下开学考试化学试卷2015-2016学年山西省怀仁一中高二下第二次月考化学试卷2014-2015学年湖南省双峰一中高二下期中理科化学试卷广西南宁市第三中学2019-2020学年高二上学期期中考试化学(理)试题第三章 烃的含氧衍生物——B 拓展区 综合拓展(人教版选修5)黑龙江省哈尔滨市哈师大附中2020-2021学年高二下学期期中考试化学试题(已下线)第一章 有机化合物的结构特点与研究方法 章末测试(A)-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)福建省莆田第一中学2021-2022学年高二上学期期中考试化学试题甘肃省永昌县第一高级中学2021-2022学年高二下学期期末考试化学试题湖北省武汉中学2022-2023学年高二下学期5月月考化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(全国大纲卷)(已下线)2013-2014江西省临川一中高一下学期期末考试化学试卷(已下线)2013-2014学年江西省临川一中高一(下)期末考试化学试卷2016届黑龙江省哈尔滨三中高三上第三次检测理综化学试卷会做实验2020届高三化学实验复习——过滤、蒸馏、冷凝、洗气装置的创新应用【选择15+有机工艺10题突破】(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
3 . 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

回答问题:
(1)在a中加入 无水苯和少量铁屑。在b中小心加入
无水苯和少量铁屑。在b中小心加入 液溴。向a中滴入几滴液溴,有白雾产生,写出产生白雾的化学方程式:
液溴。向a中滴入几滴液溴,有白雾产生,写出产生白雾的化学方程式:_______ 。仪器c的作用有两个:一是导气,二是兼起_______ 的作用。
(2)反应过程中,a外壁温度升高,为提高原料利用率,需利用温度计控制温度,适宜的温度范围为_______ (填序号)。
a.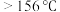 B.
B. C.
C.
(3)液溴滴完后,经过下列步骤分离提纯:①蒸馏;②水洗;③用干燥剂干燥;④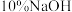 溶液洗;⑤水洗。正确的操作顺序为_______。
溶液洗;⑤水洗。正确的操作顺序为_______。
(4)为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入_______ ;但该实验不够严密,为此必须在导管c、d之间加上一盛有_______ 的洗气瓶。

| 苯 | 溴 | 溴苯 | |
密度/ | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入
 无水苯和少量铁屑。在b中小心加入
无水苯和少量铁屑。在b中小心加入 液溴。向a中滴入几滴液溴,有白雾产生,写出产生白雾的化学方程式:
液溴。向a中滴入几滴液溴,有白雾产生,写出产生白雾的化学方程式:(2)反应过程中,a外壁温度升高,为提高原料利用率,需利用温度计控制温度,适宜的温度范围为
a.
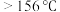 B.
B. C.
C.
(3)液溴滴完后,经过下列步骤分离提纯:①蒸馏;②水洗;③用干燥剂干燥;④
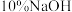 溶液洗;⑤水洗。正确的操作顺序为_______。
溶液洗;⑤水洗。正确的操作顺序为_______。| A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
您最近一年使用:0次
2022-04-28更新
|
168次组卷
|
2卷引用:重庆市朝阳中学2021-2022学年高二下学期期中考试化学试题
名校
4 . 有机化工中3,5-二甲氧基苯酚是重要的有机合成中间体,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
(1)1mol间苯三酚完全燃烧需要_____ molO2。
(2)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是________ 。
②萃取用到的分液漏斗分液时有机层在分液漏斗的____ 填(“上”或“下”)层。
(3)分离得到的有机层依次用饱和NaHCO3溶液、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是__________________________ ;
(4)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_________ (填字母)。
a.蒸馏除去乙醚 b.冷却结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(5)写出反应中可能出现的副产物结构简式______________ (只要写一种即可)。

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
| 甲醇 | 64. 7 |  | 0. 7915 | 易溶于水 |
| 乙醚 | 34. 5 |  | 0. 7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 |  | 33 ~36 |  | 易溶于甲醇、乙醚,微溶于水 |
(2)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是
②萃取用到的分液漏斗分液时有机层在分液漏斗的
(3)分离得到的有机层依次用饱和NaHCO3溶液、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是
(4)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是
a.蒸馏除去乙醚 b.冷却结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(5)写出反应中可能出现的副产物结构简式
您最近一年使用:0次
2017-12-02更新
|
450次组卷
|
3卷引用:重庆市万州三中2018-2019学年高二下学期期中考试化学试题
解题方法
5 . 三氯化磷(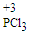 )和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
I.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3。实验室制取PCl3的装置示意图和有关数据如下:
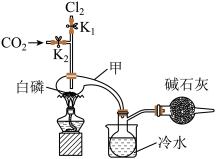
实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作顺序是:打开K2,使体系中充满CO2,再加入白磷,打开K1,通入氯气,再加热。
(1)干燥管中碱石灰的作用是_______________ 。
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是____________________ (已知亚磷酸H3PO3是二元弱酸:H3PO3 H++ H2PO
H++ H2PO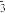 ,H2PO3-
,H2PO3- H++HPO
H++HPO )。
)。
(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用____________方法除去PC13中的POCl3制备纯净的PCl3。
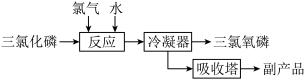
II.氯化水解法生产POC13
主要反应是:PC13+C12+H2O=POC13+2HCl,流程如下:
(4)若将0.01mol POCl3加到水中水解,再与含2.4gNaOH的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是_____________ [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
(5)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量NaOH 溶液,再加稀硝酸至酸性。
B.向锥形瓶中加入0.1000 mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL。
已知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_____________ (填字母序号),滴定终点的现象为__________________
A.FeCl2B.NH4Fe(SO4)2C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确。如无此操作,所测Cl元素含量将会______________ (填“偏大”、“偏小”或“不变”)。
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为______________ 。
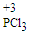 )和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。I.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3。实验室制取PCl3的装置示意图和有关数据如下:

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)干燥管中碱石灰的作用是
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是
 H++ H2PO
H++ H2PO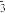 ,H2PO3-
,H2PO3- H++HPO
H++HPO )。
)。(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用____________方法除去PC13中的POCl3制备纯净的PCl3。
| A.萃取 | B.过滤 | C.蒸馏 | D.蒸发结晶 |
II.氯化水解法生产POC13
主要反应是:PC13+C12+H2O=POC13+2HCl,流程如下:

(4)若将0.01mol POCl3加到水中水解,再与含2.4gNaOH的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是
(5)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量NaOH 溶液,再加稀硝酸至酸性。
B.向锥形瓶中加入0.1000 mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL。
已知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是
A.FeCl2B.NH4Fe(SO4)2C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确。如无此操作,所测Cl元素含量将会
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为
您最近一年使用:0次



