名校
1 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
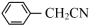 (苯乙腈)+2H2O+H2SO4
(苯乙腈)+2H2O+H2SO4
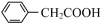 (苯乙酸)+NH4HSO4
(苯乙酸)+NH4HSO4
2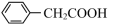 +Cu(OH)2→
+Cu(OH)2→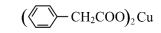 +2H2O
+2H2O
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略);
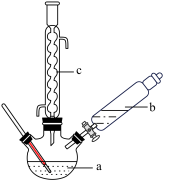
已知:苯乙酸的熔点为76.5℃,微溶于冷水,易溶于热水,易溶于乙醇。回答下列问题:
(1)在250mL三口瓶a中加入70mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是_______ 。
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中仪器c的名称是_______ 。
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______ 。下列仪器中可用于分离苯乙酸粗品的是_______ (填序号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)实验通过蒸发浓缩、冷却结晶、_______ 、洗涤等提纯苯乙酸,最终得到44g纯品,则苯乙酸的产率是_______ (保留小数点后一位)。
(5)用 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是_______ 。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是_______ 。
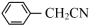 (苯乙腈)+2H2O+H2SO4
(苯乙腈)+2H2O+H2SO4
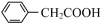 (苯乙酸)+NH4HSO4
(苯乙酸)+NH4HSO42
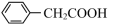 +Cu(OH)2→
+Cu(OH)2→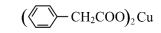 +2H2O
+2H2O制备苯乙酸的装置示意图如图所示(加热和夹持装置等略);

已知:苯乙酸的熔点为76.5℃,微溶于冷水,易溶于热水,易溶于乙醇。回答下列问题:
(1)在250mL三口瓶a中加入70mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中仪器c的名称是
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)实验通过蒸发浓缩、冷却结晶、
(5)用
 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2022-03-30更新
|
70次组卷
|
2卷引用:湖南省湘潭市湘潭县第一中学2021-2022学年高二下学期月考化学试题
2 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
 + H2O+H2SO4
+ H2O+H2SO4
 +NH4HSO4
+NH4HSO4
 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________ 。
(2)将a中的溶液加热至100℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器b的作用是_____________________ ;仪器c的名称是______________ ,其作用是___________________________________________ 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________ 。下列仪器中可用于分离苯乙酸粗品的是________________ (填标号)。
(3)提纯粗苯乙酸的方法是_____________ ,最终得到44 g纯品,则苯乙酸的产率是________ 。
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________ 。
 + H2O+H2SO4
+ H2O+H2SO4
 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
(2)将a中的溶液加热至100℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器b的作用是
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
| A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2019-01-30更新
|
3809次组卷
|
18卷引用:2014-2015学年湖南省双峰一中高二下期中理科化学试卷
2014-2015学年湖南省双峰一中高二下期中理科化学试卷2015-2016学年陕西西安铁一中学高二下开学考试化学试卷2015-2016学年山西省怀仁一中高二下第二次月考化学试卷广西南宁市第三中学2019-2020学年高二上学期期中考试化学(理)试题第三章 烃的含氧衍生物——B 拓展区 综合拓展(人教版选修5)重庆市主城区七校2019-2020学年高二下学期期末联考化学试题黑龙江省哈尔滨市哈师大附中2020-2021学年高二下学期期中考试化学试题(已下线)第一章 有机化合物的结构特点与研究方法 章末测试(A)-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)福建省莆田第一中学2021-2022学年高二上学期期中考试化学试题甘肃省永昌县第一高级中学2021-2022学年高二下学期期末考试化学试题湖北省武汉中学2022-2023学年高二下学期5月月考化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(全国大纲卷)(已下线)2013-2014江西省临川一中高一下学期期末考试化学试卷(已下线)2013-2014学年江西省临川一中高一(下)期末考试化学试卷2016届黑龙江省哈尔滨三中高三上第三次检测理综化学试卷会做实验2020届高三化学实验复习——过滤、蒸馏、冷凝、洗气装置的创新应用【选择15+有机工艺10题突破】(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
名校
解题方法
3 . 乙酰乙酸乙酯是一种无色或微黄色透明液体,是重要的有机合成原料,广泛应用于医药、塑料、染料、香料、清漆及添加剂等行业。实验室常用乙酸乙酯、金属钠、乙酸等试剂制备,反应原理: ,其中乙醇钠(CH3CH2ONa)在反应中起到催化剂的作用。
,其中乙醇钠(CH3CH2ONa)在反应中起到催化剂的作用。
注:含有烯醇式结构(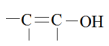 )的有机物遇
)的有机物遇 溶液会变紫色。
溶液会变紫色。
实验步骤:
I.物质制备:向三颈烧瓶中加入10.0mL乙酸乙酯粗品(含乙酸乙酯8.8g和少量乙醇),迅速加入0.1g切细的金属钠(钠颗粒)。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
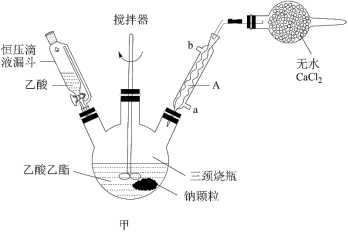
II.分离、提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用3mL无水乙酸乙酯萃取两次,分液。
③将①②所得有机层合并,加入5mL5%的碳酸钠溶液洗涤(中和乙酸)至中性,再用无水硫酸镁干燥酯层。先在常压下水浴加热蒸去乙酸乙酯(回收),用水泵将残留的乙酸乙酯抽尽;将剩余液减压蒸溜(若常压蒸馏,乙酰乙酸乙酯很易分解而降低产量),收集产品乙酰乙酸乙酯5.1g。
请回答下列有关问题:
(1)仪器A的优点是________ ;分离、提纯操作①中使用的分离仪器是________ 。
(2)本实验中迅速加入切细的金属钠(钠颗粒);有的实验是在圆底烧瓶中将金属钠与二甲苯(沸程138~145℃)共热,待钠熔化后,再用力来回振摇圆底烧瓶,制得细粒状钠珠。这样做的目的是___________ 。
(3)加入饱和氯化钠溶液的目的为___________ 。
(4)分离、提纯操作③洗涤时的 溶液能否换成
溶液能否换成 溶液,并简述其理由:
溶液,并简述其理由:_____ 。
(5)室温下,乙酰乙酸乙酯是一个酮式和烯醇式的混合物所形成的平衡体系(如图乙所示),若用实验方法证明,可选用的化学试剂为___________ (写出一种即可)。

(6)上述实验中乙酰乙酸乙酯的产率为___________ (保留两位有效数字)。
 ,其中乙醇钠(CH3CH2ONa)在反应中起到催化剂的作用。
,其中乙醇钠(CH3CH2ONa)在反应中起到催化剂的作用。| 物质 | 沸点/℃ | 相对分子质量 | 水中溶解性 |
| 乙酸乙酯 | 77.2 | 88 | 难溶 |
| 乙酰乙酸乙酯 | 181 | 130 | 微溶 |
| 乙酸 | 118 | 60 | 易溶 |
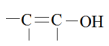 )的有机物遇
)的有机物遇 溶液会变紫色。
溶液会变紫色。实验步骤:
I.物质制备:向三颈烧瓶中加入10.0mL乙酸乙酯粗品(含乙酸乙酯8.8g和少量乙醇),迅速加入0.1g切细的金属钠(钠颗粒)。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。

II.分离、提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用3mL无水乙酸乙酯萃取两次,分液。
③将①②所得有机层合并,加入5mL5%的碳酸钠溶液洗涤(中和乙酸)至中性,再用无水硫酸镁干燥酯层。先在常压下水浴加热蒸去乙酸乙酯(回收),用水泵将残留的乙酸乙酯抽尽;将剩余液减压蒸溜(若常压蒸馏,乙酰乙酸乙酯很易分解而降低产量),收集产品乙酰乙酸乙酯5.1g。
请回答下列有关问题:
(1)仪器A的优点是
(2)本实验中迅速加入切细的金属钠(钠颗粒);有的实验是在圆底烧瓶中将金属钠与二甲苯(沸程138~145℃)共热,待钠熔化后,再用力来回振摇圆底烧瓶,制得细粒状钠珠。这样做的目的是
(3)加入饱和氯化钠溶液的目的为
(4)分离、提纯操作③洗涤时的
 溶液能否换成
溶液能否换成 溶液,并简述其理由:
溶液,并简述其理由:(5)室温下,乙酰乙酸乙酯是一个酮式和烯醇式的混合物所形成的平衡体系(如图乙所示),若用实验方法证明,可选用的化学试剂为

(6)上述实验中乙酰乙酸乙酯的产率为
您最近一年使用:0次
2022-03-24更新
|
758次组卷
|
3卷引用:湖南省益阳市第一中学2021-2022学年高二下学期期中考试化学试题
4 . 二草酸合铜(Ⅱ)酸钾 可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的 溶液,搅拌下滴加足量NaOH溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,搅拌下滴加足量NaOH溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸( )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩、冷却结晶、经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)Ⅰ中的黑色沉淀是_____ (写化学式)。
(2)由 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是_____ (填仪器名称)。

(3)若要配制450mL的硫酸铜溶液,所需要的常量瓶规格为_____ mL。
(4)Ⅱ中原料配比为 ,该反应的化学方程式为
,该反应的化学方程式为_____ 。
(5)Ⅲ中应采用_____ 进行加热。
(6)Ⅳ中“一系列操作”包括_____ 。
 可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的
 溶液,搅拌下滴加足量NaOH溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,搅拌下滴加足量NaOH溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。Ⅱ.向草酸(
 )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩、冷却结晶、经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)Ⅰ中的黑色沉淀是
(2)由
 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
(3)若要配制450mL的硫酸铜溶液,所需要的常量瓶规格为
(4)Ⅱ中原料配比为
 ,该反应的化学方程式为
,该反应的化学方程式为(5)Ⅲ中应采用
(6)Ⅳ中“一系列操作”包括
您最近一年使用:0次
5 . 氧钒(+4价)碱式碳酸铵为紫红色晶体,难溶于水,化学式为(NH4)5[(VO)6(CO3)4(OH)9]∙10H2O,是制备催化剂的基础原料。
Ⅰ.实验室以VOCl2和NH4HCO3为原料制备氧钒(+4价)碱式碳酸铵晶体的装置如图所示。已知+4价钒的化合物易被氧化。回答下列问题:

(1)仪器X的名称为_______ ,橡皮管的作用为_______ 。
(2)实验步骤①:实验开始时,先_______ (填实验操作),当D中溶液变浑浊,关闭K1,进行上述实验操作的目的是_______ 。
实验步骤②:打开K2,滴入溶液,开始反应。
(3)若无装置B导致的结果是_______ 。
(4)写出装置C中生成氧钒(+4价)碱式碳酸铵晶体的化学方程式_______ 。
Ⅱ.以V2O5为原料合成该晶体的工艺流程如下图:

(5)已知N2H4为二元弱碱,N2H4与盐酸反应生成的产物N2H5Cl属于_______ (填“正盐”、“酸式盐”或“碱式盐”)。制备VOCl2溶液时,如不加N2H4也能制备VOCl2溶液,则该反应的离子方程式为_______ 。
Ⅲ.测定粗产品[氧钒(+4价)碱式碳酸铵晶体]中钒的含量。实验步骤如下:称量a g产品于锥形瓶中,用25.00mL蒸馏水与35mL稀硫酸溶解后,加入0.02mol/L KMnO4溶液至稍过量,充分反应后继续滴加1.5%的NaNO2溶液至稍过量,再用尿素去除过量NaNO2,滴入几滴铁氰化钾溶液,最后用0.15 mol/L (NH4)2Fe(SO4)2标准溶液滴定,滴定至终点消耗标准溶液的体积为b mL。
(6)产品中钒的质量分数为_______ %(提示:滴定反应为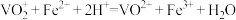 )。
)。
Ⅳ.钒元素的常见离子有V2+、V3+、VO2+、 ,某同学用如图装置验证氧化性
,某同学用如图装置验证氧化性 强于V3+。
强于V3+。

(7)接通电路后,乙装置的现象是_______ ﹔正极的电极反应为_______ 。
Ⅰ.实验室以VOCl2和NH4HCO3为原料制备氧钒(+4价)碱式碳酸铵晶体的装置如图所示。已知+4价钒的化合物易被氧化。回答下列问题:

(1)仪器X的名称为
(2)实验步骤①:实验开始时,先
实验步骤②:打开K2,滴入溶液,开始反应。
(3)若无装置B导致的结果是
(4)写出装置C中生成氧钒(+4价)碱式碳酸铵晶体的化学方程式
Ⅱ.以V2O5为原料合成该晶体的工艺流程如下图:

(5)已知N2H4为二元弱碱,N2H4与盐酸反应生成的产物N2H5Cl属于
Ⅲ.测定粗产品[氧钒(+4价)碱式碳酸铵晶体]中钒的含量。实验步骤如下:称量a g产品于锥形瓶中,用25.00mL蒸馏水与35mL稀硫酸溶解后,加入0.02mol/L KMnO4溶液至稍过量,充分反应后继续滴加1.5%的NaNO2溶液至稍过量,再用尿素去除过量NaNO2,滴入几滴铁氰化钾溶液,最后用0.15 mol/L (NH4)2Fe(SO4)2标准溶液滴定,滴定至终点消耗标准溶液的体积为b mL。
(6)产品中钒的质量分数为
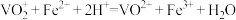 )。
)。Ⅳ.钒元素的常见离子有V2+、V3+、VO2+、
 ,某同学用如图装置验证氧化性
,某同学用如图装置验证氧化性 强于V3+。
强于V3+。
(7)接通电路后,乙装置的现象是
您最近一年使用:0次
解题方法
6 . 实验室可采用苯乙腈( )(相对分子质量为117)为原料制备苯乙酸(相对分子质量136):
)(相对分子质量为117)为原料制备苯乙酸(相对分子质量136):


 。制备苯乙酸的装置示意图如下(加热和夹持装置等略):
。制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
在250mL三颈烧瓶a中加入70mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应。回答下列问题:
(1)在装置中仪器c的名称是_______ ,其作用是_______ 。
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______ 。
(3)提纯粗苯乙酸的方法是_______ ,最终得到44g纯品,则苯乙酸的产率为_______ 。(保留两位有效数字)
(4)苯乙酸铜是合成纳米氧化铜的重要前驱体之一、将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入 ,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。混合溶剂中乙醇的作用是
,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。混合溶剂中乙醇的作用是_______ 。写出此步发生反应的化学方程式_______ 。
 )(相对分子质量为117)为原料制备苯乙酸(相对分子质量136):
)(相对分子质量为117)为原料制备苯乙酸(相对分子质量136):


 。制备苯乙酸的装置示意图如下(加热和夹持装置等略):
。制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
在250mL三颈烧瓶a中加入70mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应。回答下列问题:
(1)在装置中仪器c的名称是
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
(3)提纯粗苯乙酸的方法是
(4)苯乙酸铜是合成纳米氧化铜的重要前驱体之一、将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入
 ,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。混合溶剂中乙醇的作用是
,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。混合溶剂中乙醇的作用是
您最近一年使用:0次
名校
7 . 氯化亚(SOCl2)在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备SOCl2。

已知:①SOCl2是一种液态化合物,沸点为77℃
②SOCl2遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
③实验室合成SOCl2原理:
请回答以下问题:
(1)仪器c的名称是________ ,f中的最佳试剂是________ (填字母符号)。
A.碱石灰 B.浓硫酸 C.NaOH溶液 D.无水氯化钙
(2)实验室用浓盐酸与MnO2粉末反应制Cl2的化学方程式为______ 。
(3)SOCl2与水反应的化学方程式为________ 。
(4)下列三种制备SO2的方案中最佳选择是________ 。
(5)装置g中产生的Cl2经过e、d后进入三颈烧瓶,e中的试剂为________ 。
(6)实验结束后,若反应中消耗Cl2的体积为896 mL(已转化为标准状况,SO2足量),最后得到4.76 g SOC12,则SOCl2的产率为________ ( )。
)。

已知:①SOCl2是一种液态化合物,沸点为77℃
②SOCl2遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
③实验室合成SOCl2原理:

请回答以下问题:
(1)仪器c的名称是
A.碱石灰 B.浓硫酸 C.NaOH溶液 D.无水氯化钙
(2)实验室用浓盐酸与MnO2粉末反应制Cl2的化学方程式为
(3)SOCl2与水反应的化学方程式为
(4)下列三种制备SO2的方案中最佳选择是
| 方案 | 甲 | 乙 | 丙 |
| 发生装置 |
|
|
|
| 所选试剂 | 70% H2SO4和K2SO3粉末 | 70% H2SO4和铜片 |  和Na2SO3粉末 和Na2SO3粉末 |
(5)装置g中产生的Cl2经过e、d后进入三颈烧瓶,e中的试剂为
(6)实验结束后,若反应中消耗Cl2的体积为896 mL(已转化为标准状况,SO2足量),最后得到4.76 g SOC12,则SOCl2的产率为
 )。
)。
您最近一年使用:0次
解题方法
8 . 以菱铁矿(主要成分是碳酸亚铁FeCO3)为原料制取铁的流程如图:

(1)“浸取”时通常将菱铁矿石进行粉碎,其目的是__________ (填“加快”或“减慢”)反应速率,写出浸取过程中的化学反应方程式:____________________________ 。
(2)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则操作①的名称为____________ (填“蒸发”或“过滤”)。
(3)利用金属活动性的不同,可以采取不同的冶炼方法,其中上述过程中的②属于______ (填“热还原法”或“电解法”)。
(4)氨水由氨气溶于水制备,工业合成氨气反应方程式为:N2+3H2 2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3,用NH3表示该反应的速率v(NH3)=
2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3,用NH3表示该反应的速率v(NH3)=_____________ mol•L-1•min-1。

(1)“浸取”时通常将菱铁矿石进行粉碎,其目的是
(2)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则操作①的名称为
(3)利用金属活动性的不同,可以采取不同的冶炼方法,其中上述过程中的②属于
(4)氨水由氨气溶于水制备,工业合成氨气反应方程式为:N2+3H2
 2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3,用NH3表示该反应的速率v(NH3)=
2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3,用NH3表示该反应的速率v(NH3)=
您最近一年使用:0次
名校
解题方法
9 . 亚硝酰氯( ,熔点:
,熔点: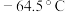 ,沸点:
,沸点: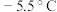 )是一种黄色气体,遇水易水解生成
)是一种黄色气体,遇水易水解生成 和
和 。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气 和
和 ,制备装置如图所示:
,制备装置如图所示:
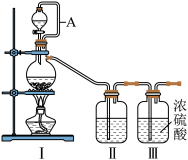
为制备纯净干燥的气体,补充表中缺少的药品
(2)乙组同学利用甲组制得的 和
和 制备
制备 ,装置如图所示:
,装置如图所示:
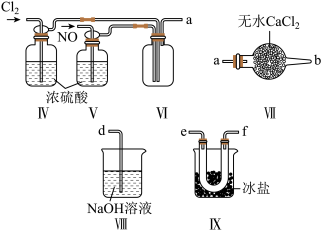
① 分子中各原子均满足8电子稳定结构,则
分子中各原子均满足8电子稳定结构,则 的电子式为
的电子式为_______ ;
②装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示);
③装置Ⅳ、Ⅴ除了可进一步干燥 、
、 外,另一作用是
外,另一作用是_______ ;
④装置Ⅷ中吸收尾气时, 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
 ,熔点:
,熔点: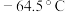 ,沸点:
,沸点: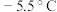 )是一种黄色气体,遇水易水解生成
)是一种黄色气体,遇水易水解生成 和
和 。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。(1)甲组的同学拟制备原料气
 和
和 ,制备装置如图所示:
,制备装置如图所示:
为制备纯净干燥的气体,补充表中缺少的药品
| 装置I | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
制备纯净的 |  | ①浓盐酸 | ② |
制备纯净的 |  | ③ | ④水 |
 和
和 制备
制备 ,装置如图所示:
,装置如图所示:
①
 分子中各原子均满足8电子稳定结构,则
分子中各原子均满足8电子稳定结构,则 的电子式为
的电子式为②装置连接顺序为a→
③装置Ⅳ、Ⅴ除了可进一步干燥
 、
、 外,另一作用是
外,另一作用是④装置Ⅷ中吸收尾气时,
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
10 . 工业上乙醚可用于制造无烟火药。无水乙醚微溶于水,熔点-116.3 ℃,沸点34.6 ℃,在空气中遇热易爆炸。实验室合成乙醚的原理如下:
主反应:2CH3CH2OH CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应:CH3CH2OH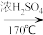 H2C=CH2↑+H2O
H2C=CH2↑+H2O
【乙醚制备】装置设计如图所示(部分装置略):

(1)仪器b应更换为下列中的________ (填字母代号)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为________ (填字母代号),取出乙醚立即密闭保存。
a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物
c.检查装置气密性 d.熄灭酒精灯
e.通冷却水并加热烧瓶 f.拆除装置
g.控制滴加乙醇速率与馏出液速率相等
(3)反应温度不超过145 ℃,其目的是____________________ 。
【乙醚提纯】

(4)操作a的名称是__________ ;进行该操作时,必须用水浴加热代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为______________________ 。
主反应:2CH3CH2OH
 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O副反应:CH3CH2OH
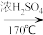 H2C=CH2↑+H2O
H2C=CH2↑+H2O【乙醚制备】装置设计如图所示(部分装置略):

(1)仪器b应更换为下列中的
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为
a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物
c.检查装置气密性 d.熄灭酒精灯
e.通冷却水并加热烧瓶 f.拆除装置
g.控制滴加乙醇速率与馏出液速率相等
(3)反应温度不超过145 ℃,其目的是
【乙醚提纯】

(4)操作a的名称是
您最近一年使用:0次






