名校
解题方法
1 . 铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠 是水处理过程中的一种新型净水剂,工业上利用
是水处理过程中的一种新型净水剂,工业上利用 和
和 的混合溶液将
的混合溶液将 氧化性制备高铁酸钠,反应的化学方程式为
氧化性制备高铁酸钠,反应的化学方程式为______ ;高铁酸钠能用作新型净水剂的原理是______ 。
(2)某实验小组模拟工业制法,以含铁污泥(主要成分为 、
、 、
、 及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
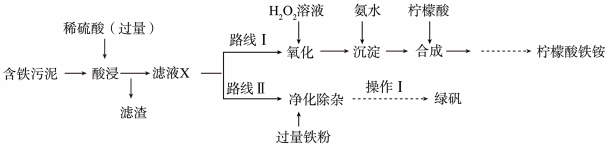
根据所学知识,回答下列问题:
①“滤液X”中一定含有的阳离子为______ 。
②路线I中,加入 溶液的离子方程式
溶液的离子方程式______ 。
③“操作I”为过滤、______ 、______ 、过滤、洗涤、低温烘干。
④实验室用绿矾配置硫酸亚铁溶液时,往往会加入适量的稀硫酸,请你解释其中原因______ (结合必要的方程式)。
(1)高铁酸钠
 是水处理过程中的一种新型净水剂,工业上利用
是水处理过程中的一种新型净水剂,工业上利用 和
和 的混合溶液将
的混合溶液将 氧化性制备高铁酸钠,反应的化学方程式为
氧化性制备高铁酸钠,反应的化学方程式为(2)某实验小组模拟工业制法,以含铁污泥(主要成分为
 、
、 、
、 及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
根据所学知识,回答下列问题:
①“滤液X”中一定含有的阳离子为
②路线I中,加入
 溶液的离子方程式
溶液的离子方程式③“操作I”为过滤、
④实验室用绿矾配置硫酸亚铁溶液时,往往会加入适量的稀硫酸,请你解释其中原因
您最近半年使用:0次
名校
2 . 某研究性学习小组为合成 查阅资料得知一条合成路线:
查阅资料得知一条合成路线:
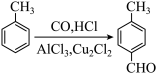
原料气CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
(提示:甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解)
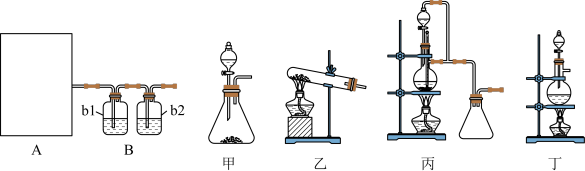
请完成下列问题:
(1)图A是利用甲酸制取CO的发生装置.根据实验原理,应选择图_____ (填“甲”、“乙”、“丙”或“丁”);选择的理由是______________________ 。
(2)若用以上装置制备干燥纯净的CO,b1和b2中盛装的试剂分别是____________ ,_____ 。
(3)CO还可以和丙烯和氢气制取正丁醇,方程式如下:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO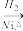 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;
在制取原料丙烯时,会产生少量SO2、CO2及水蒸气,某小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是_______ (填序号)。
①2%品红溶液 ②溴水 ③石灰水 ④无水CuSO4 ⑤饱和Na2SO3溶液
(4)产物 中往往会混有少量甲苯,为了制取较纯净的产物,该小组对这两种有机物的物理性质进行了查阅,资料如下:
中往往会混有少量甲苯,为了制取较纯净的产物,该小组对这两种有机物的物理性质进行了查阅,资料如下:
甲苯是无色透明液体,密度0.87,沸点:110.6℃,不溶于水,可混溶于苯等多数有机溶剂。无色或淡黄色透明液体,密度1.015,沸点204-205℃,微溶于水,易溶于醇、醚。通过这些资料,该小组设计了某些方法来进行产物的提纯,合理的是_________ 。
A 分液 B过滤 C蒸馏 D将甲苯氧化成苯甲酸再进行分液
(5)得到较纯净的产物之后,某位同学为了研究产物的化学性质,将产物和甲苯分别取样,并分别滴加溴水,发现溴水最终都褪色了,于是得出结论:产物和甲苯的化学性质相似。这位同学的结论是否正确?若不正确,请说明理由。_____ 。
 查阅资料得知一条合成路线:
查阅资料得知一条合成路线:
原料气CO的制备原理:HCOOH
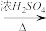 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。(提示:甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解)

请完成下列问题:
(1)图A是利用甲酸制取CO的发生装置.根据实验原理,应选择图
(2)若用以上装置制备干燥纯净的CO,b1和b2中盛装的试剂分别是
(3)CO还可以和丙烯和氢气制取正丁醇,方程式如下:
CH3CH=CH2+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO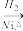 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;在制取原料丙烯时,会产生少量SO2、CO2及水蒸气,某小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①2%品红溶液 ②溴水 ③石灰水 ④无水CuSO4 ⑤饱和Na2SO3溶液
(4)产物
 中往往会混有少量甲苯,为了制取较纯净的产物,该小组对这两种有机物的物理性质进行了查阅,资料如下:
中往往会混有少量甲苯,为了制取较纯净的产物,该小组对这两种有机物的物理性质进行了查阅,资料如下: 甲苯是无色透明液体,密度0.87,沸点:110.6℃,不溶于水,可混溶于苯等多数有机溶剂。无色或淡黄色透明液体,密度1.015,沸点204-205℃,微溶于水,易溶于醇、醚。通过这些资料,该小组设计了某些方法来进行产物的提纯,合理的是
A 分液 B过滤 C蒸馏 D将甲苯氧化成苯甲酸再进行分液
(5)得到较纯净的产物之后,某位同学为了研究产物的化学性质,将产物和甲苯分别取样,并分别滴加溴水,发现溴水最终都褪色了,于是得出结论:产物和甲苯的化学性质相似。这位同学的结论是否正确?若不正确,请说明理由。
您最近半年使用:0次
2020-03-22更新
|
88次组卷
|
2卷引用:广西南宁市第二中学2022-2023学年高二上学期期中考试化学试卷
名校
解题方法
3 . 某课题组从植物香料中分离出一种罕见的醇(醇A),其结构简式如下:
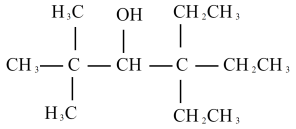
(1)用系统命名法给该醇的命名:___________ ;
(2)该醇可发生的反应:___________ (填字母序号)
A.与金属Na反应 B.与CuO反应 C.与NaOH溶液反应 D.消去反应
I.该课题组设计了以醇A为原料制备某物质的合成路线。合成反应的第一步。拟使醇A与浓氢溴酸(质量分数47. 6%)在90℃下充分反应,制备中间产物B.实验装置如图所示(夹持及加热仪器略去)。

已知:①HBr溶液受热时,HBr能否蒸发受到体系总含水量的影响。具体情况如下表。
②醇A、中间产物B的沸点均超过200℃。
(3)温度计1拟用于监控反应温度,温度计2拟用于监控实验中离开烧瓶的物质的沸点。两个温度计中,水银球位置错误的是___________ (填 “温度计1”或“温度计2”),其水银球应___________ 。
II.将温度计位置调节好后,课题组成员依次进行如下操作:
①检验气密性,装入沸石;
②加入18.6 g醇A (0.1 mol)、17.0 g 47. 6% 氢溴酸(含8.1 g HBr、0.1 mol);
③开始加热,逐渐升温至反应温度。
(4)反应开始后,当温度计2的示数上升至39°C时,冷凝管末端持续有液体流出。反应结束时,共收集到无色液体7.0 g。经检测,该液体为纯净物,标记为产物C。取0.7 g C在氧气中充分燃烧,共收集到2.2 g CO、0.9 g H2O。另取少量C进行质谱试验,结果如图所示。
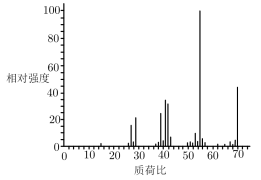
根据上述实验结果,C的分子式为___________ 。
(5)取少量产物C进行核磁共振氢谱试验,共有三个信号峰。三个信号峰的面积之比为3:6:1,综合上述实验结果,C的结构简式为___________ 。
(6)反应结束后,圆底烧瓶内液体分为两层。可用___________ 方法(填实验操作名称)将两液体分离。
(7)后续检验证实,两液体均较纯净,其中所含杂质均可忽略。上层液体质量为 10.7 g.取下层液体进行核磁共振氢谱实验,共有两个信号峰。峰的面积之比为3:2,综合以上信息,本实验的实际总反应方程式为___________ 。

(1)用系统命名法给该醇的命名:
(2)该醇可发生的反应:
A.与金属Na反应 B.与CuO反应 C.与NaOH溶液反应 D.消去反应
I.该课题组设计了以醇A为原料制备某物质的合成路线。合成反应的第一步。拟使醇A与浓氢溴酸(质量分数47. 6%)在90℃下充分反应,制备中间产物B.实验装置如图所示(夹持及加热仪器略去)。

已知:①HBr溶液受热时,HBr能否蒸发受到体系总含水量的影响。具体情况如下表。
 | <47. 6% | 47.6% | >47.6% |
| 先蒸发的物质 | 水先蒸发,直至比值升至47.6% | HBr与水一起蒸发、液化沸点124.3℃ | HBr先蒸发,直至比值降至47. 6% |
(3)温度计1拟用于监控反应温度,温度计2拟用于监控实验中离开烧瓶的物质的沸点。两个温度计中,水银球位置错误的是
II.将温度计位置调节好后,课题组成员依次进行如下操作:
①检验气密性,装入沸石;
②加入18.6 g醇A (0.1 mol)、17.0 g 47. 6% 氢溴酸(含8.1 g HBr、0.1 mol);
③开始加热,逐渐升温至反应温度。
(4)反应开始后,当温度计2的示数上升至39°C时,冷凝管末端持续有液体流出。反应结束时,共收集到无色液体7.0 g。经检测,该液体为纯净物,标记为产物C。取0.7 g C在氧气中充分燃烧,共收集到2.2 g CO、0.9 g H2O。另取少量C进行质谱试验,结果如图所示。

根据上述实验结果,C的分子式为
(5)取少量产物C进行核磁共振氢谱试验,共有三个信号峰。三个信号峰的面积之比为3:6:1,综合上述实验结果,C的结构简式为
(6)反应结束后,圆底烧瓶内液体分为两层。可用
(7)后续检验证实,两液体均较纯净,其中所含杂质均可忽略。上层液体质量为 10.7 g.取下层液体进行核磁共振氢谱实验,共有两个信号峰。峰的面积之比为3:2,综合以上信息,本实验的实际总反应方程式为
您最近半年使用:0次
解题方法
4 . 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO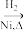 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH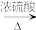 CO↑ + H2O,并设计出原料气的制备装置(如下图所示):
CO↑ + H2O,并设计出原料气的制备装置(如下图所示):

(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:_____________ ,____________ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是____________ ,_____________ 。
(3) 若用以上装置制备干燥纯净的H2,c和d中盛装的试剂分别是____________ ,_____________ 。
(4)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,(已知:①丙烯被高锰酸钾氧化有CO2生成②试剂可以重复使用)混合气体通过试剂的顺序是____________ (填序号)。
①饱和Na2SO3溶液 ②品红溶液 ③澄清石灰水 ④无水CuSO4 ⑤KMnO4酸性溶液
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO + NaHSO3(饱和) RCH(OH)SO3Na↓;
RCH(OH)SO3Na↓;
②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:

试剂1为________ ,操作1为________ ,操作2为________ ,操作3为_______ 。
CH3CH=CH2+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO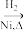 CH3CH2CH2CH2OH
CH3CH2CH2CH2OHCO的制备原理:HCOOH
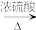 CO↑ + H2O,并设计出原料气的制备装置(如下图所示):
CO↑ + H2O,并设计出原料气的制备装置(如下图所示):
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3) 若用以上装置制备干燥纯净的H2,c和d中盛装的试剂分别是
(4)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,(已知:①丙烯被高锰酸钾氧化有CO2生成②试剂可以重复使用)混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②品红溶液 ③澄清石灰水 ④无水CuSO4 ⑤KMnO4酸性溶液
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO + NaHSO3(饱和)
 RCH(OH)SO3Na↓;
RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:

试剂1为
您最近半年使用:0次
名校
5 . 有机合成是有机化学的重要组成部分,如图是关于气体A制备和性质的合成路线图。已知C是一种塑料,D是一种植物生长调节剂,可以催熟果实。
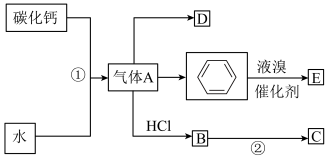
(1)①的化学方程式为______ 。
(2)②的化学方程式为______ ,该反应属于______ 反应(填反应类型)。
(3)D中的官能团为______ (填名称),写出实验室制D的化学方程式为______ ,该反应属于______ 反应(填反应类型)。
(4)与链烃相比,苯的化学性质的主要特征是 (单选)。
(5)证明苯制备E为取代反应的实验方案是______ 。已知硝基为间位定位基团,溴原子为邻、对位定位基团,写出以苯原料,制各间溴硝基苯的合成路线_____ 。
(合成路线的表示方式为:甲 乙
乙 目标产物)
目标产物)
(6)与上述物质有关的化学实验的说法中,正确的是 (单选)。

(1)①的化学方程式为
(2)②的化学方程式为
(3)D中的官能团为
(4)与链烃相比,苯的化学性质的主要特征是 (单选)。
| A.难氧化、难取代、难加成 | B.易氧化、易取代、易加成 |
| C.难氧化、能加成、易取代 | D.易氧化、易加成、难取代 |
(合成路线的表示方式为:甲
 乙
乙 目标产物)
目标产物)(6)与上述物质有关的化学实验的说法中,正确的是 (单选)。
| A.实验室制备乙烯时,产生的气体使溴水褪色,能证明有乙烯生成 |
| B.除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 |
| C.实验室制乙炔,反应物为固体和液体,且常温条件下反应,可以用启普发生器 |
| D.制取硝基苯时,试管中先加入浓H2SO4,再逐滴滴入浓HNO3和苯 |
您最近半年使用:0次
名校
6 . 某化学兴趣小组查阅文献资料了解到湿法合成高铁酸钾(K2FeO4)是目前人工成本最低、产品纯度最高的合成方法,其合成路线如图:
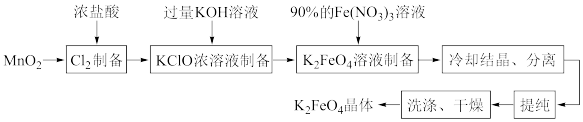
该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取K2FeO4。
已知:K2FeO4为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。
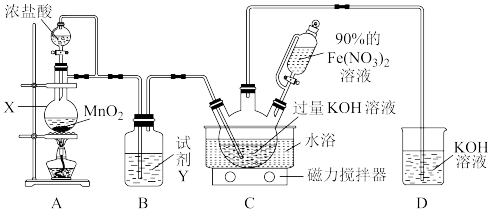
(1)仪器X的名称是_______ 。试剂Y的作用为_______ 。
(2)水浴方式是_______ (填“冷水浴”或“热水浴”)。
(3)装置C中KOH过量的原因是_______ 。
(4)上述流程中,“提纯”所用的方法是_______ 。
(5)称取1.98 g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{K[Cr(OH)4]}反应后配成100.00 mL溶液;取上述溶液20.00 mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1 mL苯二胺磺酸钠作指示剂,用1.00 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,消耗(NH4)2Fe(SO4)2溶液5.76 mL。测定过程中发生反应:
a. Cr(OH) +FeO
+FeO =Fe(OH)3+CrO
=Fe(OH)3+CrO +OH-
+OH-
b. 2CrO +2H+=Cr2O
+2H+=Cr2O +H2O
+H2O
c. Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
则K2FeO4样品的纯度是_______ 。
(6)K2FeO4是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释K2FeO4作为多功能水处理剂的原理:_______ 。
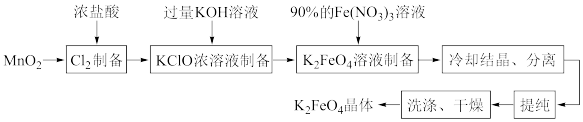
该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取K2FeO4。
已知:K2FeO4为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。

(1)仪器X的名称是
(2)水浴方式是
(3)装置C中KOH过量的原因是
(4)上述流程中,“提纯”所用的方法是
(5)称取1.98 g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{K[Cr(OH)4]}反应后配成100.00 mL溶液;取上述溶液20.00 mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1 mL苯二胺磺酸钠作指示剂,用1.00 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,消耗(NH4)2Fe(SO4)2溶液5.76 mL。测定过程中发生反应:
a. Cr(OH)
 +FeO
+FeO =Fe(OH)3+CrO
=Fe(OH)3+CrO +OH-
+OH-b. 2CrO
 +2H+=Cr2O
+2H+=Cr2O +H2O
+H2Oc. Cr2O
 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O则K2FeO4样品的纯度是
(6)K2FeO4是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释K2FeO4作为多功能水处理剂的原理:
您最近半年使用:0次
2022-01-12更新
|
152次组卷
|
4卷引用:福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题
福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题吉林省长春吉大附中实验学校2021-2022学年高三上学期第三次摸底考试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(工业流程题)(已下线)工业流程题
名校
解题方法
7 . 某硫酸厂以含有SO2的尾气、氨气等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
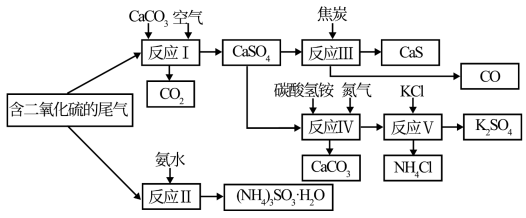
(1)写出反应Ⅲ的化学方程式:___________________________________________ 。
(2)下列有关说法正确的是_________ (填字母)
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:___________ 。
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为_______ 。
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4溶液中c(KMnO4) =_________________ 。
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。
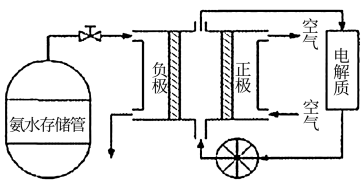
氨气燃料电池的电解质溶液最好选择________ (填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是___________ ,负极的电极反应式是_________________________ 。

(1)写出反应Ⅲ的化学方程式:
(2)下列有关说法正确的是
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4溶液中c(KMnO4) =
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。

氨气燃料电池的电解质溶液最好选择
您最近半年使用:0次
名校
解题方法
8 . 乙酸苯甲酯是一种难溶于水,密度大于水的无色油状液体,具有茉莉花气味,可用做调香剂。
(一)以乙烯,甲苯为原料,合成乙苯甲酯的路线如图所示。
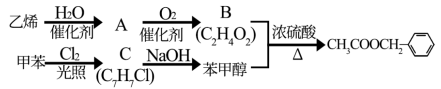
(1)写出由乙烯制备A的化学方程式_______________________________________________________ 。
(二)制备乙酸苯甲酯的流程如图:
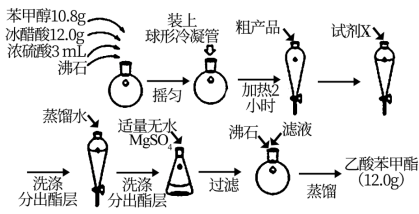
(2)球形冷凝管的作用为_______________________ .
(3)试剂X可为_______
A.氢氧化钠溶液 B.碳酸钠溶液 C.乙醇 D.氯化钠溶液
(4)分出酯层时应收集______ 层液体(填“上”或“下”)
(5)无水MgSO4的作用为__________________________ 。
(6)本实验所得乙酸苯甲酯的产率为__________ 。(已知:相对分子量:苯甲醇-108; 乙酸-60; 乙酸苯甲酯-150)
(一)以乙烯,甲苯为原料,合成乙苯甲酯的路线如图所示。

(1)写出由乙烯制备A的化学方程式
(二)制备乙酸苯甲酯的流程如图:

(2)球形冷凝管的作用为
(3)试剂X可为
A.氢氧化钠溶液 B.碳酸钠溶液 C.乙醇 D.氯化钠溶液
(4)分出酯层时应收集
(5)无水MgSO4的作用为
(6)本实验所得乙酸苯甲酯的产率为
您最近半年使用:0次
解题方法
9 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线:
 +2H2O+H2SO4
+2H2O+H2SO4
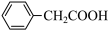 +NH4HSO4
+NH4HSO4
2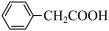 +Cu(OH)2→(
+Cu(OH)2→(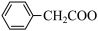 )2Cu+2H2O
)2Cu+2H2O
如图为制备苯乙酸的装置示意图(加热和夹持装置等略):已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
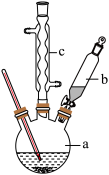
回答下列问题:
(1)在 三口瓶a中加入
三口瓶a中加入 硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是___________ 。
(2)将a中的溶液加热至 ,缓缓滴加
,缓缓滴加 苯乙腈到硫酸溶液中然后升温至
苯乙腈到硫酸溶液中然后升温至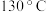 充分反应。在装置中,仪器b的作用是
充分反应。在装置中,仪器b的作用是___________ ;仪器c的名称是___________ ,其作用是___________ 。
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。下列仪器中可用于分离苯乙酸粗品的是___________ (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)提纯粗苯乙酸的具体操作步骤是___________ 、冷却结晶、过滤、洗涤、干燥。最终得到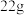 纯品,则苯乙酸的产率是
纯品,则苯乙酸的产率是___________ (保留三位有效数字)
(5)用 和
和 溶液制备适量
溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________ 。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 搅拌
搅拌 ,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________ 。
 +2H2O+H2SO4
+2H2O+H2SO4
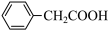 +NH4HSO4
+NH4HSO42
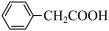 +Cu(OH)2→(
+Cu(OH)2→(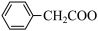 )2Cu+2H2O
)2Cu+2H2O如图为制备苯乙酸的装置示意图(加热和夹持装置等略):已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。

回答下列问题:
(1)在
 三口瓶a中加入
三口瓶a中加入 硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是(2)将a中的溶液加热至
 ,缓缓滴加
,缓缓滴加 苯乙腈到硫酸溶液中然后升温至
苯乙腈到硫酸溶液中然后升温至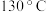 充分反应。在装置中,仪器b的作用是
充分反应。在装置中,仪器b的作用是(3)反应结束后加适量冷水,再分离出苯乙酸粗品。下列仪器中可用于分离苯乙酸粗品的是
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)提纯粗苯乙酸的具体操作步骤是
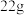 纯品,则苯乙酸的产率是
纯品,则苯乙酸的产率是(5)用
 和
和 溶液制备适量
溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌
搅拌 ,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近半年使用:0次
名校
解题方法
10 . 己二酸主要用于生产尼龙66盐、合成树脂及增塑剂等,己二酸的合成路线如下:
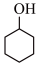
 NaOOC(CH2)4COONa
NaOOC(CH2)4COONa HOOC(CH2)4COOH
HOOC(CH2)4COOH
制备己二酸的装置示意图如图所示 加热和夹持装置等略
加热和夹持装置等略 。
。
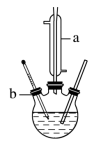
实验步骤:
Ⅰ.己二酸的制备
连接好装置后,通过瓶口b慢慢滴加1.5g环己醇至适量KMnO4和NaOH的混合溶液中,然后塞上带有温度计的胶塞,再用沸水浴加热数分钟。
Ⅱ.分离提纯
趁热过滤,收集滤液,用少量热水洗涤滤渣2次,合并滤液和洗涤液,边搅拌边滴加浓盐酸至溶液呈强酸性,小心加热蒸发浓缩至10mL左右,在冷水浴中冷却,析出己二酸粗品。
回答下列问题:
(1)仪器a的名称为:___________ ,其作用是___________ 。
(2)步骤Ⅱ中过滤时需要用到的玻璃仪器有烧杯、___________ 、___________ 。步骤Ⅱ中洗涤滤渣的目的是___________ 。
(3)分离提纯过程中滴加的浓盐酸的作用是___________ 。
(4)将己二酸粗品提纯的方法是___________  填字母
填字母 。
。
A.过滤 B.萃取 C.重结晶 D.蒸馏
(5)若制得纯己二酸的质量为1.5g,则己二酸的产率为___________ 。(结果保留至小数点后1位)(已知环己醇的摩尔质量为100g/mol,己二酸的摩尔质量为146g/mol)

 NaOOC(CH2)4COONa
NaOOC(CH2)4COONa HOOC(CH2)4COOH
HOOC(CH2)4COOH制备己二酸的装置示意图如图所示
 加热和夹持装置等略
加热和夹持装置等略 。
。
实验步骤:
Ⅰ.己二酸的制备
连接好装置后,通过瓶口b慢慢滴加1.5g环己醇至适量KMnO4和NaOH的混合溶液中,然后塞上带有温度计的胶塞,再用沸水浴加热数分钟。
Ⅱ.分离提纯
趁热过滤,收集滤液,用少量热水洗涤滤渣2次,合并滤液和洗涤液,边搅拌边滴加浓盐酸至溶液呈强酸性,小心加热蒸发浓缩至10mL左右,在冷水浴中冷却,析出己二酸粗品。
回答下列问题:
(1)仪器a的名称为:
(2)步骤Ⅱ中过滤时需要用到的玻璃仪器有烧杯、
(3)分离提纯过程中滴加的浓盐酸的作用是
(4)将己二酸粗品提纯的方法是
 填字母
填字母 。
。A.过滤 B.萃取 C.重结晶 D.蒸馏
(5)若制得纯己二酸的质量为1.5g,则己二酸的产率为
您最近半年使用:0次



