名校
解题方法
1 . 铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠 是水处理过程中的一种新型净水剂,工业上利用
是水处理过程中的一种新型净水剂,工业上利用 和
和 的混合溶液将
的混合溶液将 氧化性制备高铁酸钠,反应的化学方程式为
氧化性制备高铁酸钠,反应的化学方程式为______ ;高铁酸钠能用作新型净水剂的原理是______ 。
(2)某实验小组模拟工业制法,以含铁污泥(主要成分为 、
、 、
、 及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
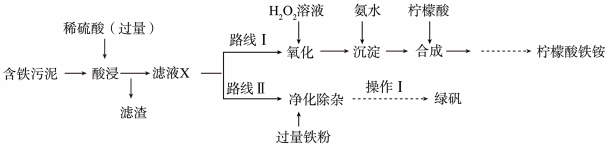
根据所学知识,回答下列问题:
①“滤液X”中一定含有的阳离子为______ 。
②路线I中,加入 溶液的离子方程式
溶液的离子方程式______ 。
③“操作I”为过滤、______ 、______ 、过滤、洗涤、低温烘干。
④实验室用绿矾配置硫酸亚铁溶液时,往往会加入适量的稀硫酸,请你解释其中原因______ (结合必要的方程式)。
(1)高铁酸钠
 是水处理过程中的一种新型净水剂,工业上利用
是水处理过程中的一种新型净水剂,工业上利用 和
和 的混合溶液将
的混合溶液将 氧化性制备高铁酸钠,反应的化学方程式为
氧化性制备高铁酸钠,反应的化学方程式为(2)某实验小组模拟工业制法,以含铁污泥(主要成分为
 、
、 、
、 及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
根据所学知识,回答下列问题:
①“滤液X”中一定含有的阳离子为
②路线I中,加入
 溶液的离子方程式
溶液的离子方程式③“操作I”为过滤、
④实验室用绿矾配置硫酸亚铁溶液时,往往会加入适量的稀硫酸,请你解释其中原因
您最近半年使用:0次
名校
解题方法
2 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。

根据所学知识,回答下列问题:
(1)“滤液X”中一定含有的阳离子为___________ 。
(2)路线Ⅰ中,加入H2O2溶液的目的是___________ (用离子方程式表示)。
(3)加入过量试剂a时发生反应的离子方程式___________ 。
(4)“操作②”为过滤、___________ 、___________ 过滤、洗涤、干燥。
(5)“酸浸”时加入400mL 1.5mol/L 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得绿矾得质量为___________ g。

根据所学知识,回答下列问题:
(1)“滤液X”中一定含有的阳离子为
(2)路线Ⅰ中,加入H2O2溶液的目的是
(3)加入过量试剂a时发生反应的离子方程式
(4)“操作②”为过滤、
(5)“酸浸”时加入400mL 1.5mol/L 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得绿矾得质量为
您最近半年使用:0次
名校
解题方法
3 . 连二亚硫酸钠(Na2S2O4)广泛应用于造纸等行业。该物质易氧化,受热易分解,在碱性条件下较稳定,易溶于水,不溶于乙醇。
(1)实验室利用下图装置和试剂制取Na2S2O4。
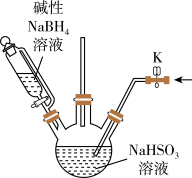
① 实验前需打开K通入一段时间氮气,其目的是_______ 。
② 原料NaBH4制备路线如下:
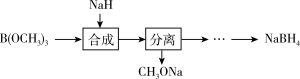
“合成”步骤中,先将NaH分散到矿物油,再与B(OCH3)3反应,其目的是_______ 。
③ 在30~ 40 ℃条件下,向三颈瓶中滴加碱性NaBH4溶液充分反应制取Na2S2O4,产物中还生成NaBO2,写出制取Na2S2O4的化学反应方程式:_______ 。
④ 反应结束后,向溶液中加入乙醇,充分结晶后过滤可得Na2S2O4·2H2O晶体。加入乙醇的作用是_______ 。
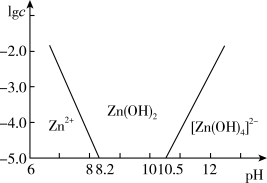
(2)请根据下列信息,利用所给试剂设计制备Na2S2O4·2H2O的实验方案:_______ 。
用乙醇洗涤,得Na2S2O4·2H2O。(实验中须使用的试剂: Zn粉,NaCl固体,蒸馏水,SO2, 1 mol·L-1 NaOH溶液)
已知:① 制备原理之一: Zn+2H2SO3 ZnS2O4+2H2O。
ZnS2O4+2H2O。
② 二价锌在水溶液中的存在形式与pH的关系如图。
(1)实验室利用下图装置和试剂制取Na2S2O4。

① 实验前需打开K通入一段时间氮气,其目的是
② 原料NaBH4制备路线如下:

“合成”步骤中,先将NaH分散到矿物油,再与B(OCH3)3反应,其目的是
③ 在30~ 40 ℃条件下,向三颈瓶中滴加碱性NaBH4溶液充分反应制取Na2S2O4,产物中还生成NaBO2,写出制取Na2S2O4的化学反应方程式:
④ 反应结束后,向溶液中加入乙醇,充分结晶后过滤可得Na2S2O4·2H2O晶体。加入乙醇的作用是
(2)请根据下列信息,利用所给试剂设计制备Na2S2O4·2H2O的实验方案:
用乙醇洗涤,得Na2S2O4·2H2O。(实验中须使用的试剂: Zn粉,NaCl固体,蒸馏水,SO2, 1 mol·L-1 NaOH溶液)
已知:① 制备原理之一: Zn+2H2SO3
 ZnS2O4+2H2O。
ZnS2O4+2H2O。② 二价锌在水溶液中的存在形式与pH的关系如图。

您最近半年使用:0次
2022-11-17更新
|
217次组卷
|
2卷引用:江苏省南通市通州区2022-2023学年高三上学期期中质量监测化学试题
名校
4 . 某研究性学习小组为合成 查阅资料得知一条合成路线:
查阅资料得知一条合成路线:
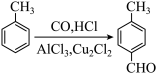
原料气CO的制备原理:HCOOH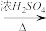 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
(提示:甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解)
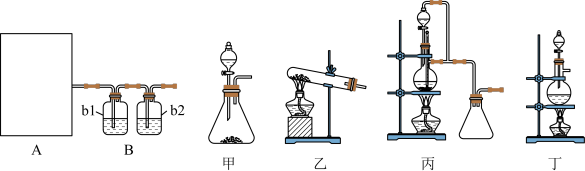
请完成下列问题:
(1)图A是利用甲酸制取CO的发生装置.根据实验原理,应选择图_____ (填“甲”、“乙”、“丙”或“丁”);选择的理由是______________________ 。
(2)若用以上装置制备干燥纯净的CO,b1和b2中盛装的试剂分别是____________ ,_____ 。
(3)CO还可以和丙烯和氢气制取正丁醇,方程式如下:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO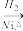 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;
在制取原料丙烯时,会产生少量SO2、CO2及水蒸气,某小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是_______ (填序号)。
①2%品红溶液 ②溴水 ③石灰水 ④无水CuSO4 ⑤饱和Na2SO3溶液
(4)产物 中往往会混有少量甲苯,为了制取较纯净的产物,该小组对这两种有机物的物理性质进行了查阅,资料如下:
中往往会混有少量甲苯,为了制取较纯净的产物,该小组对这两种有机物的物理性质进行了查阅,资料如下:
甲苯是无色透明液体,密度0.87,沸点:110.6℃,不溶于水,可混溶于苯等多数有机溶剂。无色或淡黄色透明液体,密度1.015,沸点204-205℃,微溶于水,易溶于醇、醚。通过这些资料,该小组设计了某些方法来进行产物的提纯,合理的是_________ 。
A 分液 B过滤 C蒸馏 D将甲苯氧化成苯甲酸再进行分液
(5)得到较纯净的产物之后,某位同学为了研究产物的化学性质,将产物和甲苯分别取样,并分别滴加溴水,发现溴水最终都褪色了,于是得出结论:产物和甲苯的化学性质相似。这位同学的结论是否正确?若不正确,请说明理由。_____ 。
 查阅资料得知一条合成路线:
查阅资料得知一条合成路线:
原料气CO的制备原理:HCOOH
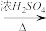 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。(提示:甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解)

请完成下列问题:
(1)图A是利用甲酸制取CO的发生装置.根据实验原理,应选择图
(2)若用以上装置制备干燥纯净的CO,b1和b2中盛装的试剂分别是
(3)CO还可以和丙烯和氢气制取正丁醇,方程式如下:
CH3CH=CH2+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO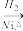 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;在制取原料丙烯时,会产生少量SO2、CO2及水蒸气,某小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①2%品红溶液 ②溴水 ③石灰水 ④无水CuSO4 ⑤饱和Na2SO3溶液
(4)产物
 中往往会混有少量甲苯,为了制取较纯净的产物,该小组对这两种有机物的物理性质进行了查阅,资料如下:
中往往会混有少量甲苯,为了制取较纯净的产物,该小组对这两种有机物的物理性质进行了查阅,资料如下: 甲苯是无色透明液体,密度0.87,沸点:110.6℃,不溶于水,可混溶于苯等多数有机溶剂。无色或淡黄色透明液体,密度1.015,沸点204-205℃,微溶于水,易溶于醇、醚。通过这些资料,该小组设计了某些方法来进行产物的提纯,合理的是
A 分液 B过滤 C蒸馏 D将甲苯氧化成苯甲酸再进行分液
(5)得到较纯净的产物之后,某位同学为了研究产物的化学性质,将产物和甲苯分别取样,并分别滴加溴水,发现溴水最终都褪色了,于是得出结论:产物和甲苯的化学性质相似。这位同学的结论是否正确?若不正确,请说明理由。
您最近半年使用:0次
2020-03-22更新
|
88次组卷
|
2卷引用:上海市奉贤区2015届高三上学期期中调研测试化学试题
名校
解题方法
5 . 某研究性学习小组为合成1-丁醇,查阅资料得知下列合成路线:CH3CH=CH2+CO+H2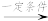 CH3CH2CH2CHO
CH3CH2CH2CHO 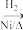 CH3CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2OH;CO的制备原理:HCOOH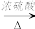 CO↑+H2O,并设计出原料气的制备装置如图所示。
CO↑+H2O,并设计出原料气的制备装置如图所示。
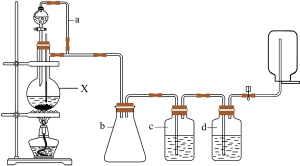
请填写下列空白:
(1)若用以上装置制备干燥纯净的CO,仪器X的名称是________ ;装置中b的作用是________ ;c和d中盛装的试剂分别是________ ,________ 。
(2)实验室现有浓硫酸、2-丙醇,请写出制备丙烯的化学方程式:________________________ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________ (填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为________ ,操作2为________ ,操作3为________ 。
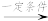 CH3CH2CH2CHO
CH3CH2CH2CHO 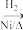 CH3CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2OH;CO的制备原理:HCOOH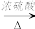 CO↑+H2O,并设计出原料气的制备装置如图所示。
CO↑+H2O,并设计出原料气的制备装置如图所示。 
请填写下列空白:
(1)若用以上装置制备干燥纯净的CO,仪器X的名称是
(2)实验室现有浓硫酸、2-丙醇,请写出制备丙烯的化学方程式:
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为
您最近半年使用:0次
2020-01-26更新
|
145次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——有机物制备实验综合题
名校
解题方法
6 . 某课题组从植物香料中分离出一种罕见的醇(醇A),其结构简式如下:
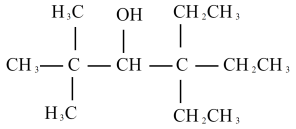
(1)用系统命名法给该醇的命名:___________ ;
(2)该醇可发生的反应:___________ (填字母序号)
A.与金属Na反应 B.与CuO反应 C.与NaOH溶液反应 D.消去反应
I.该课题组设计了以醇A为原料制备某物质的合成路线。合成反应的第一步。拟使醇A与浓氢溴酸(质量分数47. 6%)在90℃下充分反应,制备中间产物B.实验装置如图所示(夹持及加热仪器略去)。

已知:①HBr溶液受热时,HBr能否蒸发受到体系总含水量的影响。具体情况如下表。
②醇A、中间产物B的沸点均超过200℃。
(3)温度计1拟用于监控反应温度,温度计2拟用于监控实验中离开烧瓶的物质的沸点。两个温度计中,水银球位置错误的是___________ (填 “温度计1”或“温度计2”),其水银球应___________ 。
II.将温度计位置调节好后,课题组成员依次进行如下操作:
①检验气密性,装入沸石;
②加入18.6 g醇A (0.1 mol)、17.0 g 47. 6% 氢溴酸(含8.1 g HBr、0.1 mol);
③开始加热,逐渐升温至反应温度。
(4)反应开始后,当温度计2的示数上升至39°C时,冷凝管末端持续有液体流出。反应结束时,共收集到无色液体7.0 g。经检测,该液体为纯净物,标记为产物C。取0.7 g C在氧气中充分燃烧,共收集到2.2 g CO、0.9 g H2O。另取少量C进行质谱试验,结果如图所示。
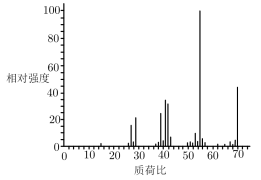
根据上述实验结果,C的分子式为___________ 。
(5)取少量产物C进行核磁共振氢谱试验,共有三个信号峰。三个信号峰的面积之比为3:6:1,综合上述实验结果,C的结构简式为___________ 。
(6)反应结束后,圆底烧瓶内液体分为两层。可用___________ 方法(填实验操作名称)将两液体分离。
(7)后续检验证实,两液体均较纯净,其中所含杂质均可忽略。上层液体质量为 10.7 g.取下层液体进行核磁共振氢谱实验,共有两个信号峰。峰的面积之比为3:2,综合以上信息,本实验的实际总反应方程式为___________ 。

(1)用系统命名法给该醇的命名:
(2)该醇可发生的反应:
A.与金属Na反应 B.与CuO反应 C.与NaOH溶液反应 D.消去反应
I.该课题组设计了以醇A为原料制备某物质的合成路线。合成反应的第一步。拟使醇A与浓氢溴酸(质量分数47. 6%)在90℃下充分反应,制备中间产物B.实验装置如图所示(夹持及加热仪器略去)。

已知:①HBr溶液受热时,HBr能否蒸发受到体系总含水量的影响。具体情况如下表。
 | <47. 6% | 47.6% | >47.6% |
| 先蒸发的物质 | 水先蒸发,直至比值升至47.6% | HBr与水一起蒸发、液化沸点124.3℃ | HBr先蒸发,直至比值降至47. 6% |
(3)温度计1拟用于监控反应温度,温度计2拟用于监控实验中离开烧瓶的物质的沸点。两个温度计中,水银球位置错误的是
II.将温度计位置调节好后,课题组成员依次进行如下操作:
①检验气密性,装入沸石;
②加入18.6 g醇A (0.1 mol)、17.0 g 47. 6% 氢溴酸(含8.1 g HBr、0.1 mol);
③开始加热,逐渐升温至反应温度。
(4)反应开始后,当温度计2的示数上升至39°C时,冷凝管末端持续有液体流出。反应结束时,共收集到无色液体7.0 g。经检测,该液体为纯净物,标记为产物C。取0.7 g C在氧气中充分燃烧,共收集到2.2 g CO、0.9 g H2O。另取少量C进行质谱试验,结果如图所示。

根据上述实验结果,C的分子式为
(5)取少量产物C进行核磁共振氢谱试验,共有三个信号峰。三个信号峰的面积之比为3:6:1,综合上述实验结果,C的结构简式为
(6)反应结束后,圆底烧瓶内液体分为两层。可用
(7)后续检验证实,两液体均较纯净,其中所含杂质均可忽略。上层液体质量为 10.7 g.取下层液体进行核磁共振氢谱实验,共有两个信号峰。峰的面积之比为3:2,综合以上信息,本实验的实际总反应方程式为
您最近半年使用:0次
解题方法
7 . 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO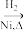 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH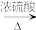 CO↑ + H2O,并设计出原料气的制备装置(如下图所示):
CO↑ + H2O,并设计出原料气的制备装置(如下图所示):

(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:_____________ ,____________ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是____________ ,_____________ 。
(3) 若用以上装置制备干燥纯净的H2,c和d中盛装的试剂分别是____________ ,_____________ 。
(4)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,(已知:①丙烯被高锰酸钾氧化有CO2生成②试剂可以重复使用)混合气体通过试剂的顺序是____________ (填序号)。
①饱和Na2SO3溶液 ②品红溶液 ③澄清石灰水 ④无水CuSO4 ⑤KMnO4酸性溶液
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO + NaHSO3(饱和) RCH(OH)SO3Na↓;
RCH(OH)SO3Na↓;
②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:

试剂1为________ ,操作1为________ ,操作2为________ ,操作3为_______ 。
CH3CH=CH2+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO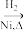 CH3CH2CH2CH2OH
CH3CH2CH2CH2OHCO的制备原理:HCOOH
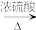 CO↑ + H2O,并设计出原料气的制备装置(如下图所示):
CO↑ + H2O,并设计出原料气的制备装置(如下图所示):
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3) 若用以上装置制备干燥纯净的H2,c和d中盛装的试剂分别是
(4)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,(已知:①丙烯被高锰酸钾氧化有CO2生成②试剂可以重复使用)混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②品红溶液 ③澄清石灰水 ④无水CuSO4 ⑤KMnO4酸性溶液
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO + NaHSO3(饱和)
 RCH(OH)SO3Na↓;
RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:

试剂1为
您最近半年使用:0次
名校
8 . 有机合成是有机化学的重要组成部分,如图是关于气体A制备和性质的合成路线图。已知C是一种塑料,D是一种植物生长调节剂,可以催熟果实。
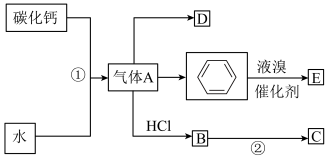
(1)①的化学方程式为______ 。
(2)②的化学方程式为______ ,该反应属于______ 反应(填反应类型)。
(3)D中的官能团为______ (填名称),写出实验室制D的化学方程式为______ ,该反应属于______ 反应(填反应类型)。
(4)与链烃相比,苯的化学性质的主要特征是 (单选)。
(5)证明苯制备E为取代反应的实验方案是______ 。已知硝基为间位定位基团,溴原子为邻、对位定位基团,写出以苯原料,制各间溴硝基苯的合成路线_____ 。
(合成路线的表示方式为:甲 乙
乙 目标产物)
目标产物)
(6)与上述物质有关的化学实验的说法中,正确的是 (单选)。

(1)①的化学方程式为
(2)②的化学方程式为
(3)D中的官能团为
(4)与链烃相比,苯的化学性质的主要特征是 (单选)。
| A.难氧化、难取代、难加成 | B.易氧化、易取代、易加成 |
| C.难氧化、能加成、易取代 | D.易氧化、易加成、难取代 |
(合成路线的表示方式为:甲
 乙
乙 目标产物)
目标产物)(6)与上述物质有关的化学实验的说法中,正确的是 (单选)。
| A.实验室制备乙烯时,产生的气体使溴水褪色,能证明有乙烯生成 |
| B.除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 |
| C.实验室制乙炔,反应物为固体和液体,且常温条件下反应,可以用启普发生器 |
| D.制取硝基苯时,试管中先加入浓H2SO4,再逐滴滴入浓HNO3和苯 |
您最近半年使用:0次
9 . 五水合硫酸铜(CuSO4·5H2O)是蓝色晶体,某学生实验小组利用铜屑制备CuSO4·5H2O,并进行了相关实验。具体合成路线如下:

回答下列问题:
(1)铜屑需经预处理除去表面油污,方法是___________ 。
(2)步骤①的实验装置如图(a)所示(夹持、加热仪器略),其中浓硝酸需要逐滴加入,其原因是___________ 。(写出一点即可)

(3)CuSO4·5H2O在受热时质量分数(w)随温度的变化情况如图(b)所示。据此分析可知,CuSO4·5H2O受热过程可能发生的化学反应是 ___________(填标号)。

(4)制备过程中若加热不当会导致晶体发白,为了得到蓝色的CuSO4·5H2O晶体,步骤③最适宜采用___________(填标号)加热。
(5)请从原子经济性和环境友好的角度,设计由铜制备CuSO4·5H2O的合成路线___________ 。

回答下列问题:
(1)铜屑需经预处理除去表面油污,方法是
(2)步骤①的实验装置如图(a)所示(夹持、加热仪器略),其中浓硝酸需要逐滴加入,其原因是

(3)CuSO4·5H2O在受热时质量分数(w)随温度的变化情况如图(b)所示。据此分析可知,CuSO4·5H2O受热过程可能发生的化学反应是 ___________(填标号)。

A.  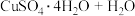 | B.  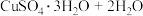 |
C.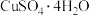  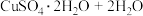 | D.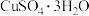   |
(4)制备过程中若加热不当会导致晶体发白,为了得到蓝色的CuSO4·5H2O晶体,步骤③最适宜采用___________(填标号)加热。
A.电热套 | B.酒精灯 | C.水浴锅 | D.煤气灯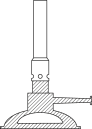 |
(5)请从原子经济性和环境友好的角度,设计由铜制备CuSO4·5H2O的合成路线
您最近半年使用:0次
10 . CuCl常用作有机合成催化剂,现有如下两种方法制备CuCl。
已知:CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解为绿色的 ,见光易分解。
,见光易分解。
方法一:利用热分解 (绿色)制备CuCl,并进行相关探究。
(绿色)制备CuCl,并进行相关探究。
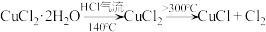

(1)将下列的实验操作按准确的先后顺序排列:a→→→e→→→_____ 。
a.检查装置的气密性后加入药品
b.点燃酒精灯加热至140℃,反应一段时间
c.调整酒精灯温度>300℃,反应一段时间
d.停止通入
e.停止通入HCl,然后通入干燥
f.在“气体入口”处通入干燥HCl
g.熄灭酒精灯
(2)关于上述实验说法正确的是___________(填字母)
方法二:以CuCl(含少量 )粗品为原料制取CuCl,设计的合成路线如下:
)粗品为原料制取CuCl,设计的合成路线如下:

查阅资料可知:
①在较高的盐酸浓度下, 能溶解于甲基异丁基甲酮;
能溶解于甲基异丁基甲酮;
②CuCl在溶液中存在: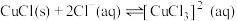 。
。
(3)下列叙述正确的是___________(填字母)。

(4)向混合液中加入去氧水的主要目的是___________ 。
(5)现称取m g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用c 溶液滴定,平均消耗V mL。
溶液滴定,平均消耗V mL。
①用移液管吸取25.00mL溶液后,将移液管垂直放入稍倾斜的锥形瓶中,___________ ,数秒后,取出移液管。
②有同学认为该实验方案明显不合理,会导致产品中CuCl的纯度严重偏高,理由是___________ 。
已知:CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解为绿色的
 ,见光易分解。
,见光易分解。方法一:利用热分解
 (绿色)制备CuCl,并进行相关探究。
(绿色)制备CuCl,并进行相关探究。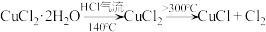

(1)将下列的实验操作按准确的先后顺序排列:a→→→e→→→
a.检查装置的气密性后加入药品
b.点燃酒精灯加热至140℃,反应一段时间
c.调整酒精灯温度>300℃,反应一段时间
d.停止通入

e.停止通入HCl,然后通入干燥

f.在“气体入口”处通入干燥HCl
g.熄灭酒精灯
(2)关于上述实验说法正确的是___________(填字母)
A.若加热时间不足或温度偏低,最终可能混有 |
| B.可通过固体颜色变化,判断反应终点 |
| C.干燥管中最好放无水硫酸铜固体 |
D.通入干燥HCl的作用是防止CuCl被氧化,可用干燥 代替 代替 |
方法二:以CuCl(含少量
 )粗品为原料制取CuCl,设计的合成路线如下:
)粗品为原料制取CuCl,设计的合成路线如下:
查阅资料可知:
①在较高的盐酸浓度下,
 能溶解于甲基异丁基甲酮;
能溶解于甲基异丁基甲酮;②CuCl在溶液中存在:
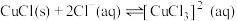 。
。(3)下列叙述正确的是___________(填字母)。

A. 原料中含有的 原料中含有的 经氧化、萃取几乎都在有机相中被除去 经氧化、萃取几乎都在有机相中被除去 |
| B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇 |
C.通入 的目的是将 的目的是将 还原直接生成CuCl沉淀 还原直接生成CuCl沉淀 |
| D.上述合成路线中,一系列操作包括:抽滤、洗涤、干燥,且干燥时应注意密封、避光 |
(5)现称取m g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用c
 溶液滴定,平均消耗V mL。
溶液滴定,平均消耗V mL。①用移液管吸取25.00mL溶液后,将移液管垂直放入稍倾斜的锥形瓶中,
②有同学认为该实验方案明显不合理,会导致产品中CuCl的纯度严重偏高,理由是
您最近半年使用:0次



