名校
解题方法
1 . 六氟锑酸钠( )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含 、
、 和
和 、
、 、CuO等)合成六氟锑酸钠的工艺流程如图所示:
、CuO等)合成六氟锑酸钠的工艺流程如图所示:

已知:① 的性质与
的性质与 类似;②
类似;② 可溶于
可溶于 溶液;③
溶液;③ 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:
(1)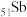 在元素周期表中的位置是
在元素周期表中的位置是___________ ,属于___________ 区元素。
(2)“碱浸、还原”时, 发生反应的离子方程式为
发生反应的离子方程式为___________ ;若 与
与 反应计量关系为
反应计量关系为 ,则氧化物为
,则氧化物为___________ 。
(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的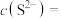
___________ [结果保留两位有效数字,常温下, ,
, ]。
]。
(4)“转化”时控温约80℃的原因是___________ 。
(5)“氟化”中发生的反应化学方程式为___________ 。
(6)氟锑酸化学式为 ,酸性比纯硫酸要强
,酸性比纯硫酸要强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成
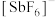 ,
, 离子的空间构型为
离子的空间构型为___________ 。
 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含 、
、 和
和 、
、 、CuO等)合成六氟锑酸钠的工艺流程如图所示:
、CuO等)合成六氟锑酸钠的工艺流程如图所示:
已知:①
 的性质与
的性质与 类似;②
类似;② 可溶于
可溶于 溶液;③
溶液;③ 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:(1)
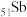 在元素周期表中的位置是
在元素周期表中的位置是(2)“碱浸、还原”时,
 发生反应的离子方程式为
发生反应的离子方程式为 与
与 反应计量关系为
反应计量关系为 ,则氧化物为
,则氧化物为(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入
 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的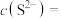
 ,
, ]。
]。(4)“转化”时控温约80℃的原因是
(5)“氟化”中发生的反应化学方程式为
(6)氟锑酸化学式为
 ,酸性比纯硫酸要强
,酸性比纯硫酸要强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成
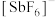 ,
, 离子的空间构型为
离子的空间构型为
您最近半年使用:0次
2 . 氧化锌烟灰中主要含有锌、铅、铜、氧、砷、氯等元素。氨法溶浸氧化锌烟灰可制取高纯锌,工艺流程如图所示。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为____________ 。
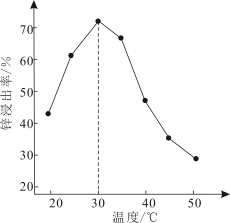
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为______________ 。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式__________________________________________ 。
(4)“滤渣3”除锌外,主要成分为___________________ 。
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是___________ (写名称)。电解后的电解液经补充_________ (写一种物质的化学式)后可返回至__________________ (填流程中的操作名称)循环利用。
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为_______________ 。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为

(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式
(4)“滤渣3”除锌外,主要成分为
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为
您最近半年使用:0次
名校
解题方法
3 . 工业上以软锰矿(主要成分 ,还含有少量的
,还含有少量的 、
、 、
、 等)为原料制取金属锰的工艺流程如图所示:
等)为原料制取金属锰的工艺流程如图所示:
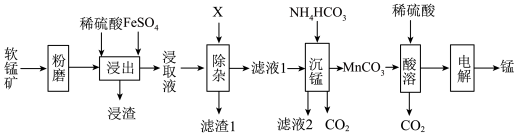
回答问题:
(1)Mn元素在元素周期表中的位置_______ (写周期和族)。
(2)软锰矿“粉磨”的目的是_______ 。
(3)写出“浸出”过程中 参与反应的离子方程式
参与反应的离子方程式_______ 。
(4)“除杂”反应中X可以是_______ (填标号)。
a.MnO b. c.
c. d.
d.
(5)写出“沉锰”操作中发生反应的离子方程式_______ 。
(6)“电解”操作中电极均为惰性电极,写出阴极的电极反应式_______ 。
(7)在废水处理中常用 将
将 转化MnS除去,向含有
转化MnS除去,向含有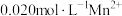 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的pH=a,当
气体,调节溶液的pH=a,当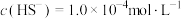 时,
时, 开始沉淀,则a=
开始沉淀,则a=_______ 。(已知:25℃时, 的电离常数
的电离常数 ,
,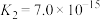 ;
; )
)
 ,还含有少量的
,还含有少量的 、
、 、
、 等)为原料制取金属锰的工艺流程如图所示:
等)为原料制取金属锰的工艺流程如图所示:
回答问题:
(1)Mn元素在元素周期表中的位置
(2)软锰矿“粉磨”的目的是
(3)写出“浸出”过程中
 参与反应的离子方程式
参与反应的离子方程式(4)“除杂”反应中X可以是
a.MnO b.
 c.
c. d.
d.
(5)写出“沉锰”操作中发生反应的离子方程式
(6)“电解”操作中电极均为惰性电极,写出阴极的电极反应式
(7)在废水处理中常用
 将
将 转化MnS除去,向含有
转化MnS除去,向含有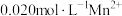 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的pH=a,当
气体,调节溶液的pH=a,当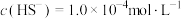 时,
时, 开始沉淀,则a=
开始沉淀,则a= 的电离常数
的电离常数 ,
,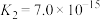 ;
; )
)
您最近半年使用:0次
名校
解题方法
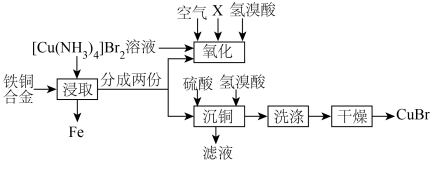
4 .  为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备
为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备 的流程如下:
的流程如下:
已知:“氧化”阶段存在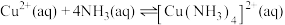 平衡。
平衡。
请回答下列问题:
(1) 在元素周期表中的位置为第
在元素周期表中的位置为第_______ 周期第_______ 族。
(2)“浸取”阶段的产物为 。
。
① 中含有
中含有_______  键。
键。
②其他条件不变, 浸出率与温度关系如图所示。
浸出率与温度关系如图所示。

请解释 以前随温度升高,
以前随温度升高, 浸出率增大的原因:
浸出率增大的原因:_______ 。
③该阶段被氧化的铜元素与被还原的铜元素质量之比为_______ 。
(3)“氧化”阶段试剂X选用_______ (填“液氨”“浓氨水”或“稀氨水”)更好,试从平衡移动角度解释其原因:_______ 。
(4)补全“沉铜”阶段的离子方程式:_______  。
。
(5)洗涤时宜选用_______ (填“冷水”或“乙醇”)。
 为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备
为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备 的流程如下:
的流程如下:
已知:“氧化”阶段存在
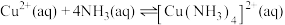 平衡。
平衡。请回答下列问题:
(1)
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)“浸取”阶段的产物为
 。
。①
 中含有
中含有 键。
键。②其他条件不变,
 浸出率与温度关系如图所示。
浸出率与温度关系如图所示。
请解释
 以前随温度升高,
以前随温度升高, 浸出率增大的原因:
浸出率增大的原因:③该阶段被氧化的铜元素与被还原的铜元素质量之比为
(3)“氧化”阶段试剂X选用
(4)补全“沉铜”阶段的离子方程式:
 。
。(5)洗涤时宜选用
您最近半年使用:0次
真题
名校
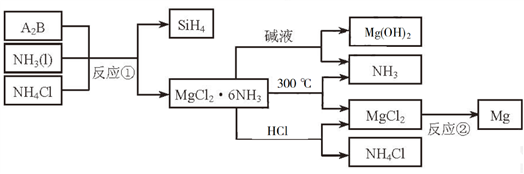
5 . 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________ ,Mg在元素周期表中的位置:_____________________ ,Mg(OH)2的电子式:____________________ 。
(2)A2B的化学式为_______________ 。反应②的必备条件是_______________ 。上图中可以循环使用的物质有_______________ 。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________ (写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________ 。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备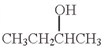 所需醛的可能结构简式:
所需醛的可能结构简式:_______________ 。

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):
(2)A2B的化学式为
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备
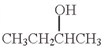 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近半年使用:0次
2018-06-09更新
|
2947次组卷
|
13卷引用:2018年全国普通高等学校招生统一考试化学(天津卷)
2018年全国普通高等学校招生统一考试化学(天津卷)【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)高考母题题源15 物质结构与推断(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物云南省玉溪元江民中2020届高三开学考试化学试题云南省弥勒市第四中学2019-2020学年高二上学期开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省绿春县二中2019-2020学年高一上学期期中考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记
6 . 工业上湿法合成硼氢化钠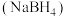 路线如下:
路线如下:

已知:硼酸的结构为: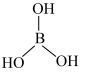
请回答下列问题:
(1)“合成”步骤中常将 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是___________ 。
(2)“合成”反应的化学方程式为___________ 。
(3)“合成”反应也可以利用KH,其还原能力比 更强,请说明原因
更强,请说明原因___________ 。
(4)硼氢化钠在催化剂钌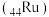 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。

(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素___________ 。并写出检验过程中涉及的离子方程式___________ 。
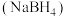 路线如下:
路线如下:
已知:硼酸的结构为:

请回答下列问题:
(1)“合成”步骤中常将
 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是(2)“合成”反应的化学方程式为
(3)“合成”反应也可以利用KH,其还原能力比
 更强,请说明原因
更强,请说明原因(4)硼氢化钠在催化剂钌
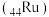 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。
A.元素钌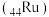 在元素周期表中位于第五周期Ⅷ族 在元素周期表中位于第五周期Ⅷ族 |
B. 分子中B原子为 分子中B原子为 杂化且不含孤对电子 杂化且不含孤对电子 |
C.过程④中产生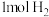 ,转移电子的物质的量为 ,转移电子的物质的量为 |
D.硼氢化钠中硼元素的化合价为 价,反应过程中硼元素的化合价始终保持不变 价,反应过程中硼元素的化合价始终保持不变 |
(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素
您最近半年使用:0次
解题方法
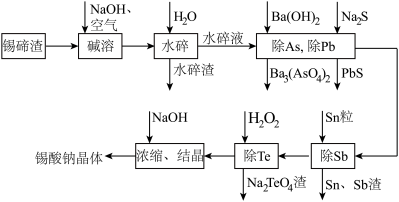
7 . 锡酸钠晶体(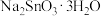 )在染料工业用作媒染剂。以锡碲渣废料(主要成分是SnO、TeO,还含有少量Fe、Te、Sb、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体的工艺流程如下:
)在染料工业用作媒染剂。以锡碲渣废料(主要成分是SnO、TeO,还含有少量Fe、Te、Sb、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体的工艺流程如下:
已知:水碎液中溶质的主要成分为 、
、 、
、 、
、 、
、 ,均为强电解质。
,均为强电解质。
回答下列问题:
(1)Sn元素在元素周期表中的位置为_______ 。
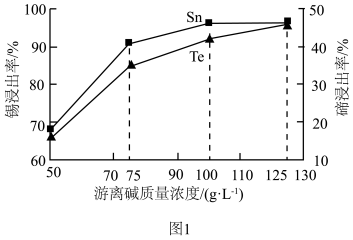
(2)“碱溶”时,TeO发生反应的化学方程式为_______ ,该过程中,锡碲浸出率与溶液中游离碱质量浓度关系如图1所示,则最理想的游离碱质量浓度为_______  。
。
(3)“除Sb”时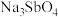 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
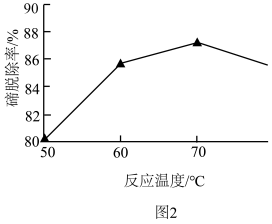
(4)“除Te”时,相同时间内不同的反应温度对Te的脱除率的影响关系如图2,随温度升高Te的脱除率先升高后下降的原因可能是_______ 。
(5)在“浓缩、结晶”时,加入NaOH的主要目的是_______ 。
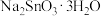 )在染料工业用作媒染剂。以锡碲渣废料(主要成分是SnO、TeO,还含有少量Fe、Te、Sb、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体的工艺流程如下:
)在染料工业用作媒染剂。以锡碲渣废料(主要成分是SnO、TeO,还含有少量Fe、Te、Sb、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体的工艺流程如下:
已知:水碎液中溶质的主要成分为
 、
、 、
、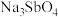 、
、 、
、 ,均为强电解质。
,均为强电解质。回答下列问题:
(1)Sn元素在元素周期表中的位置为
(2)“碱溶”时,TeO发生反应的化学方程式为
 。
。
(3)“除Sb”时
 发生反应的离子方程式为
发生反应的离子方程式为(4)“除Te”时,相同时间内不同的反应温度对Te的脱除率的影响关系如图2,随温度升高Te的脱除率先升高后下降的原因可能是

(5)在“浓缩、结晶”时,加入NaOH的主要目的是
您最近半年使用:0次
8 . 根据如图,已知有机物A,B,C,D,E,F有以下转化关系。A是分子量为28的气体烯烃,其产量是衡量一个国家石油化工生产水平的标志;D是食醋的主要成分,E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍,F是一种高分子化合物。结合如图关系回答问题:
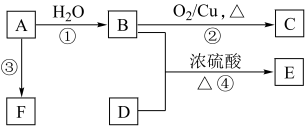
(1)写出D中官能团的名称:D____ 。
(2)写出下列反应的化学方程式:④____ ;该反应类型是____ 。F是常见的高分子材料,合成F的化学方程式是____ 。
(3)根据如图,实验室用该装置制备E,试管A中浓硫酸的作用是____ ;B中的试剂是____ ;B中导管的位置在液面上方,目的是:____ 。
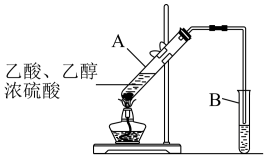
(4)根据如图,某化学课外小组设计了这样的装置(图中铁架台、铁夹、加热装置均已略去)制取E,与原装置相比,该装置的主要优点有:____ 。(至少回答两点)
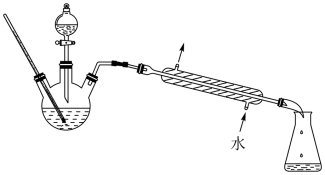

(1)写出D中官能团的名称:D
(2)写出下列反应的化学方程式:④
(3)根据如图,实验室用该装置制备E,试管A中浓硫酸的作用是

(4)根据如图,某化学课外小组设计了这样的装置(图中铁架台、铁夹、加热装置均已略去)制取E,与原装置相比,该装置的主要优点有:

您最近半年使用:0次
名校
解题方法
9 . 从钒铬锰矿渣(主要成分为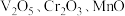 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下:
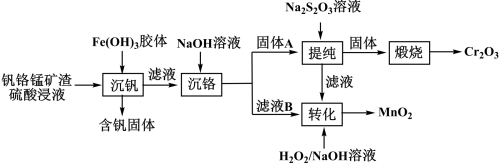
已知: 较大时,二价锰
较大时,二价锰 在空气中易被氧化。回答下列问题:
在空气中易被氧化。回答下列问题:
(1) 元素位于元素周期表第
元素位于元素周期表第_______ 周期_______ 族。
(2)用 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数 与
与 关系如图1,已知钒铬锰矿渣硫酸浸液中
关系如图1,已知钒铬锰矿渣硫酸浸液中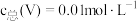 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。

(4)某温度下, (III)、
(III)、 (II)的沉淀率与
(II)的沉淀率与 关系如图2,“沉铬”过程最佳
关系如图2,“沉铬”过程最佳 为
为_______ (填标号);
a.4.0 b.5.0 c.6.0
在该条件下滤液B中
_______  [
[ 近似为
近似为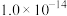 ,
, 的
的 近似为
近似为 ]。
]。
(5)“转化”过程中生成 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
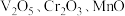 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下:
已知:
 较大时,二价锰
较大时,二价锰 在空气中易被氧化。回答下列问题:
在空气中易被氧化。回答下列问题:(1)
 元素位于元素周期表第
元素位于元素周期表第(2)用
 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数
 与
与 关系如图1,已知钒铬锰矿渣硫酸浸液中
关系如图1,已知钒铬锰矿渣硫酸浸液中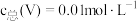 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为
(4)某温度下,
 (III)、
(III)、 (II)的沉淀率与
(II)的沉淀率与 关系如图2,“沉铬”过程最佳
关系如图2,“沉铬”过程最佳 为
为a.4.0 b.5.0 c.6.0
在该条件下滤液B中

 [
[ 近似为
近似为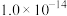 ,
, 的
的 近似为
近似为 ]。
]。(5)“转化”过程中生成
 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为
您最近半年使用:0次
10 . 锗是一种重要的战略资源,在半导体、航空航天测控等领域都有着广泛的应用。下图是以一种锗矿 主要成分为
主要成分为 、
、 、
、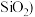 为原料制备锗的工艺流程:
为原料制备锗的工艺流程:
已知:
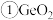 为两性氧化物。
为两性氧化物。
 “萃取”时用的萃取剂在本实验条件下对
“萃取”时用的萃取剂在本实验条件下对 有很好的选择性。
有很好的选择性。
 的熔、沸点分别为
的熔、沸点分别为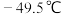 、
、 ,极易水解放热。
,极易水解放热。
 “蒸馏”过程中发生的反应为
“蒸馏”过程中发生的反应为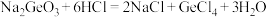 。
。
(1)锗在元素周期表中的位置为第_________ 周期第________ 族。
(2)“粉碎”的目的是_______________________ 。
(3)“焙烧”过程中 发生反应的化学方程式为
发生反应的化学方程式为________________ 。
(4)“滤渣”的成分为________________  填化学式
填化学式 ,“水相”中的阳离子除了
,“水相”中的阳离子除了 和
和 外,还有
外,还有__________________  填离子符号
填离子符号 。
。
(5)“萃取”时,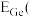 锗的萃取率
锗的萃取率 与
与 水相与有机相的体积比
水相与有机相的体积比 的关系如图所示,从生产成本的角度考虑,最适宜的
的关系如图所示,从生产成本的角度考虑,最适宜的 为
为______________  填序号
填序号 。
。
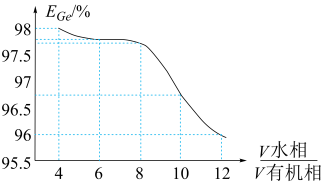
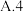
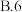

(6)“水解”时反应的化学方程式为_________________ ,该步实验操作必须在冰盐浴中进行的原因除了有利于水解反应正向进行外,还有______________ 。
(7)假设流程中每步都没有锗元素损失,若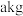 锗
锗  含锗
含锗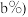 经提纯得到
经提纯得到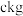 的锗,则杂质元素的脱除率为
的锗,则杂质元素的脱除率为_____________  用含a、b、c的式子表示
用含a、b、c的式子表示 。
。 已知:杂质元素的脱除率
已知:杂质元素的脱除率
 主要成分为
主要成分为 、
、 、
、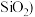 为原料制备锗的工艺流程:
为原料制备锗的工艺流程:
已知:
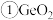 为两性氧化物。
为两性氧化物。 “萃取”时用的萃取剂在本实验条件下对
“萃取”时用的萃取剂在本实验条件下对 有很好的选择性。
有很好的选择性。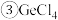 的熔、沸点分别为
的熔、沸点分别为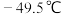 、
、 ,极易水解放热。
,极易水解放热。 “蒸馏”过程中发生的反应为
“蒸馏”过程中发生的反应为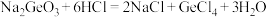 。
。(1)锗在元素周期表中的位置为第
(2)“粉碎”的目的是
(3)“焙烧”过程中
 发生反应的化学方程式为
发生反应的化学方程式为(4)“滤渣”的成分为
 填化学式
填化学式 ,“水相”中的阳离子除了
,“水相”中的阳离子除了 和
和 外,还有
外,还有 填离子符号
填离子符号 。
。(5)“萃取”时,
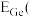 锗的萃取率
锗的萃取率 与
与 水相与有机相的体积比
水相与有机相的体积比 的关系如图所示,从生产成本的角度考虑,最适宜的
的关系如图所示,从生产成本的角度考虑,最适宜的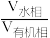 为
为 填序号
填序号 。
。

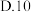
(6)“水解”时反应的化学方程式为
(7)假设流程中每步都没有锗元素损失,若
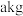 锗
锗  含锗
含锗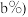 经提纯得到
经提纯得到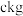 的锗,则杂质元素的脱除率为
的锗,则杂质元素的脱除率为 用含a、b、c的式子表示
用含a、b、c的式子表示 。
。 已知:杂质元素的脱除率
已知:杂质元素的脱除率
您最近半年使用:0次



