名校
解题方法
1 . 下列指定反应的离子方程式正确的是
A.实验室用稀硝酸清洗银镜: |
B.常用绿矾( )处理工业废水中的 )处理工业废水中的 : : |
C. 和 和 溶液反应: 溶液反应: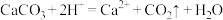 : : |
D.向 溶液中加入过量的 溶液中加入过量的 溶液并加热: 溶液并加热: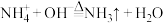 |
您最近一年使用:0次
名校
解题方法
2 . 亚硝酰氯NOCl常用于合成洗涤剂及合成中间体,某学习小组在实验室利用 反应制备NOCl,设计如图实验装置(夹持装置略去)。
反应制备NOCl,设计如图实验装置(夹持装置略去)。
①NOCl为红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃;
②NOCl遇水发生反应 。
。
回答下列问题:
(1)实验过程中,某同学发现铜与稀硝酸反应较慢,于是有同学提议用“浓硝酸”代替将A装置中的“稀硝酸”,该同学的观点是否合理?________ (填“合理”或“不合理”),试说明原因:_______________ .
(2)实验时,应先在三颈烧瓶内通入__________ (填“ ”或“NO”),另一种气体可以通入的标志是
”或“NO”),另一种气体可以通入的标志是______________________________ .
(3)实验中用NaOH溶液进行尾气处理。①无水 的作用是
的作用是_________________ 。②尾气处理时,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与_________ (填化学式)同时通入NaOH溶液中。
 反应制备NOCl,设计如图实验装置(夹持装置略去)。
反应制备NOCl,设计如图实验装置(夹持装置略去)。
①NOCl为红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃;
②NOCl遇水发生反应
 。
。回答下列问题:
(1)实验过程中,某同学发现铜与稀硝酸反应较慢,于是有同学提议用“浓硝酸”代替将A装置中的“稀硝酸”,该同学的观点是否合理?
(2)实验时,应先在三颈烧瓶内通入
 ”或“NO”),另一种气体可以通入的标志是
”或“NO”),另一种气体可以通入的标志是(3)实验中用NaOH溶液进行尾气处理。①无水
 的作用是
的作用是
您最近一年使用:0次
名校
解题方法
3 . 下列离子方程式正确的是
A. 溶液与少量 溶液与少量 溶液反应: 溶液反应: |
B.向 稀溶液中加入盐酸: 稀溶液中加入盐酸: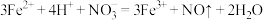 |
C.用 溶液吸收废气中的 溶液吸收废气中的 : :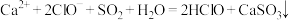 |
D.用热的NaOH溶液溶解S: |
您最近一年使用:0次
名校
4 . 如图是氮元素的各种价态与物质类别的对应关系:_____ 。从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有_______ 。
(2)实验室将浓氨水加入生石灰中可以快速制取NH3的化学方程式为_________ 。
(3)浓硝酸、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应使用___________ 。
(4)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_____________ 。

(2)实验室将浓氨水加入生石灰中可以快速制取NH3的化学方程式为
(3)浓硝酸、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应使用
(4)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为
您最近一年使用:0次
名校
5 . 下图为合成氨以及氨氧化制硝酸的流程示意图。
(1)物质A(纯净物)的化学式是___________ 。
(2)写出吸收塔中发生反应的离子方程式___________ 。
(3)为避免硝酸生产尾气中的氮氧化物污染环境,可以采用催化还原法处理尾气。写出使用氨气处理二氧化氮尾气的化学方程式___________ 。
(4)下列说法不正确 的是___________。
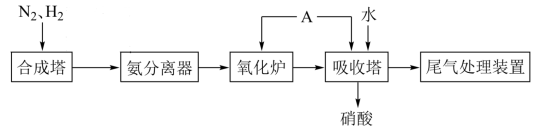
(1)物质A(纯净物)的化学式是
(2)写出吸收塔中发生反应的离子方程式
(3)为避免硝酸生产尾气中的氮氧化物污染环境,可以采用催化还原法处理尾气。写出使用氨气处理二氧化氮尾气的化学方程式
(4)下列说法
| A.铝的化学性质活泼,不能作为罐体材料盛装大量浓硝酸 |
| B.合成氨工业是最主要的人工固氮的途径 |
| C.氨极易溶于水,可形成喷泉实验 |
| D.工业制硝酸和制硫酸中都需要吸收塔装置,利用水吸收相应气体 |
您最近一年使用:0次
6 . 下列实验操作所得的实验现象及结论均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 检验硫代硫酸钠( )氧化变质可能混有的 )氧化变质可能混有的 | 取少量样品溶于水,先加入过量稀盐酸,再滴加 溶液,有沉淀生成 溶液,有沉淀生成 | 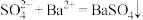 |
| B | 镁、铝为电极,氢氧化钠为电解质的原电池装置 | 铝表面有气泡 | 金属活动性:Mg>Al |
| C | 将某气体通入品红溶液中 | 溶液褪色 | 该气体一定是 |
| D | 向稀硝酸溶液中加入打磨的铝片 | 铝片溶解,试管口观察到浅红棕色气体 | 铝与稀硝酸反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 下列指定反应的离子方程式书写正确的是
A.NO2与水反应: |
B.氨水吸收足量SO2的反应: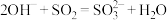 |
C.过量Fe和稀HNO3的反应: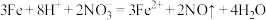 |
D.向 溶液中通入少量SO2: 溶液中通入少量SO2: |
您最近一年使用:0次
8 . 亚硝酸钠( )常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。
)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。 是白色粉末,易溶于水。
是白色粉末,易溶于水。
(1)滴入浓硝酸前先通入一段时间的 ,目的是
,目的是___________ 。
(2)B中发生反应的化学方程式为___________ 、___________ 。
(3)C中试剂是___________ (填名称)。
(4)装置E的作用是___________ 。
(5)观察到F中溶液由紫红色变为无色,经检验氧化产物是 ,还原产物是
,还原产物是 。写出F中发生反应的离子方程式:
。写出F中发生反应的离子方程式:___________ 。
(6)实验结束后小组同学发现装置A中浓硝酸有剩余,溶液呈绿色,针对这一现象提出猜想。
查阅资料:
ⅰ. 溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
ⅱ. 与水反应时会有部分发生反应:
与水反应时会有部分发生反应: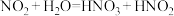 ,
, 是弱酸,无色,不稳定。
是弱酸,无色,不稳定。
ⅲ. 离子颜色为绿色。
离子颜色为绿色。
猜想1: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想2: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,溶液呈黄色,加入
,溶液呈黄色,加入___________ (填化学式)后呈绿色,证实猜想1合理。
②研究猜想2是否为所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
 )常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。
)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。 是白色粉末,易溶于水。
是白色粉末,易溶于水。
(1)滴入浓硝酸前先通入一段时间的
 ,目的是
,目的是(2)B中发生反应的化学方程式为
(3)C中试剂是
(4)装置E的作用是
(5)观察到F中溶液由紫红色变为无色,经检验氧化产物是
 ,还原产物是
,还原产物是 。写出F中发生反应的离子方程式:
。写出F中发生反应的离子方程式:(6)实验结束后小组同学发现装置A中浓硝酸有剩余,溶液呈绿色,针对这一现象提出猜想。
查阅资料:
ⅰ.
 溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;ⅱ.
 与水反应时会有部分发生反应:
与水反应时会有部分发生反应: ,
, 是弱酸,无色,不稳定。
是弱酸,无色,不稳定。ⅲ.
 离子颜色为绿色。
离子颜色为绿色。猜想1:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想2:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,溶液呈黄色,加入
,溶液呈黄色,加入②研究猜想2是否为所得溶液呈绿色的主要原因,实验如下。
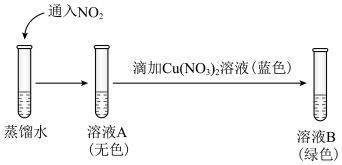
 的证据是
的证据是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
名校
9 . 某化学兴趣小组研究浓硝酸与KSCN溶液的反应。
资料:Ⅰ.SCN‒中S、C、N元素的化合价依次为:-2价、+4价、-3价。
Ⅱ.SCN‒的性质类似卤素离子,能被氧化为(SCN)2,(SCN)2可聚合为红色的(SCN)x。
Ⅲ.NO2可溶于浓硝酸。
(1)实验一:___________ (填化学式)。
(2)实验二:研究SCN‒的转化产物。
a.将实验一ⅲ中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量实验一ⅲ中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
①甲同学根据实验一iii的现象推断SCN‒的氧化产物中一定有NO2,乙同学认为证据不足,理由是___________ 。
②通过b证实了红棕色气体中不含SO2,证据是___________ 。
③由上述实验现象可知:SCN‒转化的最终产物中一定有___________ 。
(3)实验三:研究实验一ⅲ中“静置一段时间后,突然剧烈反应,红色迅速褪去”的原因。丙同学设计了实验三,与实验一进行对比,证实了一定浓度的NO2能加快浓硝酸氧化(SCN)x的化学反应速率。
实验三:___________ 。
②操作2是___________ 。
资料:Ⅰ.SCN‒中S、C、N元素的化合价依次为:-2价、+4价、-3价。
Ⅱ.SCN‒的性质类似卤素离子,能被氧化为(SCN)2,(SCN)2可聚合为红色的(SCN)x。
Ⅲ.NO2可溶于浓硝酸。
(1)实验一:
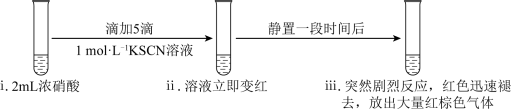
(2)实验二:研究SCN‒的转化产物。
a.将实验一ⅲ中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量实验一ⅲ中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
①甲同学根据实验一iii的现象推断SCN‒的氧化产物中一定有NO2,乙同学认为证据不足,理由是
②通过b证实了红棕色气体中不含SO2,证据是
③由上述实验现象可知:SCN‒转化的最终产物中一定有
(3)实验三:研究实验一ⅲ中“静置一段时间后,突然剧烈反应,红色迅速褪去”的原因。丙同学设计了实验三,与实验一进行对比,证实了一定浓度的NO2能加快浓硝酸氧化(SCN)x的化学反应速率。
实验三:
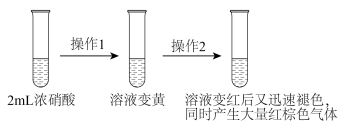
②操作2是
您最近一年使用:0次
2024-05-27更新
|
97次组卷
|
2卷引用:北师大附属实验中学2023-2024学年度第二学期期中试卷
名校
解题方法
10 . 铜与硝酸反应的装置如图所示,实验步骤如下:
步骤2:一段时间后,试管a中反应变平缓,溶液逐渐变成蓝色,同时气体颜色从下方开始变浅,最终变成无色。
步骤3:反应停止后,用注射器向试管a中注入少量稀硫酸,铜丝继续溶解,产生无色气体。
下列说法不正确的是

步骤2:一段时间后,试管a中反应变平缓,溶液逐渐变成蓝色,同时气体颜色从下方开始变浅,最终变成无色。
步骤3:反应停止后,用注射器向试管a中注入少量稀硫酸,铜丝继续溶解,产生无色气体。
下列说法不正确的是
| A.步骤1观察到试管a中充满红棕色气体,说明铜和浓硝酸反应生成NO2 |
| B.步骤2观察到反应变平缓而且气体颜色从下方开始变浅,说明浓硝酸已经变成稀硝酸 |
| C.步骤3固体继续溶解,说明此时铜被硫酸氧化 |
| D.相对于步骤2,步骤1中溶液显绿色可能是NO2溶解在硝酸铜中所致 |
您最近一年使用:0次
2024-05-27更新
|
134次组卷
|
3卷引用:北师大附属实验中学2023-2024学年度第二学期期中试卷



