铅的单质、氧化物、盐在现代T业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式:___ 。
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:

(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为____ 。 “脱硫过程”可在如图所示的装置中进行。实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h。

①仪器a的名称是____ ;转化温度为35℃,采用的合适加热方式是____ 。
②步骤②中H2O2的作用是____ (用化学方程式表示)。
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A___ (填装置字母代号),证明产物中有CO气体的实验现象是____ 。

(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为____ ,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14. 52 mL。
①若滴定管未用EDTA标准液润洗,测定结果将___ (填“偏高”“偏低”或“不变”)。
②草酸铅的纯度为___ (保留四位有效数字)。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式:
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:

(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为

①仪器a的名称是
②步骤②中H2O2的作用是
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A

(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为
①若滴定管未用EDTA标准液润洗,测定结果将
②草酸铅的纯度为
更新时间:2020-04-15 16:31:42
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】研究发现“利用零价铁还原 可脱除地下废水中硝酸盐”,某课外活动小组利用如下装置探究铁粉与
可脱除地下废水中硝酸盐”,某课外活动小组利用如下装置探究铁粉与 溶液的反应。实验步骤有如下五步:
溶液的反应。实验步骤有如下五步:
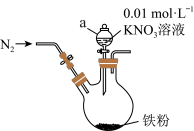
①打开弹簧夹,缓慢通入 ,并保持后续反应均在
,并保持后续反应均在 氛围中进行。
氛围中进行。
②加入pH已调至2.5的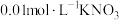 酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现剩余固体表面有少量白色物质附着。
酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现剩余固体表面有少量白色物质附着。
③连接好装置,并检查装置的气密性。
④检测到滤液中存在 、
、 和
和 。
。
⑤装好药品。
⑥过滤剩余固体时,表面的白色物质变为红褐色。
请回答下列问题:
(1)仪器a的名称是___________ 。
(2)通入 并保持后续反应均在
并保持后续反应均在 氛围中进行的实验目的是
氛围中进行的实验目的是___________ 。
(3)实验步骤的正确顺序是___________ 。
(4)白色物质是___________ ,白色物质变为红褐色的化学方程式为___________ :检验滤液中 所用的试剂是
所用的试剂是___________ 。
(5)某地下废水中 的含量测定。取VL废水,加入稀硫酸酸化,再加入
的含量测定。取VL废水,加入稀硫酸酸化,再加入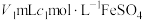 标准溶液(过量),充分反应后,用
标准溶液(过量),充分反应后,用 标准溶液滴定剩余的
标准溶液滴定剩余的 ,消耗
,消耗 标准溶液的体积为
标准溶液的体积为 ,终点时的现象是
,终点时的现象是___________ 。
 可脱除地下废水中硝酸盐”,某课外活动小组利用如下装置探究铁粉与
可脱除地下废水中硝酸盐”,某课外活动小组利用如下装置探究铁粉与 溶液的反应。实验步骤有如下五步:
溶液的反应。实验步骤有如下五步: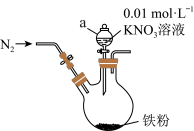
①打开弹簧夹,缓慢通入
 ,并保持后续反应均在
,并保持后续反应均在 氛围中进行。
氛围中进行。②加入pH已调至2.5的
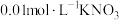 酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现剩余固体表面有少量白色物质附着。
酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现剩余固体表面有少量白色物质附着。③连接好装置,并检查装置的气密性。
④检测到滤液中存在
 、
、 和
和 。
。⑤装好药品。
⑥过滤剩余固体时,表面的白色物质变为红褐色。
请回答下列问题:
(1)仪器a的名称是
(2)通入
 并保持后续反应均在
并保持后续反应均在 氛围中进行的实验目的是
氛围中进行的实验目的是(3)实验步骤的正确顺序是
(4)白色物质是
 所用的试剂是
所用的试剂是(5)某地下废水中
 的含量测定。取VL废水,加入稀硫酸酸化,再加入
的含量测定。取VL废水,加入稀硫酸酸化,再加入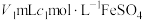 标准溶液(过量),充分反应后,用
标准溶液(过量),充分反应后,用 标准溶液滴定剩余的
标准溶液滴定剩余的 ,消耗
,消耗 标准溶液的体积为
标准溶液的体积为 ,终点时的现象是
,终点时的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】EDTA二钠盐(用 表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。
表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。
EDTA的结构简式为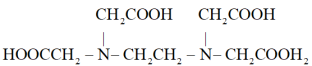 。
。
实验(一):制备 。
。
步骤1:称取一氯乙酸于三口瓶中,慢慢加入50%碳酸钠溶液,直至不再产生二氧化碳气泡为止。
步骤2:如图1所示,在50℃条件下保温2小时。
步骤3:将步骤2所得混合物倒入烧杯中,用浓盐酸调节pH至1.2,析出大量白色沉淀。
步骤4:从步骤3所得混合物中分离 ,如图2所示。
,如图2所示。

已知: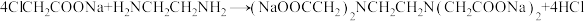 。
。
(1)图1中三口瓶采用___________ (填“酒精灯”或“热水浴”)加热。
(2)图1中仪器A的名称是___________ ,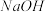 的作用是
的作用是___________ 。
(3)仪器B的作用是___________ ,进水口是___________ (填“a”或“b”)。
(4)用图2装置分离 的优点是
的优点是___________ 。
(5)分离出来的 用
用___________ (填“冷水”、“热水”或“酒精”)洗涤。
实验(二):用 溶液测定饮用水的总硬度
溶液测定饮用水的总硬度
饮用水的总硬度用 、
、 的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol/L的
的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol/L的 溶液滴定,三次平行实验测定数据如下:
溶液滴定,三次平行实验测定数据如下:
滴定反应: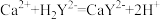 ,
,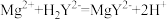 。
。
(6)该饮用水的总硬度为___________ mol/L。
(7)下列操作可能使测得的结果偏高的是___________(填标号)。
 表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。
表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。EDTA的结构简式为
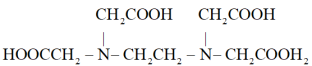 。
。实验(一):制备
 。
。步骤1:称取一氯乙酸于三口瓶中,慢慢加入50%碳酸钠溶液,直至不再产生二氧化碳气泡为止。
步骤2:如图1所示,在50℃条件下保温2小时。
步骤3:将步骤2所得混合物倒入烧杯中,用浓盐酸调节pH至1.2,析出大量白色沉淀。
步骤4:从步骤3所得混合物中分离
 ,如图2所示。
,如图2所示。
已知:
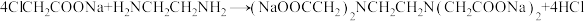 。
。(1)图1中三口瓶采用
(2)图1中仪器A的名称是
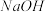 的作用是
的作用是(3)仪器B的作用是
(4)用图2装置分离
 的优点是
的优点是(5)分离出来的
 用
用实验(二):用
 溶液测定饮用水的总硬度
溶液测定饮用水的总硬度饮用水的总硬度用
 、
、 的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol/L的
的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol/L的 溶液滴定,三次平行实验测定数据如下:
溶液滴定,三次平行实验测定数据如下:| 实验 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 0.25 | 26.54 |
| Ⅱ | 1.20 | 26.10 |
| Ⅲ | 0.40 | 25.50 |
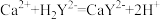 ,
,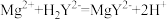 。
。(6)该饮用水的总硬度为
(7)下列操作可能使测得的结果偏高的是___________(填标号)。
A.盛装 溶液的滴定管没有润洗 溶液的滴定管没有润洗 | B.锥形瓶残留有蒸馏水 |
| C.开始时仰视读数,终点时俯视读数 | D.开始时滴定管充满溶液,终点时滴定管下端有气泡 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
I.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度,将水样与 碱性悬浊液(含有
碱性悬浊液(含有 )混合,反应生成
)混合,反应生成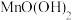 ,实现氧的固定。
,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,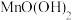 被
被 还原为
还原为 ,在暗处静置
,在暗处静置 ,然后用标准
,然后用标准 溶液滴定,生成的
溶液滴定,生成的 反应为:
反应为: 。
。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_______ 。
(2)“氧的固定”中发生反应的化学方程式为_______ 。
(3)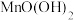 被
被 还原为
还原为 的离子反应方程式
的离子反应方程式_______ 。
(4)取 水样经固氧、酸化后,用
水样经固氧、酸化后,用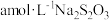 溶液滴定,以淀粉溶液作指示剂,终点现象为
溶液滴定,以淀粉溶液作指示剂,终点现象为_______ .若消耗 溶液的体积为
溶液的体积为 ,则水样中溶解氧的含量为
,则水样中溶解氧的含量为_______  。
。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏_______ (填“高”或“低”)。
I.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度,将水样与
 碱性悬浊液(含有
碱性悬浊液(含有 )混合,反应生成
)混合,反应生成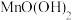 ,实现氧的固定。
,实现氧的固定。Ⅱ.酸化、滴定
将固氧后的水样酸化,
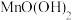 被
被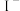 还原为
还原为 ,在暗处静置
,在暗处静置 ,然后用标准
,然后用标准 溶液滴定,生成的
溶液滴定,生成的 反应为:
反应为: 。
。回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是
(2)“氧的固定”中发生反应的化学方程式为
(3)
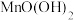 被
被 还原为
还原为 的离子反应方程式
的离子反应方程式(4)取
 水样经固氧、酸化后,用
水样经固氧、酸化后,用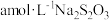 溶液滴定,以淀粉溶液作指示剂,终点现象为
溶液滴定,以淀粉溶液作指示剂,终点现象为 溶液的体积为
溶液的体积为 ,则水样中溶解氧的含量为
,则水样中溶解氧的含量为 。
。(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】高纯硫酸锰在电池材料领域具有重要的用途。一种以软锰矿(主要成分是 ,含有
,含有 、
、 、
、 、
、 等杂质)和硫铁矿(主要成分是
等杂质)和硫铁矿(主要成分是 ,含有FeO、NiO、
,含有FeO、NiO、 等杂质)为原料制备
等杂质)为原料制备 流程如下图所示。
流程如下图所示。

相关金属离子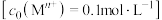 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)基态Mn原子的价电子排布式为_______ 。
(2)“滤渣1”的成分是 。“酸浸”过程中,
。“酸浸”过程中, 转化为
转化为 的化学反应方程式为
的化学反应方程式为_______ 。
(3)“氧化”目的是将浸出液中 氧化为
氧化为 ,为检测溶液中
,为检测溶液中 是否被氧化完全,可选用的化学试剂为
是否被氧化完全,可选用的化学试剂为_______ 。
(4)已知加入 调节溶液pH为5~6,则“滤渣2”的主要成分是
调节溶液pH为5~6,则“滤渣2”的主要成分是_______ 。
(5)已知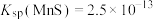 ,
, ,请用沉淀溶解平衡原理计算说明“除杂1”中选择MnS的原因
,请用沉淀溶解平衡原理计算说明“除杂1”中选择MnS的原因_______ 。
(6)“除杂2”中加入 的作用是
的作用是_______ 。
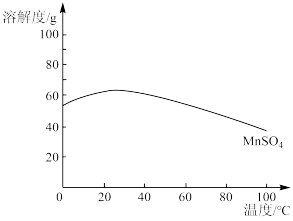
(7)下图为 溶解度曲线。则“结晶”的具体操作为
溶解度曲线。则“结晶”的具体操作为_______ 、_______ 、洗涤、干燥。
 ,含有
,含有 、
、 、
、 、
、 等杂质)和硫铁矿(主要成分是
等杂质)和硫铁矿(主要成分是 ,含有FeO、NiO、
,含有FeO、NiO、 等杂质)为原料制备
等杂质)为原料制备 流程如下图所示。
流程如下图所示。
相关金属离子
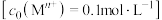 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.9 |
回答下列问题:
(1)基态Mn原子的价电子排布式为
(2)“滤渣1”的成分是
 。“酸浸”过程中,
。“酸浸”过程中, 转化为
转化为 的化学反应方程式为
的化学反应方程式为(3)“氧化”目的是将浸出液中
 氧化为
氧化为 ,为检测溶液中
,为检测溶液中 是否被氧化完全,可选用的化学试剂为
是否被氧化完全,可选用的化学试剂为(4)已知加入
 调节溶液pH为5~6,则“滤渣2”的主要成分是
调节溶液pH为5~6,则“滤渣2”的主要成分是(5)已知
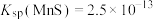 ,
, ,请用沉淀溶解平衡原理计算说明“除杂1”中选择MnS的原因
,请用沉淀溶解平衡原理计算说明“除杂1”中选择MnS的原因(6)“除杂2”中加入
 的作用是
的作用是(7)下图为
 溶解度曲线。则“结晶”的具体操作为
溶解度曲线。则“结晶”的具体操作为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:

NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr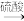 CH3CH2Br + H2O
CH3CH2Br + H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。
请回答下列问题。
(1)加入药品之前须做的操作是:_________________ ,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________ 。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________ 。温度计的温度应控制在_____________ 之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________ ,______________ ,此操作可在___________ (填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了_______________________ 。
(5)粗产品中含有的主要有机液体杂质是_____________ ,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________ 操作。

NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr
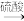 CH3CH2Br + H2O
CH3CH2Br + H2O某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g·cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是:
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了
(5)粗产品中含有的主要有机液体杂质是
您最近一年使用:0次
【推荐3】水泥的添加剂。以含钴废料(含少量 Fe、 Al 等杂质)制取CoCl26H2O的一种工艺如下:
已知:
(1)净化除杂时,加入 H2O2发生反应的离子方程式为____________________________ 。
(2)加入CoCO3调 pH 为 5.2~7.6,则操作1获得的滤渣成分为_____________________ 。
(3)加盐酸调整pH为2~3的目的为__________________________________________ 。
(4)操作Ⅱ过程为蒸发浓缩、______________ (填操作名称)、过滤。

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
(2)加入CoCO3调 pH 为 5.2~7.6,则操作1获得的滤渣成分为
(3)加盐酸调整pH为2~3的目的为
(4)操作Ⅱ过程为蒸发浓缩、
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】2021年5月15日,火星探测器“天问一号”成功若陆火星,着陆后“天问一号”将利用三结砷化镓太阳能电池作为其动力,一种由砷化镓废料(主要成分为GaAs,含Fe2O3、SiO2等杂质)制备馆镓的工艺流程如图:

已知:Ga在周期表中位于Al的正下方,性质与Al相似;
②离子完全沉淀的pH值:SiO 为8,GaO
为8,GaO 为5.5。
为5.5。
回答下列问题:
(1)“风化粉碎”的目的是___ 。
(2)图1、图2分别为碱浸时温度和浸泡时间对浸出率的距响,根据图中值息确定最佳反应条件:___ ;超过70℃,出率下降的原因可能有___ 。

(3)“滤渣1”的成分为___ (填化学式),“操作a”为___ 、过滤、洗涤、干燥。
(4)“碱浸”时,GaAs中Ga以NaGaO2的形式进入溶液中,该反应的离子方程式是___ 。
(5)“调pH1”时,不能通入过量的CO2,其原因是___ 。
(6)若用240kg含7.25%砷化镓的废料回收镓,得到纯度为96%的镓7.0kg,则镓的回收率为___ %(保留3位有效数字)。

已知:Ga在周期表中位于Al的正下方,性质与Al相似;
②离子完全沉淀的pH值:SiO
 为8,GaO
为8,GaO 为5.5。
为5.5。回答下列问题:
(1)“风化粉碎”的目的是
(2)图1、图2分别为碱浸时温度和浸泡时间对浸出率的距响,根据图中值息确定最佳反应条件:

(3)“滤渣1”的成分为
(4)“碱浸”时,GaAs中Ga以NaGaO2的形式进入溶液中,该反应的离子方程式是
(5)“调pH1”时,不能通入过量的CO2,其原因是
(6)若用240kg含7.25%砷化镓的废料回收镓,得到纯度为96%的镓7.0kg,则镓的回收率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】LiMn2O4是一种无污染、成本低的锂离子电池电极材料,某研究小组利用柠檬酸配合法制备LiMn2O4。
(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料,用6mol•L-1氨水调节pH至6.5~9,在75℃~85℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价),装置如图所示(加热和夹持装置已略去)。

①调节pH至6.5~9是为了促进柠檬酸电离,pH不能大于9的原因是_____ 。
②用水浴加热的目的是______ 。
(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4。
①柠檬酸配合物前驱体应放在______ (填仪器名称)中焙烧。
②焙烧需要在空气中进行的原因是______ 。
(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料,用6mol•L-1氨水调节pH至6.5~9,在75℃~85℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价),装置如图所示(加热和夹持装置已略去)。

①调节pH至6.5~9是为了促进柠檬酸电离,pH不能大于9的原因是
②用水浴加热的目的是
(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4。
①柠檬酸配合物前驱体应放在
②焙烧需要在空气中进行的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃铜锌矿制取活性ZnO的方案如图。

已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示。
回答下列问题:
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶解,这是由于相同温度下:Ksp(CuS)___ Ksp(ZnS)(填“>”、“<”或“=”)。
(2)除铁过程中试剂甲最好选用___ (填字母编号)。
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在范围之间___ 。
(4)沉淀Zn2+时发生反应的离子方程式为___ 。
(5)相同物质的量浓度的①NH4HSO4、②NH4HCO3、③NH4Cl三种溶液,pH值从大到小的顺序为____ (用数字标号填空,下同);相同温度下,NH 浓度相等的上述三种溶液,物质的量浓度从大到小的顺序为
浓度相等的上述三种溶液,物质的量浓度从大到小的顺序为____ 。
(6)含有Cr2O 的废水毒性较大。某工厂酸性废水中含5.0×10-3mol•L-1的Cr2O
的废水毒性较大。某工厂酸性废水中含5.0×10-3mol•L-1的Cr2O ,可先向废水中加入绿矾(FeSO4·7H2O),搅拌后撒入生石灰处理。
,可先向废水中加入绿矾(FeSO4·7H2O),搅拌后撒入生石灰处理。
①写出加入绿矾的离子方程式___ 。
②若处理后的废水中残留的c(Fe3+)=4.0×10-13mol•L-1,则残留的Cr3+的浓度为___ mol•L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-33)。

已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示。
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶解,这是由于相同温度下:Ksp(CuS)
(2)除铁过程中试剂甲最好选用
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在范围之间
(4)沉淀Zn2+时发生反应的离子方程式为
(5)相同物质的量浓度的①NH4HSO4、②NH4HCO3、③NH4Cl三种溶液,pH值从大到小的顺序为
 浓度相等的上述三种溶液,物质的量浓度从大到小的顺序为
浓度相等的上述三种溶液,物质的量浓度从大到小的顺序为(6)含有Cr2O
 的废水毒性较大。某工厂酸性废水中含5.0×10-3mol•L-1的Cr2O
的废水毒性较大。某工厂酸性废水中含5.0×10-3mol•L-1的Cr2O ,可先向废水中加入绿矾(FeSO4·7H2O),搅拌后撒入生石灰处理。
,可先向废水中加入绿矾(FeSO4·7H2O),搅拌后撒入生石灰处理。①写出加入绿矾的离子方程式
②若处理后的废水中残留的c(Fe3+)=4.0×10-13mol•L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]:测定硫元素的含量
I.将m1g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)I中,甲瓶内所盛试剂是_____________ 溶液。乙瓶内发生反应的离子方程式有_____________ 、_____________ 。
(2)Ⅱ中,所加H2O2溶液需足量的理由是_____________ 。
(3)该黄铁矿石中硫元素的质量分数为_____________ 。
[实验二]:设计以下实验方案测定铁元素的含量

问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?_____________ 。若不合理,会如何影响测量结果:_____________ (若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_____________ 。
(6)④中高锰酸钾溶液应放在_____________ 滴定管中;判断滴定终点的现象为_____________ 。
[实验一]:测定硫元素的含量
I.将m1g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)I中,甲瓶内所盛试剂是
(2)Ⅱ中,所加H2O2溶液需足量的理由是
(3)该黄铁矿石中硫元素的质量分数为
[实验二]:设计以下实验方案测定铁元素的含量

问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
(6)④中高锰酸钾溶液应放在
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】I.中国的侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了侯氏制碱法,又称联合制碱法,生产流程可以表示如图所示( 代表所需物质,代表产品,代表操作)
代表所需物质,代表产品,代表操作)

在上述工业流程中:
(1)产品N为___________ (填化学式),所需物质A为___________ (填名称)。
(2)侯德榜制碱法的原理是___________ (用2个化学方程式表示)。
(3)操作X为___________ 。
Ⅱ.利用侯德榜制碱原理制备的纯碱中含有少量NaCl等杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。实验步骤如下:

①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量(设为m1g);
③准确称取一定量的纯碱(设为ng),并将其放进广口瓶B内;
④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止;
⑤准确称取干燥管D的总质量(设为m2g)
根据上述实验,回答下列问题:
(4)根据此实验,纯碱中Na2CO3的质量分数为_________ (用含有m1、m2、n的计算式表示)。
(5)C是一个吸水的装置,如果缺少装置C,则计算所得的质量分数会___________ (填“偏高”、“偏低”或“无影响”)。
 代表所需物质,代表产品,代表操作)
代表所需物质,代表产品,代表操作)
在上述工业流程中:
(1)产品N为
(2)侯德榜制碱法的原理是
(3)操作X为
Ⅱ.利用侯德榜制碱原理制备的纯碱中含有少量NaCl等杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。实验步骤如下:

①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量(设为m1g);
③准确称取一定量的纯碱(设为ng),并将其放进广口瓶B内;
④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止;
⑤准确称取干燥管D的总质量(设为m2g)
根据上述实验,回答下列问题:
(4)根据此实验,纯碱中Na2CO3的质量分数为
(5)C是一个吸水的装置,如果缺少装置C,则计算所得的质量分数会
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
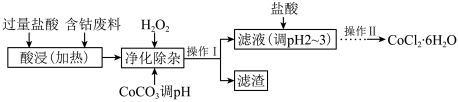
【推荐3】三草酸合铁酸钾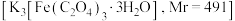 为翠绿色晶体,可溶于水,难溶于乙醇。实验室进行制备并对其阴离子电荷和晶体组成进行测定,方法如下并回答有关问题:
为翠绿色晶体,可溶于水,难溶于乙醇。实验室进行制备并对其阴离子电荷和晶体组成进行测定,方法如下并回答有关问题:
Ⅰ.晶体制备
ⅰ.称取一定量 加水溶解,向其中滴加稍过量的
加水溶解,向其中滴加稍过量的 氨水和6%
氨水和6% 溶液,于40℃水浴中加热搅拌;静置,弃去上层清液,洗涤后得到
溶液,于40℃水浴中加热搅拌;静置,弃去上层清液,洗涤后得到 沉淀。
沉淀。
ⅱ.向 沉淀中加入
沉淀中加入 溶液,于80℃水浴中不断搅拌至溶液呈翠绿色;将溶液加热浓缩、冷却、结晶;结晶完全后减压抽滤,得到产品。
溶液,于80℃水浴中不断搅拌至溶液呈翠绿色;将溶液加热浓缩、冷却、结晶;结晶完全后减压抽滤,得到产品。
(1)步骤ⅰ中,向静置后的上层清液中滴加_______ (填化学式),观察现象可确定反应是否进行完全。
(2)步骤ⅱ中为促进结晶,冷却后可加入_______ (填试剂名称)。
(3)减压抽滤采用如图装置。抽滤完毕,接下来的操作为_______ (填选项字母)。
A.先关闭水龙头,后拔掉橡胶管 B.先拔掉橡胶管,后关闭水龙头
Ⅱ.阴离子电荷的测定
准确称取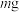 三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用
三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用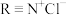 表示)的交换柱,发生阴离子(用
表示)的交换柱,发生阴离子(用 表示)交换:
表示)交换: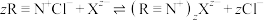 。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成
。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成 溶液。取
溶液。取 该溶液,以
该溶液,以 溶液为指示剂,用
溶液为指示剂,用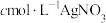 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 。
。
(4)阴离子电荷数为_______ (用含字母的代数式表示);若交换时样品液的流速过快,则会导致测定结果_______ (填“偏高”“偏低”或“无影响”)。
(5)阴离子交换树脂复原回收:实验完毕,用饱和 溶液淋洗交换柱内树脂,取最后一次淋洗液进行检验,合格后可回收。该检验操作为
溶液淋洗交换柱内树脂,取最后一次淋洗液进行检验,合格后可回收。该检验操作为_______ 。
Ⅲ.晶体部分组成的测定
ⅰ. 含量测定:称取一定量三草酸合铁酸钾,加硫酸酸化后配成溶液置于锥形瓶中,用
含量测定:称取一定量三草酸合铁酸钾,加硫酸酸化后配成溶液置于锥形瓶中,用 标准液滴定至终点。
标准液滴定至终点。
ⅱ.Fe3+含量测定:向ⅰ中滴定后的溶液中加入 粉和适量稀
粉和适量稀 ,加热至沸腾,过滤除去过量
,加热至沸腾,过滤除去过量 粉得滤液,冷却后用
粉得滤液,冷却后用 标准液滴定至终点。
标准液滴定至终点。
(6)若省略步骤ⅰ,直接利用步骤ⅱ不能测定 含量,解释其原因为
含量,解释其原因为_______ 。
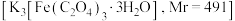 为翠绿色晶体,可溶于水,难溶于乙醇。实验室进行制备并对其阴离子电荷和晶体组成进行测定,方法如下并回答有关问题:
为翠绿色晶体,可溶于水,难溶于乙醇。实验室进行制备并对其阴离子电荷和晶体组成进行测定,方法如下并回答有关问题:Ⅰ.晶体制备
ⅰ.称取一定量
 加水溶解,向其中滴加稍过量的
加水溶解,向其中滴加稍过量的 氨水和6%
氨水和6% 溶液,于40℃水浴中加热搅拌;静置,弃去上层清液,洗涤后得到
溶液,于40℃水浴中加热搅拌;静置,弃去上层清液,洗涤后得到 沉淀。
沉淀。ⅱ.向
 沉淀中加入
沉淀中加入 溶液,于80℃水浴中不断搅拌至溶液呈翠绿色;将溶液加热浓缩、冷却、结晶;结晶完全后减压抽滤,得到产品。
溶液,于80℃水浴中不断搅拌至溶液呈翠绿色;将溶液加热浓缩、冷却、结晶;结晶完全后减压抽滤,得到产品。(1)步骤ⅰ中,向静置后的上层清液中滴加
(2)步骤ⅱ中为促进结晶,冷却后可加入
(3)减压抽滤采用如图装置。抽滤完毕,接下来的操作为

A.先关闭水龙头,后拔掉橡胶管 B.先拔掉橡胶管,后关闭水龙头
Ⅱ.阴离子电荷的测定
准确称取
 三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用
三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用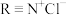 表示)的交换柱,发生阴离子(用
表示)的交换柱,发生阴离子(用 表示)交换:
表示)交换: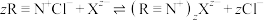 。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成
。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成 溶液。取
溶液。取 该溶液,以
该溶液,以 溶液为指示剂,用
溶液为指示剂,用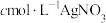 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 。
。(4)阴离子电荷数为
(5)阴离子交换树脂复原回收:实验完毕,用饱和
 溶液淋洗交换柱内树脂,取最后一次淋洗液进行检验,合格后可回收。该检验操作为
溶液淋洗交换柱内树脂,取最后一次淋洗液进行检验,合格后可回收。该检验操作为Ⅲ.晶体部分组成的测定
ⅰ.
 含量测定:称取一定量三草酸合铁酸钾,加硫酸酸化后配成溶液置于锥形瓶中,用
含量测定:称取一定量三草酸合铁酸钾,加硫酸酸化后配成溶液置于锥形瓶中,用 标准液滴定至终点。
标准液滴定至终点。ⅱ.Fe3+含量测定:向ⅰ中滴定后的溶液中加入
 粉和适量稀
粉和适量稀 ,加热至沸腾,过滤除去过量
,加热至沸腾,过滤除去过量 粉得滤液,冷却后用
粉得滤液,冷却后用 标准液滴定至终点。
标准液滴定至终点。(6)若省略步骤ⅰ,直接利用步骤ⅱ不能测定
 含量,解释其原因为
含量,解释其原因为
您最近一年使用:0次



