已知 A、B、C、D、E 五种元素都是元素周期表中前 20 号元素,原子序数依次增大,E 的外围电子排布式为 4s2。A、B、C、D 四种元素在元素周期表中的相对位置如表所示:
根据以上信息,回答下列问题:
(1) A、D 分别与 B 形成的化合物中,________ 的晶格能大(填化学式)。
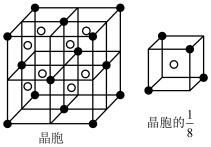
(2)A 和 E 可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。A 和 E 化合物的晶胞 1/8 的体积为 2.0×10-23cm3,求 A 和E 组成的离子化合物的密度为 (结果保留一位小数):________ g/cm3。
| …… | A | ||||||
| B | C | D |
根据以上信息,回答下列问题:
(1) A、D 分别与 B 形成的化合物中,

(2)A 和 E 可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。A 和 E 化合物的晶胞 1/8 的体积为 2.0×10-23cm3,求 A 和E 组成的离子化合物的密度为 (结果保留一位小数):
更新时间:2020-05-15 16:58:26
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
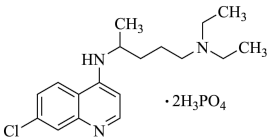
【推荐1】磷酸氯喹(结构如图所示)在细胞水平上能有效抑制新型冠状病毒的感染,我国印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中明确规定了其用量。
(1)碳、硅、锗为同一主族元素,则基态硅原子核外电子的空间运动状态有________ 种,基态锗原子的最外层的电子排布图为__________________ 。
(2)C、N、O三种元素第一电离能由大到小的顺序是_____________________ 。
(3)磷酸氯喹分子中氮原子的杂化方式为________ ,苯环中含有的共价键类型是________ 。
(4) 的空间构型是
的空间构型是____________ ,与 互为等电子体的分子是
互为等电子体的分子是____________ (写一种即可)。
(5)由C、H、O元素组成的H2O和C2H5OH可以任意比例互溶,其原因是________________ 。

(6)由P与B元素形成的化合物BP的晶胞(如图所示)中B采用面心立方堆积,P原子填入四面体空隙中。已知晶胞边长为a pm,晶体中B原子与P原子的最近距离是___________ ,设阿伏加 德罗常数的值为NA,则BP晶体的密度是___________ g/cm3(列出计算表达式)。

(1)碳、硅、锗为同一主族元素,则基态硅原子核外电子的空间运动状态有
(2)C、N、O三种元素第一电离能由大到小的顺序是
(3)磷酸氯喹分子中氮原子的杂化方式为
(4)
 的空间构型是
的空间构型是 互为等电子体的分子是
互为等电子体的分子是(5)由C、H、O元素组成的H2O和C2H5OH可以任意比例互溶,其原因是

(6)由P与B元素形成的化合物BP的晶胞(如图所示)中B采用面心立方堆积,P原子填入四面体空隙中。已知晶胞边长为a pm,晶体中B原子与P原子的最近距离是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】铁、银及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
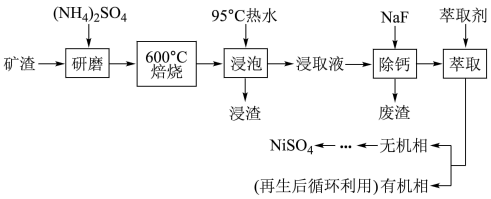
已知:(NH4)2SO4在350℃时分解生成NH3和H2SO4。
回答下列问题:
(1)基态Ni原子的价层电子排布图为__________ ,与Ni元素同周期,基态原子有1个未成对电子的金属元素有___________ 种。
(2)“浸渣”的成分有Fe2O3、FeO(OH),SiO2外,还含有___________ (写化学式)。
(3)矿渣中部分FeO在空气中焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_________ 。
(4)将“浸取液”冷却到室温,测得溶液中c(Ca2+)=l.0×10-3mol・L-1,向其中加入一定量的NaF晶体,搅拌,当溶液中c(F‑)=1.0×10-3mol·L-1时,除钙率为___________ %[室温时,Ksp(CaF2)=4.0×10‑11,除钙率=1- ]。
]。
(5)采用萃取操作可对溶液中的金属离子进行富集与分离:Fe2+(水相)+2HR(有机相)⇌FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(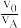 )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,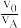 的最佳取值为
的最佳取值为___________ 。有机相中加入稀硫酸可以使萃取剂再生,反应的离子方程式为___________ 。
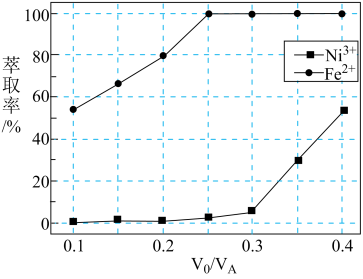
(6)CuFeS2晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如图1中原子1的分数坐标为( ,
, ,
, ),则原子2
),则原子2__________ 。

已知:(NH4)2SO4在350℃时分解生成NH3和H2SO4。
回答下列问题:
(1)基态Ni原子的价层电子排布图为
(2)“浸渣”的成分有Fe2O3、FeO(OH),SiO2外,还含有
(3)矿渣中部分FeO在空气中焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(4)将“浸取液”冷却到室温,测得溶液中c(Ca2+)=l.0×10-3mol・L-1,向其中加入一定量的NaF晶体,搅拌,当溶液中c(F‑)=1.0×10-3mol·L-1时,除钙率为
 ]。
]。(5)采用萃取操作可对溶液中的金属离子进行富集与分离:Fe2+(水相)+2HR(有机相)⇌FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(
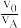 )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,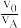 的最佳取值为
的最佳取值为
(6)CuFeS2晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如图1中原子1的分数坐标为(
 ,
, ,
, ),则原子2
),则原子2
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2 价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
①N、O、S三种元素的第一电离能由大到小的顺序为______________________________ 。
②比较NH3 和[Cu(NH3)4]2+中H-N-H键角的大小:NH3___________ [Cu(NH3)4]2+(填“>”或“<”),并说明理由________________________ 。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。
①NO3- 的立体构型的名称为_______________ ,N原子的杂化方式为________________ 。NO3- 的一种等电子体为________________________ 。
②N2O4会发生类似于水的自偶电离N2O4 NO++NO3- ,制备无水Cu(NO3)2的化学方程式为
NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________ 。
Ⅱ.CuCl是较为常见的+1价铜的化合物。
(3)基态Cu+ 的价层电子排布式为________________________ 。
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。

①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________ 。
②设NA为阿伏伽德罗常数的值,晶体的密度为ρg/cm3,CuCl的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cu原子间的距离为___________ pm。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
①N、O、S三种元素的第一电离能由大到小的顺序为
②比较NH3 和[Cu(NH3)4]2+中H-N-H键角的大小:NH3
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。
①NO3- 的立体构型的名称为
②N2O4会发生类似于水的自偶电离N2O4
 NO++NO3- ,制备无水Cu(NO3)2的化学方程式为
NO++NO3- ,制备无水Cu(NO3)2的化学方程式为Ⅱ.CuCl是较为常见的+1价铜的化合物。
(3)基态Cu+ 的价层电子排布式为
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。

①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为
②设NA为阿伏伽德罗常数的值,晶体的密度为ρg/cm3,CuCl的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cu原子间的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】碳和硅是自然界中大量存在的元素,硅及其化合物是工业上最重要的材料。设NA代表阿伏加德罗常数的值。粗硅的制备方法有两种:
方法一:SiO2+2C Si+2CO↑
Si+2CO↑
方法二:SiO2+2Mg Si+2MgO
Si+2MgO
(1)基态Si原子的电子排布式为______ 。
(2)上述2个反应中,涉及的所有元素中第一电离能最小的是______ (填元素符号)。
(3)C(金刚石)、晶体硅、CO三种晶体的熔点由高到低的顺序______ 。
(4)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si-Si键中间插入O原子而形成。

①推测SiO2晶胞中Si采取_______ 杂化。
②SiO2晶胞中含有______ 个Si原子和______ 个O原子。
③假设金刚石晶胞的边长为apm,试计算该晶胞的密度为______ g•cm-3(写出表达式即可),设C原子半径为rC,则金刚石晶胞空间占有率为______ %(列出计算表达式)。
方法一:SiO2+2C
 Si+2CO↑
Si+2CO↑方法二:SiO2+2Mg
 Si+2MgO
Si+2MgO(1)基态Si原子的电子排布式为
(2)上述2个反应中,涉及的所有元素中第一电离能最小的是
(3)C(金刚石)、晶体硅、CO三种晶体的熔点由高到低的顺序
(4)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si-Si键中间插入O原子而形成。

①推测SiO2晶胞中Si采取
②SiO2晶胞中含有
③假设金刚石晶胞的边长为apm,试计算该晶胞的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A. 海底热液研究(图1)处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物。
(1) Ni2+的核外电子排布式是____________________ 。
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是____________________ 。
(3) 下列说法正确的是________ 。
A. 电负性:N>O>S>C B. CO2与COS(硫化羰)互为等电子体
C. NH3分子中氮原子采用sp3杂化 D. CO、H2S、HCN都是极性分子
(4) “酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为________________ 。
(5) FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是____________________ 。在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为________________ 。

(1) Ni2+的核外电子排布式是
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是
| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
(3) 下列说法正确的是
A. 电负性:N>O>S>C B. CO2与COS(硫化羰)互为等电子体
C. NH3分子中氮原子采用sp3杂化 D. CO、H2S、HCN都是极性分子
(4) “酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为
(5) FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】工业上采用还原法冾炼黄金(Au)的原理如下:


请回答下列问题:
(1)在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为___________ ,金元素位于___________ 区。
(2)Zn和Cu相邻,第一电离能:I1(Cu)___________ (填“>”、“<”或“=”,下同)I1(Zn),第二电离能:I2(Cu)___________ I2(Zn)。
(3)1mol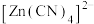 中含
中含___________ molσ键。
(4)已知卤化锌的熔点如下表所示:
卤化锌的熔点存在差异的主要原因是___________ 。
(5)由金、氯、铯三种元素组成的晶体M,其晶胞结构如图1所示,M的化学式为___________ ,其中金原子形成了2种不同的配离子(均呈负一价),它们分别是___________ 和___________ (写出离子符号,不分顺序)。

(6)金晶体的晶胞结构如图2所示,其晶胞参数为408pm,金晶体的密度为___________ (只列计算式,设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值) 。
。



请回答下列问题:
(1)在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为
(2)Zn和Cu相邻,第一电离能:I1(Cu)
(3)1mol
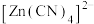 中含
中含(4)已知卤化锌的熔点如下表所示:
| 卤化锌 |  |  | 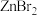 | 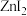 |
| 熔点/℃ | 872 | 283 | 394 | 446 |
(5)由金、氯、铯三种元素组成的晶体M,其晶胞结构如图1所示,M的化学式为

(6)金晶体的晶胞结构如图2所示,其晶胞参数为408pm,金晶体的密度为
 为阿伏加德罗常数的值)
为阿伏加德罗常数的值) 。
。
您最近一年使用:0次



