I.如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
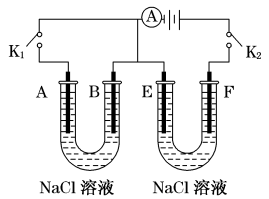
(1)断开K2,闭合K1时。B为___ 极,A的电极反应为_______ ,最终可观察到的现象是________ 。
(2)断开K1,闭合K2时。E为_____ 极,F极的电极反应为_____ ,检验F极产物的方法是___ 。
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A、B、E、F电极周围能变红的是____ 。
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。

试回答:
(1)电源电极X名称为____ 。
(2)pH变化:A池_____ , B池______ , C池____ 。
(3)写出B池中所发生的电解反应方程式:_________ 。

(1)断开K2,闭合K1时。B为
(2)断开K1,闭合K2时。E为
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A、B、E、F电极周围能变红的是
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。

试回答:
(1)电源电极X名称为
(2)pH变化:A池
(3)写出B池中所发生的电解反应方程式:
更新时间:2020-05-16 08:51:05
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】【化学---选修2:化学与技术】
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多______________ 的水,硬水加热后产生沉淀的离子方程式为:________________________________ (写出生成一种沉淀物的即可) 。
(2)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO),已知水的硬度在8°以下的称为软水,在8°以上的称为硬水。已知岛上山泉水中c( Ca2+)=1.2×10-3 mol/L,c(Mg2+) =6×l0-4mol/L,那么此水______ (填“是”或“否”)属于硬水。
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式__________________ 。
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理:______________ 。
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:

①阳离子交换膜是指___________ (填A或B)。
②写出通电后阳极区的电极反应式____________ ,阴极区的现象是:_______________ 。
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多
(2)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO),已知水的硬度在8°以下的称为软水,在8°以上的称为硬水。已知岛上山泉水中c( Ca2+)=1.2×10-3 mol/L,c(Mg2+) =6×l0-4mol/L,那么此水
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理:
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:

①阳离子交换膜是指
②写出通电后阳极区的电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】研究NOx、CO等大气污染气体的处理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:①NO2(g)+CO(g) CO2(g)+NO(g) ΔH1=−234.0 kJ·mol−1,②N2(g) +O2(g)
CO2(g)+NO(g) ΔH1=−234.0 kJ·mol−1,②N2(g) +O2(g) 2NO(g)ΔH2=+179.5 kJ·mol−1,③2NO(g)+O2(g)
2NO(g)ΔH2=+179.5 kJ·mol−1,③2NO(g)+O2(g) 2NO2(g) ΔH3=−112.3 kJ·mol−1,反应2NO2(g) +4CO(g)
2NO2(g) ΔH3=−112.3 kJ·mol−1,反应2NO2(g) +4CO(g) N2(g)+4CO2(g)的ΔH=
N2(g)+4CO2(g)的ΔH=__________ kJ·mol−1。
(2)在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应:2NO2(g)+4CO(g) N2(g) +4CO2(g),测得相关数据如下:
N2(g) +4CO2(g),测得相关数据如下:
①在0~10 min,用CO2的浓度变化表示的反应速率为______________ 。
②为使该反应的反应速率增大,下列措施中可采用的是________ (填字母代号)。
a.减小压强 b.适当升高温度 c.增大CO的浓度 d.选择高效催化剂
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为_______ 。此时通过阴离子交换膜的离子数____ (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口____ (填“A”“B”“C”或“D”)导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为_____ 。
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:①NO2(g)+CO(g)
 CO2(g)+NO(g) ΔH1=−234.0 kJ·mol−1,②N2(g) +O2(g)
CO2(g)+NO(g) ΔH1=−234.0 kJ·mol−1,②N2(g) +O2(g) 2NO(g)ΔH2=+179.5 kJ·mol−1,③2NO(g)+O2(g)
2NO(g)ΔH2=+179.5 kJ·mol−1,③2NO(g)+O2(g) 2NO2(g) ΔH3=−112.3 kJ·mol−1,反应2NO2(g) +4CO(g)
2NO2(g) ΔH3=−112.3 kJ·mol−1,反应2NO2(g) +4CO(g) N2(g)+4CO2(g)的ΔH=
N2(g)+4CO2(g)的ΔH=(2)在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应:2NO2(g)+4CO(g)
 N2(g) +4CO2(g),测得相关数据如下:
N2(g) +4CO2(g),测得相关数据如下:| 0 min | 5 min | 10 min | 15 min | 20 min | |
| c(NO2)/mol·L−1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol·L−1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②为使该反应的反应速率增大,下列措施中可采用的是
a.减小压强 b.适当升高温度 c.增大CO的浓度 d.选择高效催化剂
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
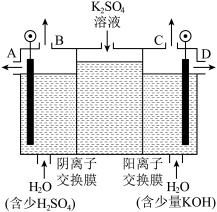
①该电解槽的阳极反应式为
②制得的氢氧化钾溶液从出口
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】电化学原理在金属腐蚀、能量转换、物质合成等方面应用广泛。
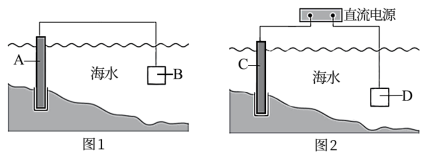
(1)通常可用图l、图2所示的两种方式减缓海水埘钢闸门A的腐蚀,则图l中材料B通常选择_________ (填字母序号),图2 中材料C最好选择_________ (填字母序号)。
a.钠块 b.铜块 c.锌块 d.石墨
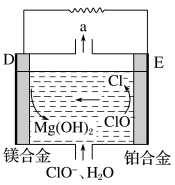
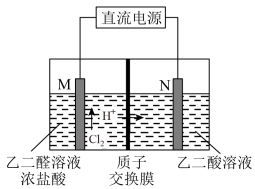
图3 图4
则图2中C上发生的主要电极反应式为___________________ 。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①D为该燃料电池的________ 极(填“正”或“负”)。E电极上的电极反应式为_______ 。
②镁燃料电池负极容易发生自腐蚀使负极利用率降低,该过程中产生的气体a为_______ (填化学式)。
(3)乙醇酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸。
①乙二醛(OHC—CHO)与M电极的气体产物反应生成乙醛酸,则反应的化学方程式为____________ 。
②该电解装置工作中若有0.5molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为____________ mol。

(1)通常可用图l、图2所示的两种方式减缓海水埘钢闸门A的腐蚀,则图l中材料B通常选择
a.钠块 b.铜块 c.锌块 d.石墨


图3 图4
则图2中C上发生的主要电极反应式为
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①D为该燃料电池的
②镁燃料电池负极容易发生自腐蚀使负极利用率降低,该过程中产生的气体a为
(3)乙醇酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸。
①乙二醛(OHC—CHO)与M电极的气体产物反应生成乙醛酸,则反应的化学方程式为
②该电解装置工作中若有0.5molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6 g。

请回答下列问题;
(1)A接的是电源的________ 极,B是该装置______ 极
(2)写出电解时反应的总离子方程式_______________
(3)电解后溶液的pH为________ ;要使电解后溶液恢复到电解前的状态,则需加入________ ,其质量为________ 。(假设电解前后溶液的体积不变)

请回答下列问题;
(1)A接的是电源的
(2)写出电解时反应的总离子方程式
(3)电解后溶液的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ、氮肥的使用在提高粮食产量的同时,也导致了土壤、水体污染等环境问题。
(1)长期过量使用铵态化肥NH4Cl,易导致土壤酸化,请用化学用语解释原因________________
(2)工业上处理氨氮废水的方法是采用电解法将NO 转化为N2,如图所示
转化为N2,如图所示


B极的电极反应方程式是_________________________
(3)除去60L废水中的62 mg NO 后, 废水的pH=
后, 废水的pH=_______ 。
Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色。
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为__________ 。
(2)欲用(丙)装置给铜镀银,银应该是_________ 电极(填G或H)。
(3)(丁)装置中Y极附近红褐色变__________ (填深或浅)。
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为______________ 。
(1)长期过量使用铵态化肥NH4Cl,易导致土壤酸化,请用化学用语解释原因
(2)工业上处理氨氮废水的方法是采用电解法将NO
 转化为N2,如图所示
转化为N2,如图所示

B极的电极反应方程式是
(3)除去60L废水中的62 mg NO
 后, 废水的pH=
后, 废水的pH=Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色。
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为
(2)欲用(丙)装置给铜镀银,银应该是
(3)(丁)装置中Y极附近红褐色变
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】甲醇( )是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知:
)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知:
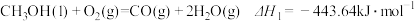
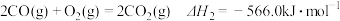
(1)试写出 (1)在氧气中完全燃烧生成
(1)在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:________
(2)科研人员研发出一种由强碱溶液作电解质溶液的新型甲醇手机电池,充满电后手机可连续使用一个月,则放电时,甲醇在___________ (填“正”或“负”)极发生反应。
(3)某同学设计了一种用电解法制取 的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是
的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是__________ (填序号)。
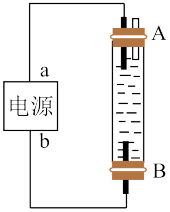
A.a为电源正极,b为电源负极 B.可以用NaCl溶液作为电解质溶液
C.A.B两端都必须用铁作电极 D.阴极发生的反应为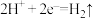
 )是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知:
)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知: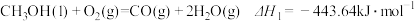
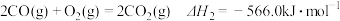
(1)试写出
 (1)在氧气中完全燃烧生成
(1)在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:(2)科研人员研发出一种由强碱溶液作电解质溶液的新型甲醇手机电池,充满电后手机可连续使用一个月,则放电时,甲醇在
(3)某同学设计了一种用电解法制取
 的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是
的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是
A.a为电源正极,b为电源负极 B.可以用NaCl溶液作为电解质溶液
C.A.B两端都必须用铁作电极 D.阴极发生的反应为
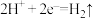
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完。设A池中原混合溶液的体积为200mL。
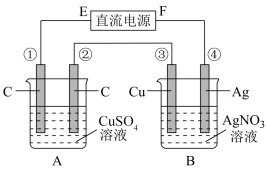
(1)电源F为______ 极;第②极为_____ 极;B池为_____ 池。
(2)A池中第②极上的电极反应式为_____ 。
(3)通电前A池中原混合溶液Cu2+的浓度为_____ 。

(1)电源F为
(2)A池中第②极上的电极反应式为
(3)通电前A池中原混合溶液Cu2+的浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】完成下列各小题
(1)已知在25℃、101kPa时,4g H2完全燃烧生成液态水,放出571.6kJ的热量,写出表示H2摩尔燃烧焓的热化学方程式:______________________ 。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生___________ 腐蚀而生锈。请写出铁锅生锈过程的正极反应式:_______________________ 。
(3)图中甲池的总反应式为N2H4+O2=N2+2H2O。
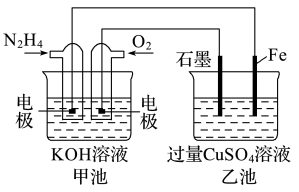
①甲池中负极上发生的是____________________ (填“氧化反应”或“还原反应”),乙池中SO 向
向_________ 移动(填“左”或“右”)。
②乙池中电解反应的离子方程为_________________________ 。
③要使乙池恢复到电解前的状态,应向溶液中加入_____________ (填化学式)。
(1)已知在25℃、101kPa时,4g H2完全燃烧生成液态水,放出571.6kJ的热量,写出表示H2摩尔燃烧焓的热化学方程式:
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生
(3)图中甲池的总反应式为N2H4+O2=N2+2H2O。

①甲池中负极上发生的是
 向
向②乙池中电解反应的离子方程为
③要使乙池恢复到电解前的状态,应向溶液中加入
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组同学利用下图装置进行电化学实验:

(1)装置乙中 电极的名称是
电极的名称是___________ 。(填“正极”或“负极”)
(2)装置丙中Pb上发生的电极反应方程式为___________ 。
(3)装置丁中左边石墨电极的电极反应方程式为___________ 。
(4)装置甲中溶液的pH会___________ (填“增大”“减小”或“不变”)。
(5)若装置戊的目的是在Fe材料上镀银,则X为___________ ,极板N的材料为___________ ,若装置戊的目的是精炼铜,则X为___________ ,极板M的材料为___________ ,极板M电极反应方程式为___________ 。
(6)当电路中通过0.2mol电子时,装置甲中产生的气体体积(标况下)为___________ L。

(1)装置乙中
 电极的名称是
电极的名称是(2)装置丙中Pb上发生的电极反应方程式为
(3)装置丁中左边石墨电极的电极反应方程式为
(4)装置甲中溶液的pH会
(5)若装置戊的目的是在Fe材料上镀银,则X为
(6)当电路中通过0.2mol电子时,装置甲中产生的气体体积(标况下)为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学电源在日常生活和工业生产中有着重要的应用。
I.如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题

(1)甲烷燃料电池负极反应式是______________________ 。
(2)石墨(C)极的电极反应式为______________________ 。
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为___________ L;丙装置中阴极析出铜的质量为___________ g,一段时间后烧杯中c(Cu2+)___________ (填“增大”、“减小”或“不变”)
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:

(4)从a口加入___________ (填名称)。H+移动方向是___________ (填“A到B”或“B到A”)
(5)A极发生的电极反应式:______________________ 。
(6)若以该电池为电源用石墨做电极电解200mL0.5mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是___________ 。
I.如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题

(1)甲烷燃料电池负极反应式是
(2)石墨(C)极的电极反应式为
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:

(4)从a口加入
(5)A极发生的电极反应式:
(6)若以该电池为电源用石墨做电极电解200mL0.5mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】以CH3OH燃料电池为电源电解法制取ClO2,二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
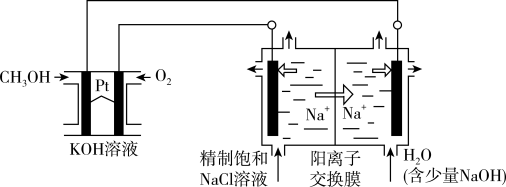
(1)CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH___________ (填“增大减小”或“不变”),负极反应式为。________________ 。
(2)图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,阳极产生ClO2的反应式为_______________ 。
(3)电解一段时间,从阴极处收集到的气体比阳极处收集到的气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为___________ mol。

(1)CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH
(2)图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,阳极产生ClO2的反应式为
(3)电解一段时间,从阴极处收集到的气体比阳极处收集到的气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】某课外活动小组同学用如图所示装置进行实验,试答下列问题:
(1)①若开始时开关K与a连接,则铁发生电化学腐蚀中的____ 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为______ 。

(2)硝化学式Na2SO4•l0H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。

①该电解槽的阳极反应式为___ 。
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)___ 导出。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为___ 。
④已知H2的燃烧热为285.8kJ⋅mol−1,则该燃料电池工作产生36gH2O时,理论上有___ kJ的能量转化为电能。
(1)①若开始时开关K与a连接,则铁发生电化学腐蚀中的
②若开始时开关K与b连接,则总反应的离子方程式为

(2)硝化学式Na2SO4•l0H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。

①该电解槽的阳极反应式为
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为
④已知H2的燃烧热为285.8kJ⋅mol−1,则该燃料电池工作产生36gH2O时,理论上有
您最近一年使用:0次



