如图为原电池装置示意图:
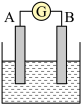
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为_______ 极(填正或负),写出电极反应式:正极_______ ,负极_______ .总反应离子方程式为:_______ 。
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为_______ 极(填正或负),写出电极反应式:正极_______ ,负极_______ .总反应离子方程式为:_______ 。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的_______ 极(填正或负),写出电极反应式:正极______________ ,负极______ .总反应方程式为:______ 。

(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的
更新时间:2020-06-28 17:23:47
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2g SiH4自燃放出热量89.2kJ,其热化学方程式为:_______
(2)已知60g C(s)与高温水蒸气反应制取CO和H2时吸收657.5kJ热量,写出热化学方程式_____________ 。
(3)某次发射火箭,用气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol
② N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol,
假如都在相同状态下,请写出发射火箭反应的热化学方程式。_______ 。
(4)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:
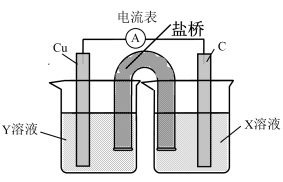
①写出正极电极反应式:___________ ;
②图中X溶液是_______ ,铜电极发生___________ 反应(填“氧化”或“还原”)。
③盐桥中的_____ (填“阳”、“阴”)离子向X溶液方向移动。
(2)已知60g C(s)与高温水蒸气反应制取CO和H2时吸收657.5kJ热量,写出热化学方程式
(3)某次发射火箭,用气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol
② N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol,
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
(4)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:

①写出正极电极反应式:
②图中X溶液是
③盐桥中的
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如图所示。其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍。
请回答下列问题:
(1)写出Y元素的名称:_______ ,X、Z单质构成燃料电池时正极参加反应的物质________ (填化学式)反应类型为________ (填氧化反应或还原反应)
(2)Q2Z电子式为__________ ,Q2Z2含的化学键类型为______________________ 。
(3)R、Z分别形成的简单离子的半径大小:________ (用离子符号表示)。
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为_________ 。
| Y | Z | ||
| R |
(1)写出Y元素的名称:
(2)Q2Z电子式为
(3)R、Z分别形成的简单离子的半径大小:
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】硫化氢( )为易燃危险化学品,与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,并且硫化氢有剧毒。石油与天然气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。根据所学知识回答下列问题:
)为易燃危险化学品,与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,并且硫化氢有剧毒。石油与天然气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。根据所学知识回答下列问题:
(1)已知:Ⅰ.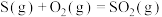
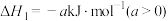
Ⅱ.
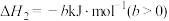
Ⅲ.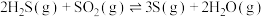

若反应Ⅲ中正反应的活化能为 ,逆反应的活化能为
,逆反应的活化能为 ,则
,则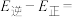
_______ (填含 、
、 的代数式)
的代数式) ;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是
;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是_______ (填标号)。
A.体系压强不再变化 B.断裂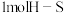 键的同时断裂
键的同时断裂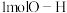 键
键
C.混合气体的密度不再变化 D.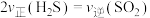
(2)利用工业废气 生产
生产 的反应为
的反应为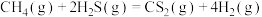 。向某容器中充入
。向某容器中充入 、
、 ,体系起始总压强为
,体系起始总压强为 ,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
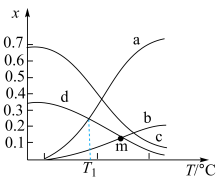
①图中表示 的曲线是
的曲线是_______ (填标号)。
② ℃时,该反应的
℃时,该反应的
___________ (列出表达式即可,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
③维持 点温度不变,向容器中再通入
点温度不变,向容器中再通入 、
、 、
、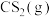 、
、 各
各 ,此时氢气的正、逆反应速率的关系为
,此时氢气的正、逆反应速率的关系为
___________ (填“>”“<”或“=”) 。
。
(3)工业中先将废气与空气混合,再通入 、
、 、
、 的混合液中,其转化过程如图2所示。已知:25℃时,
的混合液中,其转化过程如图2所示。已知:25℃时,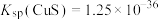 ,
, 的
的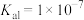 、
、 。则25℃时过程ii中的反应
。则25℃时过程ii中的反应___________ (填“能”或“不能”)进行完全。(已知:通常情况下,反应平衡常数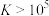 时,认为反应已进行完全)
时,认为反应已进行完全)
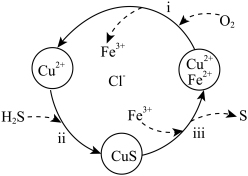
(4)某科研小组将微电池技术用于去除废气中的 ,其装置如图,主要反应:
,其装置如图,主要反应: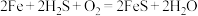 (
( 难溶于水),室温时,
难溶于水),室温时, 的条件下,研究反应时间对
的条件下,研究反应时间对 的去除率的影响。
的去除率的影响。

①装置中 溶液的作用是
溶液的作用是___________ , 在
在____ (填“正”或“负”)极生成。
②一段时间后,电流减小,单位时间内 的去除率降低,可能的原因是
的去除率降低,可能的原因是___________ 。
 )为易燃危险化学品,与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,并且硫化氢有剧毒。石油与天然气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。根据所学知识回答下列问题:
)为易燃危险化学品,与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,并且硫化氢有剧毒。石油与天然气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。根据所学知识回答下列问题:(1)已知:Ⅰ.
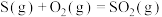
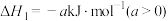
Ⅱ.

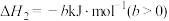
Ⅲ.
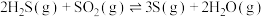

若反应Ⅲ中正反应的活化能为
 ,逆反应的活化能为
,逆反应的活化能为 ,则
,则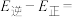
 、
、 的代数式)
的代数式) ;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是
;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是A.体系压强不再变化 B.断裂
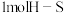 键的同时断裂
键的同时断裂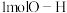 键
键C.混合气体的密度不再变化 D.
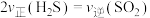
(2)利用工业废气
 生产
生产 的反应为
的反应为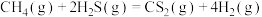 。向某容器中充入
。向某容器中充入 、
、 ,体系起始总压强为
,体系起始总压强为 ,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
①图中表示
 的曲线是
的曲线是②
 ℃时,该反应的
℃时,该反应的
③维持
 点温度不变,向容器中再通入
点温度不变,向容器中再通入 、
、 、
、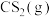 、
、 各
各 ,此时氢气的正、逆反应速率的关系为
,此时氢气的正、逆反应速率的关系为
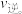 。
。(3)工业中先将废气与空气混合,再通入
 、
、 、
、 的混合液中,其转化过程如图2所示。已知:25℃时,
的混合液中,其转化过程如图2所示。已知:25℃时,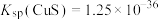 ,
, 的
的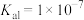 、
、 。则25℃时过程ii中的反应
。则25℃时过程ii中的反应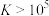 时,认为反应已进行完全)
时,认为反应已进行完全) 
(4)某科研小组将微电池技术用于去除废气中的
 ,其装置如图,主要反应:
,其装置如图,主要反应: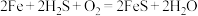 (
( 难溶于水),室温时,
难溶于水),室温时, 的条件下,研究反应时间对
的条件下,研究反应时间对 的去除率的影响。
的去除率的影响。
①装置中
 溶液的作用是
溶液的作用是 在
在②一段时间后,电流减小,单位时间内
 的去除率降低,可能的原因是
的去除率降低,可能的原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】I.下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。
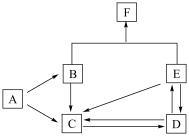
据此,请回答下列问题:
(1)写出以下物质的化学式:A_______ ,D_______ ,F_______ 。
(2)写出下列变化的化学方程式:
BC_______
EC_______
II.氢燃料电池车是北京冬奥会期间的交通服务用车,酸性氢氧燃料电池的构造如图所示。
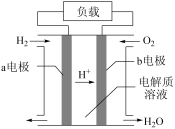
(3)若该电池中的电解质溶液是稀硫酸溶液,则a电极上发生反应的电极反应式为_______ 。
(4)b电极是该电池的_______ 极(填“正”或“负”),从氧化还原反应的角度分析,该电极发生的反应属于_______ 反应。
(5)当转移0.2mol电子时,需要消耗标况下的氢气体积是_______ L。

据此,请回答下列问题:
(1)写出以下物质的化学式:A
(2)写出下列变化的化学方程式:
BC
EC
II.氢燃料电池车是北京冬奥会期间的交通服务用车,酸性氢氧燃料电池的构造如图所示。

(3)若该电池中的电解质溶液是稀硫酸溶液,则a电极上发生反应的电极反应式为
(4)b电极是该电池的
(5)当转移0.2mol电子时,需要消耗标况下的氢气体积是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】2022年2月在北京举办了冬季奥运会,冬奥会奖牌是金镶玉材料,而玉的成分是硅酸盐和二氧化硅,回答下面问题:
(1)向硅酸钠溶液中通入少量CO2,生成一种凝胶硅酸,写出反应的离子方程式:___________ 。此实验可以证明碳元素的非金属性___________ (填“大于”或“小于”)硅元素。
(2)碳纳米材料是一种新型无机非金属材料,下面不属于新型无机非金属材料的是___________。
(3)举办冬奥会需要低温环境,而氨气是一种很好的制冷剂。
①写出氨气的电子式___________ 。
②写出实验室制备氨气的化学方程式___________ 。
(4)北京冬奥会基本实现100%绿电供应和碳中和,利用 和
和 在光催化酶作用下可以高效合成甲醇
在光催化酶作用下可以高效合成甲醇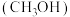 。
。
①写出甲醇燃烧的化学方程式:___________ ,该反应是___________ (填“吸热”或“放热”)反应。
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:

a电极是___________ 极,b电极发生的电极反应式是___________ 。外电路中有电子流入的是___________ (填“a”或“b”)极。
③将上图中的 改为甲醇就构成了碱性甲醇燃料电池,其中发生还原反应的电极是
改为甲醇就构成了碱性甲醇燃料电池,其中发生还原反应的电极是___________ (填“a”或“b”)极,a电极发生的电极反应式是___________ 。
(1)向硅酸钠溶液中通入少量CO2,生成一种凝胶硅酸,写出反应的离子方程式:
(2)碳纳米材料是一种新型无机非金属材料,下面不属于新型无机非金属材料的是___________。
| A.碳纳米管 | B.石墨烯 | C.超导电动陶瓷 | D.滑雪刀刃用铬钼钢 |
①写出氨气的电子式
②写出实验室制备氨气的化学方程式
(4)北京冬奥会基本实现100%绿电供应和碳中和,利用
 和
和 在光催化酶作用下可以高效合成甲醇
在光催化酶作用下可以高效合成甲醇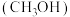 。
。①写出甲醇燃烧的化学方程式:
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:

a电极是
③将上图中的
 改为甲醇就构成了碱性甲醇燃料电池,其中发生还原反应的电极是
改为甲醇就构成了碱性甲醇燃料电池,其中发生还原反应的电极是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】 具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备
具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备 ,采用的装置如图B所示,以
,采用的装置如图B所示,以 辅助的
辅助的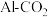 电池(如图A)为电源进行电解。
电池(如图A)为电源进行电解。
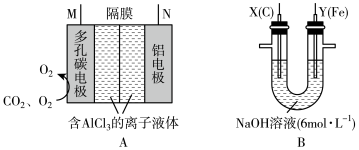
(1) 的电子式为
的电子式为___________ 。
(2)图A中正极反应式为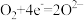 、
、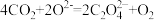 ,则该电池的总反应方程式为
,则该电池的总反应方程式为___________ 。
(3)图A中N极名称是___________ (填“正极”或“负极”),M极与图B___________ (填“X”或“Y”)极相连。
(4)电解过程中,图BX极区溶液的pH___________ (填“增大”“减小”或“不变”)。
(5)图B中两极均有气体产生,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极质量减小___________ g。
 具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备
具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备 ,采用的装置如图B所示,以
,采用的装置如图B所示,以 辅助的
辅助的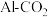 电池(如图A)为电源进行电解。
电池(如图A)为电源进行电解。
(1)
 的电子式为
的电子式为(2)图A中正极反应式为
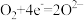 、
、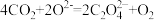 ,则该电池的总反应方程式为
,则该电池的总反应方程式为(3)图A中N极名称是
(4)电解过程中,图BX极区溶液的pH
(5)图B中两极均有气体产生,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极质量减小
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)①工业合成氨反应:N2+3H2 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量_______ (填“大于”、“小于”或“等于”)920kJ。
②已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
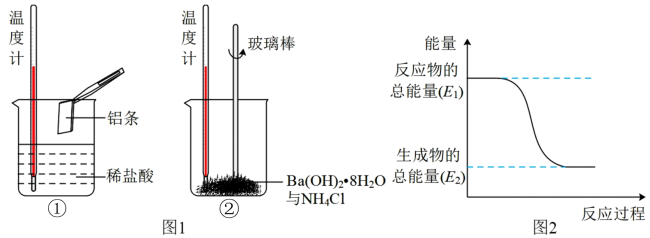
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______ (填“升高”或“降低”)。反应过程_______ (填“①”或“②”)的能量变化可用图2表示。
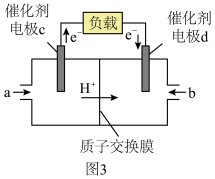
(3)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示,则d电极是_______ (填“正极”或“负极”),d电极的电极反应式为_______ 。
(1)①工业合成氨反应:N2+3H2
 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量②已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度

(3)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示,则d电极是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品。
(1)写出氯碱工业中电解饱和食盐水的离子方程式____ 。
(2)①室温下,0.1mol·L-1NaClO溶液的pH____ 0.1mol·L-1Na2SO3溶液的pH。(填“大于”、“小于”或“等于”)。已知:H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7;HClO的Ka=2.95×10-8
②设计实验证明NaHSO3溶液中HSO 的电离程度大于水解程度
的电离程度大于水解程度____ 。
(3)氯气含量检测仪中,原电池工作原理示意图如图所示。则Cl2在Pt电极放电的电极反应式为____ 。

(4)工业上用NaClO3氧化酸性FeCl2废液,通过控制条件,使Fe3+水解产物聚合,形成可溶的多聚体,最终析出红棕色胶状沉淀Fe2O3•nH2O。其中水解形成羟桥配离子的离子方程式为:2Fe3++10H2O [Fe(H2O)4(OH)2Fe(H2O)4]4++2H+△H>0。
[Fe(H2O)4(OH)2Fe(H2O)4]4++2H+△H>0。
欲使上述水解平衡正向移动,可采用的方法有____ (填字母)。
(1)写出氯碱工业中电解饱和食盐水的离子方程式
(2)①室温下,0.1mol·L-1NaClO溶液的pH
②设计实验证明NaHSO3溶液中HSO
 的电离程度大于水解程度
的电离程度大于水解程度(3)氯气含量检测仪中,原电池工作原理示意图如图所示。则Cl2在Pt电极放电的电极反应式为

(4)工业上用NaClO3氧化酸性FeCl2废液,通过控制条件,使Fe3+水解产物聚合,形成可溶的多聚体,最终析出红棕色胶状沉淀Fe2O3•nH2O。其中水解形成羟桥配离子的离子方程式为:2Fe3++10H2O
 [Fe(H2O)4(OH)2Fe(H2O)4]4++2H+△H>0。
[Fe(H2O)4(OH)2Fe(H2O)4]4++2H+△H>0。欲使上述水解平衡正向移动,可采用的方法有
| A.加水稀释 | B.加热 | C.加入盐酸 | D.加入NaHCO3 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。请回答下列问题:
Ⅰ.已知反应N2(g)+3H2(g) 2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
(1)反应2NH3(g) N2(g)+3H2(g)的活化能Ea2=
N2(g)+3H2(g)的活化能Ea2=______ kJ/mol(用含a的代数式表示);
(2)已知:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
则△H1、△H2、△H3三者之间的关系为:△H3=______________ ;
Ⅱ.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,工作原理如图所示。
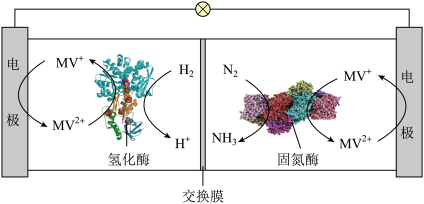
(3)负极的电极反应式为_______________ ;
(4)当电路中通过3mol电子时,可产生氨气的体积(标况下)为_______ L;正极区中n(H+)______ (填“增加”、“减少”或“不变”);
(5)该装置在高温下不能正常工作,原因是_____ 。
Ⅰ.已知反应N2(g)+3H2(g)
 2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:| 化学键 | H-H | N≡N | N-H |
| 键能/kJ·mol-1 | 436 | 946 | 391 |
 N2(g)+3H2(g)的活化能Ea2=
N2(g)+3H2(g)的活化能Ea2=(2)已知:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
则△H1、△H2、△H3三者之间的关系为:△H3=
Ⅱ.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,工作原理如图所示。

(3)负极的电极反应式为
(4)当电路中通过3mol电子时,可产生氨气的体积(标况下)为
(5)该装置在高温下不能正常工作,原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g)。
2HI(g)。
(1)保持容器容积不变,向其中充入1molHe,反应速率________ (填“加快”“减慢”或“不变”,下同)。
(2)保持容器内气体压强不变,向其中充入1molHe,反应速率________ 。
II.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,氢氧燃料电池以KOH溶液为电解质,其总反应的化学方程式为2H2+O2=2H2O。
(3)负极上的电极反应为______________________________ 。
(4)工作过程中时,溶液的c(OH-)_______ (填“增大”、“减小”或“不变”)。
Ⅲ..A、B、C、D、E、W、T六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子。B原子的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,W的L层电子数为K层和M层电子数之和,D和W同主族。回答下列问题:
(5)元素B在周期表中的位置是_______________________ 。
(6)元素C的原子结构示意图为_______________________ 。
(7)元素C与W可形成CW2,C与T可形成CT4,这两种化合物均可做溶剂,其电子式分别为____________________________________ 。
(8)元素A与D、E形成10电子分子的结构式分别为_______________________________ 。
(9)元素D、W的简单氢化物的沸点高的为____________ (用化学式表示)。
(10)1molCA4与D2完全反应生成两种气体时放出热量802kJ,则该反应的热化学方程式为__________________________________________________________________ 。
 2HI(g)。
2HI(g)。(1)保持容器容积不变,向其中充入1molHe,反应速率
(2)保持容器内气体压强不变,向其中充入1molHe,反应速率
II.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,氢氧燃料电池以KOH溶液为电解质,其总反应的化学方程式为2H2+O2=2H2O。
(3)负极上的电极反应为
(4)工作过程中时,溶液的c(OH-)
Ⅲ..A、B、C、D、E、W、T六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子。B原子的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,W的L层电子数为K层和M层电子数之和,D和W同主族。回答下列问题:
(5)元素B在周期表中的位置是
(6)元素C的原子结构示意图为
(7)元素C与W可形成CW2,C与T可形成CT4,这两种化合物均可做溶剂,其电子式分别为
(8)元素A与D、E形成10电子分子的结构式分别为
(9)元素D、W的简单氢化物的沸点高的为
(10)1molCA4与D2完全反应生成两种气体时放出热量802kJ,则该反应的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】按要求回答下列问题:
Ⅰ.某温度时,在2L密闭容器中,加入气体A、B,经过一段时间后,气体A、B的物质的量随时间变化的曲线如图所示,回答下列问题:

(1)该反应的化学方程式为____ 。
(2)0~4min内,用A表示反应速率v(A)=____ mol/(L·min)。
(3)反应达平衡时容器内混合气体的平均相对分子质量比起始时____ (填“变大”、“变小”或“相等”)。
(4)下列措施能加快反应速率的是____ 。
Ⅱ.化学能与电能之间可以相互转化。
(5)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是____ 。
(6)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的负极反应式为____ 。
②电池工作时OH-向____ 移动(填“正极”或“负极”)。
③正极上消耗4.48L(标准状况)气体时,转移电子的物质的量为____ 。
Ⅰ.某温度时,在2L密闭容器中,加入气体A、B,经过一段时间后,气体A、B的物质的量随时间变化的曲线如图所示,回答下列问题:

(1)该反应的化学方程式为
(2)0~4min内,用A表示反应速率v(A)=
(3)反应达平衡时容器内混合气体的平均相对分子质量比起始时
(4)下列措施能加快反应速率的是
| A.缩小体积,使压强增大 | B.恒温恒容充入氦气 |
| C.恒温恒压充入氦气 | D.使用催化剂 |
Ⅱ.化学能与电能之间可以相互转化。
(5)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.氢氧化钠与稀盐酸反应 |
| C.灼热的炭与CO2反应 | D.H2与Cl2燃烧反应 |

①电池的负极反应式为
②电池工作时OH-向
③正极上消耗4.48L(标准状况)气体时,转移电子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】根据化学能转化为电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。有甲、乙两位同学设计了如图所示的原电池。
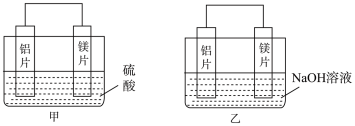
(1)写出甲中正极上的电极反应式:_______ 。
(2)乙中负极为_______ (填名称),总反应的离子方程式为_______ 。
Ⅱ.铅蓄电池是常用的化学电源,其电极材料分别是 和PbO2,电解液为稀硫酸。工作时,该电池总反应式为
和PbO2,电解液为稀硫酸。工作时,该电池总反应式为 。
。
(3)铅蓄电池属于_______ (填“一次”或“二次”)电池,该蓄电池放电时,负极材料是_______ (填化学式),放电时 被
被_______ (填“氧化”或“还原”)。
(4)该蓄电池放电时,电解质溶液中阴离子移向_______ (填“正”或“负”)极。
(5)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。写出该电池放电时,正极上的电极反应式:_______ 。
(6)充电时,以氢氧燃料电池(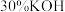 溶液为电解质溶液)为电源,则该氢氧燃料电池负极上的电极反应式为
溶液为电解质溶液)为电源,则该氢氧燃料电池负极上的电极反应式为_______ 。
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。有甲、乙两位同学设计了如图所示的原电池。

(1)写出甲中正极上的电极反应式:
(2)乙中负极为
Ⅱ.铅蓄电池是常用的化学电源,其电极材料分别是
 和PbO2,电解液为稀硫酸。工作时,该电池总反应式为
和PbO2,电解液为稀硫酸。工作时,该电池总反应式为 。
。(3)铅蓄电池属于
 被
被(4)该蓄电池放电时,电解质溶液中阴离子移向
(5)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。写出该电池放电时,正极上的电极反应式:
(6)充电时,以氢氧燃料电池(
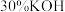 溶液为电解质溶液)为电源,则该氢氧燃料电池负极上的电极反应式为
溶液为电解质溶液)为电源,则该氢氧燃料电池负极上的电极反应式为
您最近一年使用:0次



