某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
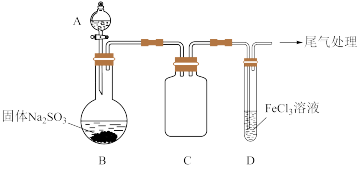
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO ⇌Fe(HSO3)2+。
⇌Fe(HSO3)2+。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______ ,装置C的作用为:________________ 。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________ 。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
综合上述实验探究过程,得出的结论为:____________ 。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________ 。

已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO
 ⇌Fe(HSO3)2+。
⇌Fe(HSO3)2+。步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
| 实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
19-20高二下·北京顺义·期末 查看更多[2]
更新时间:2020-07-05 07:35:11
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某研究性学习小组设计了如图装置制取和验证SO2的性质。
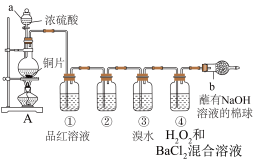
请回答:
(1)写出装置A中发生反应的化学方程式_______________________________ 。
(2)棉球中NaOH 溶液的作用是_______________________________ ,写出该反应离子方程式_______________________________ 。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____ 。
A.酸性高锰酸钾试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是_____ 。
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)二氧化硫排放到空气中,可形成酸雨,含亚硫酸的酸雨久置后pH_____ (增大、减小或不变)。你认为减少酸雨产生的途径可采取的措施是_____ 。
①少用煤作燃料; ②把工厂烟囱造高; ③燃料脱硫; ④在已酸化的土壤中加石灰;⑤开发新的能源。
A.②③ B.②③⑤ C.①③⑤ D.①③④⑤

请回答:
(1)写出装置A中发生反应的化学方程式
(2)棉球中NaOH 溶液的作用是
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是
A.酸性高锰酸钾试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)二氧化硫排放到空气中,可形成酸雨,含亚硫酸的酸雨久置后pH
①少用煤作燃料; ②把工厂烟囱造高; ③燃料脱硫; ④在已酸化的土壤中加石灰;⑤开发新的能源。
A.②③ B.②③⑤ C.①③⑤ D.①③④⑤
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某实验小组同利用某工业废弃矿石(主要成分为Cu2S和Fe2O3,其他成分不参与反应)制备绿矾(FeSO4·7H2O)和胆矾(CuSO4·5H2O),其工艺流程如图所示:
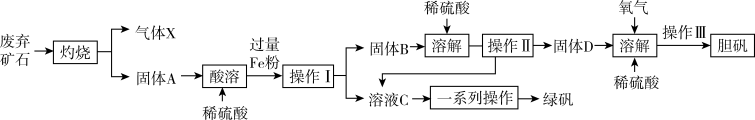
(1)“灼烧”时Cu2S转化为Cu,该反应中每生成6.4g的Cu,转移电子的物质的量为_______ 。
(2)“酸溶”过程中,红色固体A被溶解的离子方程式为_______ 。
(3)为检验溶液C中不含有Fe3+,而只含有Fe2+,应进行的实验操作和现象为_______ 。
(4)固体D、氧气和稀硫酸反应的离子方程式为_______ 。
(5)若称取12.0g废弃矿石经过上述流程最终得到2.50g胆矾,则废弃矿石中铜元素的含量(质量分数)为_______ %。(假设过程中没有铜元素损失,计算结果保留三位有效数字)
(6)加热FeSO4固体可发生分解反应,为探究分解产物,将FeSO4固体放在图所示的装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
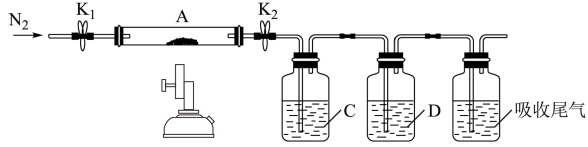
①C、D中的溶液依次为_______ (填标号)。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓硫酸
②写出FeSO4固体高温分解反应的化学方程式_______ 。

(1)“灼烧”时Cu2S转化为Cu,该反应中每生成6.4g的Cu,转移电子的物质的量为
(2)“酸溶”过程中,红色固体A被溶解的离子方程式为
(3)为检验溶液C中不含有Fe3+,而只含有Fe2+,应进行的实验操作和现象为
(4)固体D、氧气和稀硫酸反应的离子方程式为
(5)若称取12.0g废弃矿石经过上述流程最终得到2.50g胆矾,则废弃矿石中铜元素的含量(质量分数)为
(6)加热FeSO4固体可发生分解反应,为探究分解产物,将FeSO4固体放在图所示的装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓硫酸
②写出FeSO4固体高温分解反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫代硫酸钠(Na2S2O3·5H2O),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:
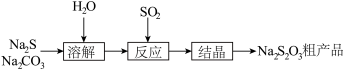
某化学兴趣小组同学模拟该流程设计了如下实验装置:
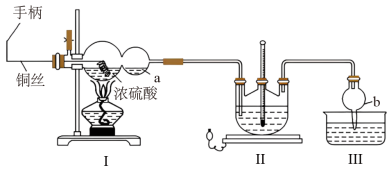
回答下列问题:
(1)双球管a处的液体可用来检验I中的反应是否发生,选用的试剂是______ (填字母)
a、品红溶液 b、NaOH溶液 c、稀硫酸
若要停止I中的化学反应,除停止加热外,还要采取的操作是___________________ 。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O;②可能是CuO;③可能是CuS;④CuS和CuO的混合物。乙同学提出假设①一定不成立,该同学的依据是____________________________________ ;丙同学做了如下实验来验证黑色物质的组成:
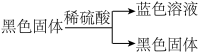
基于上述假设分析,原黑色物质的组成为____________________ (填化学式)。
(3)II中发生反应的化学方程式为_____________________ ,实验中通入的SO2不能过量,可能的原因是______________________________________________________ 。
(4)丁同学提出上述实验装置的设计存在不足,建议在I上_____________ ;在I、II之间增加_____________ 。

某化学兴趣小组同学模拟该流程设计了如下实验装置:

回答下列问题:
(1)双球管a处的液体可用来检验I中的反应是否发生,选用的试剂是
a、品红溶液 b、NaOH溶液 c、稀硫酸
若要停止I中的化学反应,除停止加热外,还要采取的操作是
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O;②可能是CuO;③可能是CuS;④CuS和CuO的混合物。乙同学提出假设①一定不成立,该同学的依据是

基于上述假设分析,原黑色物质的组成为
(3)II中发生反应的化学方程式为
(4)丁同学提出上述实验装置的设计存在不足,建议在I上
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】硫酸亚铁晶体 是一种重要的食品或饲料添加剂.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为
是一种重要的食品或饲料添加剂.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为 、
、 、
、 、
、 ,不考虑其他杂质)制取硫酸亚铁晶体的流程如图所示:
,不考虑其他杂质)制取硫酸亚铁晶体的流程如图所示:
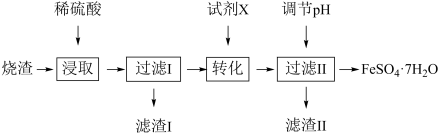
(1)烧渣要进行粉碎,目的是______________ 。
(2)滤渣I的主要成分是____________ (填化学式) 。
(3)“转化”是为了将溶液中的 转化为
转化为 。方法是向溶液中加入过量铁粉,其反应的离子方程式为
。方法是向溶液中加入过量铁粉,其反应的离子方程式为_____________ 。
(4)若检验滤液Ⅱ中不存在 ,可选择的操作方法是
,可选择的操作方法是_______________________ 。
(5)要得到 晶体的一系列具体操作是
晶体的一系列具体操作是_________ 、__________ 、过滤、洗涤、干燥,“过滤”所用到的玻璃仪器除了漏斗外还有__________ 、____________ 。
(6) 晶体应密封保存,主要目的是
晶体应密封保存,主要目的是________________ 。
 是一种重要的食品或饲料添加剂.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为
是一种重要的食品或饲料添加剂.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为 、
、 、
、 、
、 ,不考虑其他杂质)制取硫酸亚铁晶体的流程如图所示:
,不考虑其他杂质)制取硫酸亚铁晶体的流程如图所示:
(1)烧渣要进行粉碎,目的是
(2)滤渣I的主要成分是
(3)“转化”是为了将溶液中的
 转化为
转化为 。方法是向溶液中加入过量铁粉,其反应的离子方程式为
。方法是向溶液中加入过量铁粉,其反应的离子方程式为(4)若检验滤液Ⅱ中不存在
 ,可选择的操作方法是
,可选择的操作方法是(5)要得到
 晶体的一系列具体操作是
晶体的一系列具体操作是(6)
 晶体应密封保存,主要目的是
晶体应密封保存,主要目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组在验证反应“Fe+2Ag+===Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。向硝酸酸化的0.05 mol/L硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
资料:i.Ag+与SCN−生成白色沉淀AgSCN;
ⅱ.3Fe2++2[Fe(CN)6]3−===Fe3[Fe(CN)6]2↓(蓝色)
(1)检验产物:
①取出少量黑色固体,洗涤后,____________ (填操作和现象)。证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______ 。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是_________ (用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于____________ (用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3−具有氧化性,可产生Fe3+;
假设d:根据__________ 现象,判断溶液中存在Ag+,可产生Fe3+。
资料:i.Ag+与SCN−生成白色沉淀AgSCN;
ⅱ.3Fe2++2[Fe(CN)6]3−===Fe3[Fe(CN)6]2↓(蓝色)
(1)检验产物:
①取出少量黑色固体,洗涤后,
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| i | 3 | 产生大量白色沉淀;溶液呈红色 |
| ii | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀: 较30min时量少;溶液红色较30min时变浅 |
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于
假设c:酸性溶液中NO3−具有氧化性,可产生Fe3+;
假设d:根据
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】按要求完成下列各题:
Ⅰ.用 和
和 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①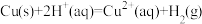 △H1=+64.39kJ/mol
△H1=+64.39kJ/mol
②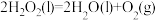 △H2=-196.46kJ/mol
△H2=-196.46kJ/mol
③ △H3=-285.84kJ/mol
△H3=-285.84kJ/mol
(1)在 溶液中,Cu与
溶液中,Cu与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为________ 。
Ⅱ.硫有多种化合物,如H2S、SO2等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(2)将 通入以下溶液,均会发生颜色变化,其中体现
通入以下溶液,均会发生颜色变化,其中体现 还原性的是________(填字母)。
还原性的是________(填字母)。
(3)有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成 而实现SO2的回收利用,写出Fe3+将
而实现SO2的回收利用,写出Fe3+将 氧化成
氧化成 反应的离子方程式
反应的离子方程式________ 。
(4)含有Fe2+、Fe3+的硫酸盐混合溶液可用于吸收H2S回收硫单质,其转化关系如图所示。该图示中总反应的化学方程式为________ 。

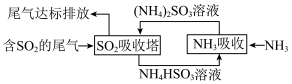
(5)某企业利用下列流程(如图)综合处理工厂排放的含 的烟气,以减少其对环境造成的污染。“
的烟气,以减少其对环境造成的污染。“ 吸收塔”中发生反应的化学方程式为
吸收塔”中发生反应的化学方程式为________ ,该流程中可循环利用的物质为________ (填化学式)。
Ⅰ.用
 和
和 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:①
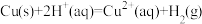 △H1=+64.39kJ/mol
△H1=+64.39kJ/mol②
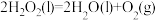 △H2=-196.46kJ/mol
△H2=-196.46kJ/mol③
 △H3=-285.84kJ/mol
△H3=-285.84kJ/mol(1)在
 溶液中,Cu与
溶液中,Cu与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为Ⅱ.硫有多种化合物,如H2S、SO2等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(2)将
 通入以下溶液,均会发生颜色变化,其中体现
通入以下溶液,均会发生颜色变化,其中体现 还原性的是________(填字母)。
还原性的是________(填字母)。| A.使溴水褪色 | B.使品红溶液褪色 |
| C.使滴有酚酞的氢氧化钠溶液褪色 | D.使氢硫酸溶液中出现淡黄色浑浊 |
(3)有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成
 而实现SO2的回收利用,写出Fe3+将
而实现SO2的回收利用,写出Fe3+将 氧化成
氧化成 反应的离子方程式
反应的离子方程式(4)含有Fe2+、Fe3+的硫酸盐混合溶液可用于吸收H2S回收硫单质,其转化关系如图所示。该图示中总反应的化学方程式为

(5)某企业利用下列流程(如图)综合处理工厂排放的含
 的烟气,以减少其对环境造成的污染。“
的烟气,以减少其对环境造成的污染。“ 吸收塔”中发生反应的化学方程式为
吸收塔”中发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】为了探究铁与氯气的反应,某同学甲设计了如下的实验方案。其实验装置为:
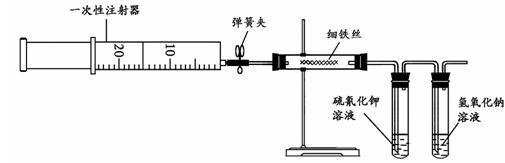
其实验步骤为:
(1)用注射器吸取20 mL左右的氯气。
(2)在硬质玻璃管内加入一定量的细铁丝,一支试管内加入硫氰化钾溶液,另一支试管中加入氢氧化钠溶液。按图所示连接实验装置,并固定在铁架台上。经检验装置不漏气。
(3)加热硬质玻璃管内铁丝约1 min,然后把注射器中的氯气注入到硬质玻璃管内,观察实验现象。可观察到的主要现象是__________________________________________________________ ,_____________________________________________________ 。
(4)氢氧化钠溶液的作用是___________________________________ 。
(5)某同学乙猜测铁与氯气反应可能还会生成氯化亚铁,其为了探究生成物中是否含有氯化亚铁(假设铁已完全反应),设计了实验步骤如下的实验方案,但其只写出了实验的第1步。现只有酸性KMnO4溶液和KSCN溶液,请你选用合适的试剂,补充同学乙的实验步骤、完善其实验方案:
第1步:取出甲实验后的玻璃管中的固体少量,放入小烧杯中加适量蒸馏水,搅拌、溶解。
____________________________________________________________________________________________________________________________________________________ 。

其实验步骤为:
(1)用注射器吸取20 mL左右的氯气。
(2)在硬质玻璃管内加入一定量的细铁丝,一支试管内加入硫氰化钾溶液,另一支试管中加入氢氧化钠溶液。按图所示连接实验装置,并固定在铁架台上。经检验装置不漏气。
(3)加热硬质玻璃管内铁丝约1 min,然后把注射器中的氯气注入到硬质玻璃管内,观察实验现象。可观察到的主要现象是
(4)氢氧化钠溶液的作用是
(5)某同学乙猜测铁与氯气反应可能还会生成氯化亚铁,其为了探究生成物中是否含有氯化亚铁(假设铁已完全反应),设计了实验步骤如下的实验方案,但其只写出了实验的第1步。现只有酸性KMnO4溶液和KSCN溶液,请你选用合适的试剂,补充同学乙的实验步骤、完善其实验方案:
第1步:取出甲实验后的玻璃管中的固体少量,放入小烧杯中加适量蒸馏水,搅拌、溶解。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】镁在二氧化碳中能燃烧,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如下装置进行探究。
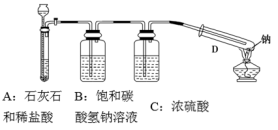
(1)写出镁在二氧化碳中燃烧的化学反应方程式:_______ 。
(2)该装置中饱和碳酸氢钠溶液的作用是_______ ,浓硫酸的作用是_______ 。
(3)用酒精灯在试管D底部加热,钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟。试管底部有黑色物质生成。试管冷却后,试管壁上附着一层白色物质。往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现。则试管壁上附着的白色物质是_______ 。将滤纸上的黑色物质在坩埚中灼烧,黑色物质能燃烧。则该黑色物质是_______ 。试写出钠与二氧化碳反应的化学方程式:_______ 。

(1)写出镁在二氧化碳中燃烧的化学反应方程式:
(2)该装置中饱和碳酸氢钠溶液的作用是
(3)用酒精灯在试管D底部加热,钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟。试管底部有黑色物质生成。试管冷却后,试管壁上附着一层白色物质。往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现。则试管壁上附着的白色物质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】SO2是硫元素重要的化合物,是大气主要污染物之一,是形成酸雨的主要原因,是以还原性为主的酸性氧化物,具有漂白性。
Ⅰ.检验SO2气体的实验方法和现象是______________ 。
Ⅱ.探究SO2气体的氧化性和还原性,可以使用的药品和装置如图1所示:
(1) 装置A中的现象是______ ,写出B中发生反应的离子方程式:______ 。
(2) 在上述装置中通入过量的SO2,为了验证B中SO2与Fe3+发生了氧化还原反应,取B中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是_________ ,原因是__________ 。
Ⅲ.使用如图2所示的装置进行实验,探究SO2与Na2O2的反应(图中铁架台等装置已略去)。
假设1 : 2SO2+2Na2O2=2Na2SO3+O2
假设2 : SO2+ Na2O2=2Na2SO4
(1) D装置的作用是______________ 。
(2)为验证假设1正确,需要进行的实验操作和现象是______________ 。
(3)为验证假设2正确,需要进行的实验操作和现象是______________ 。
Ⅰ.检验SO2气体的实验方法和现象是
Ⅱ.探究SO2气体的氧化性和还原性,可以使用的药品和装置如图1所示:

(1) 装置A中的现象是
(2) 在上述装置中通入过量的SO2,为了验证B中SO2与Fe3+发生了氧化还原反应,取B中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是
Ⅲ.使用如图2所示的装置进行实验,探究SO2与Na2O2的反应(图中铁架台等装置已略去)。

假设1 : 2SO2+2Na2O2=2Na2SO3+O2
假设2 : SO2+ Na2O2=2Na2SO4
(1) D装置的作用是
(2)为验证假设1正确,需要进行的实验操作和现象是
(3)为验证假设2正确,需要进行的实验操作和现象是
您最近一年使用:0次



