 、·CH3、
、·CH3、 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是| A.·CH3中的碳原子杂化方式为sp2 | B. 空间构型为正四面体 空间构型为正四面体 |
C. 中的键角大于NH3 中的键角大于NH3 | D. 与OH-形成的化合物中含有离子键 与OH-形成的化合物中含有离子键 |
2020·山东泰安·模拟预测 查看更多[2]
更新时间:2020-07-10 12:19:08
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列关于等电子体的说法中,正确的是
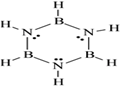
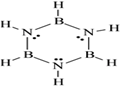
| A.N2与CO不属于等电子体,故它们的熔沸点、溶解度相差较大 |
| B.PO43-与SO42-不属于等电子体,故结构不相似 |
| C.NO2-与O3属于等电子体,故NO2-为O2的同素异形体 |
| D.苯与硼氮苯(路易斯结构式如上图)属于等电子体,故硼氮苯中含有大π键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】现有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且与Q同一主族;Y原子的价电子排布式为3d64s2;Z原子的L电子层的p能级上有一个空轨道,Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
| A.T的一种单质的空间构型为正四面体形 |
| B.1mol[Y(CO)5]分子中含5molσ键 |
| C.X和Q结合生成的一种化合物为平面三角形 |
D.Z 与Q 与Q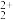 互为等电子体,1molQ 互为等电子体,1molQ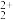 中含有的π键数目为2NA 中含有的π键数目为2NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】微观的世界多姿多彩,下列说法正确的是
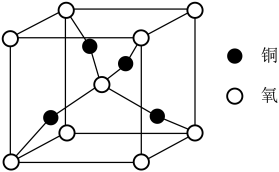
| A.上图为铜和氧形成的一种晶体,该氧化物为CuO |
| B.氧元素位于周期表的s区 |
C. 分子中,氮原子存在孤电子对 分子中,氮原子存在孤电子对 |
| D.四氨合铜离子中存在离子键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列化学用语表示正确的是
A.原子核内有8个中子的碳原子: |
B. 的VSEPR模型: 的VSEPR模型: |
C.基态氯原子的价电子排布式为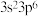 |
D.基态氮原子价电子的轨道表示式为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】顺铂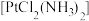 是具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(II)的简称,其结构如图所示,是一种新型抗癌药物。下列说法正确的是
是具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(II)的简称,其结构如图所示,是一种新型抗癌药物。下列说法正确的是
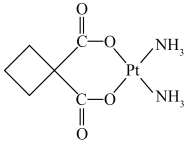
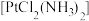 是具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(II)的简称,其结构如图所示,是一种新型抗癌药物。下列说法正确的是
是具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(II)的简称,其结构如图所示,是一种新型抗癌药物。下列说法正确的是
| A.碳铂分子中所有碳原子在同一平面上 |
B.顺铂分子中氮原子采取 杂化 杂化 |
C.碳铂分子中采取 杂化的碳原子与采取 杂化的碳原子与采取 杂化的碳原子数目之比为2︰1 杂化的碳原子数目之比为2︰1 |
| D.1mol碳铂中含有σ键的数目为14NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】电催化是利用催化剂电极进行电解以实现物质转化的前沿方法.使用单原子催化剂电催化将 转化为CO的部分机理如下所示.下列说法不正确的是
转化为CO的部分机理如下所示.下列说法不正确的是
 转化为CO的部分机理如下所示.下列说法不正确的是
转化为CO的部分机理如下所示.下列说法不正确的是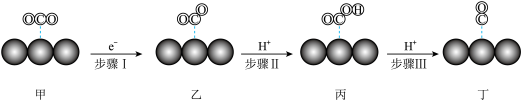
| A.该催化过程在电解池的阴极进行 | B. 的空间构型为直线形 的空间构型为直线形 |
| C.甲、乙中的C原子的杂化类型相同 | D.催化剂原子吸附 中带正电的部分 中带正电的部分 |
您最近一年使用:0次


 可用于制次氯酸、消毒液、漂白粉,在碱性条件下与
可用于制次氯酸、消毒液、漂白粉,在碱性条件下与 反应可制取水处理剂高铁酸钾(
反应可制取水处理剂高铁酸钾( ),
), )是生产医药、农药的重要原料,在催化剂作用下合成反应为
)是生产医药、农药的重要原料,在催化剂作用下合成反应为
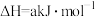 (
( )。
)。 可用作火箭推进剂。下列说法正确的是
可用作火箭推进剂。下列说法正确的是 分子的键角为120°
分子的键角为120° 与
与 与
与 的空间构型不同
的空间构型不同

