氢气在工业合成中应用广泛。
(1)通过下列反应可以制备甲醇:
①CO(g)+2H2(g)=CH3OH(g) ΔH=-90.8kJ·mol-1。
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.3kJ·mol-1。
请写出由CO2和H2制取甲醇的热化学方程式___ 。
(1)通过下列反应可以制备甲醇:
①CO(g)+2H2(g)=CH3OH(g) ΔH=-90.8kJ·mol-1。
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.3kJ·mol-1。
请写出由CO2和H2制取甲醇的热化学方程式
更新时间:2020-10-01 20:47:36
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】目前煤在我国依然是第一能源,煤的气化可以实现煤的综合利用,提高煤的利用价值。
已知:煤气化反应为C(s) + H2O(g) = CO(g)+H2(g) ΔH
① C(s)+O2(g) = CO2(g) ΔH1=-393.5 kJ/mol
② CO(g)+ O2(g) = CO2(g) ΔH2=-283.0 kJ/mol
O2(g) = CO2(g) ΔH2=-283.0 kJ/mol
③ H2(g)+ O2(g) = H2O(g) ΔH3=-242.0 kJ/mol
O2(g) = H2O(g) ΔH3=-242.0 kJ/mol
(1)ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH =_______ ;ΔH = _______ kJ/mol。
(2)从两个不同的角度评价将煤转化为CO和H2再燃烧的优点是________ 。
已知:煤气化反应为C(s) + H2O(g) = CO(g)+H2(g) ΔH
① C(s)+O2(g) = CO2(g) ΔH1=-393.5 kJ/mol
② CO(g)+
 O2(g) = CO2(g) ΔH2=-283.0 kJ/mol
O2(g) = CO2(g) ΔH2=-283.0 kJ/mol③ H2(g)+
 O2(g) = H2O(g) ΔH3=-242.0 kJ/mol
O2(g) = H2O(g) ΔH3=-242.0 kJ/mol(1)ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH =
(2)从两个不同的角度评价将煤转化为CO和H2再燃烧的优点是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】根据要求回答下列问题:
(1)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1;C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1。
①在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活。甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____ (填“>”“<”或“=”)890.3 kJ。
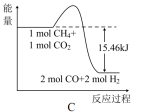
②甲烷与CO2可用于合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,能表示该反应过程中能量变化的是_______ (填字母)。



(2)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出其反应热ΔH=_____________ 。
(3)一定条件下,不同量的CO2与不同量的NaOH溶液充分反应放出的热量如表所示:
写出该条件下,CO2(g)与NaOH溶液反应生成NaHCO3的热化学方程式:___________________ 。
(1)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1;C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1。
①在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活。甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量
②甲烷与CO2可用于合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,能表示该反应过程中能量变化的是




(2)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出其反应热ΔH=
(3)一定条件下,不同量的CO2与不同量的NaOH溶液充分反应放出的热量如表所示:
| CO2(g)的量 | NaOH的量 | 放出的热量 |
| 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
| 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下,CO2(g)与NaOH溶液反应生成NaHCO3的热化学方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】按要求完成下列问题。
(1)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。如图表示反应中能量的变化;在图中,曲线
CH3OH(g)。如图表示反应中能量的变化;在图中,曲线____ (填“a”或“b”)表示使用了催化剂;该反应属于____ 反应。(填“吸热”或“放热”)。

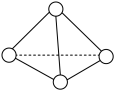
(2)科学家已获得了极具理论研究意义的N4气体分子,其结构为正四面体(如图所示),与白磷分子相似,化学性质比较活泼。已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,断裂1molN-H键吸收391kJ热量,断裂1molH-H键吸收436kJ热量,则:写出N4与H2反应生成NH3的热化学方程式:____ 。
(3)试运用盖斯定律回答下列问题:(已知Q1、Q2、Q3为正值)
已知:H2O(g)=H2O(l) ΔH1=-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3kJ/mol
则表示液态无水酒精燃烧热的热化学方程式为____ 。
(1)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。如图表示反应中能量的变化;在图中,曲线
CH3OH(g)。如图表示反应中能量的变化;在图中,曲线
(2)科学家已获得了极具理论研究意义的N4气体分子,其结构为正四面体(如图所示),与白磷分子相似,化学性质比较活泼。已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,断裂1molN-H键吸收391kJ热量,断裂1molH-H键吸收436kJ热量,则:写出N4与H2反应生成NH3的热化学方程式:

(3)试运用盖斯定律回答下列问题:(已知Q1、Q2、Q3为正值)
已知:H2O(g)=H2O(l) ΔH1=-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3kJ/mol
则表示液态无水酒精燃烧热的热化学方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨,s)
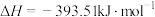
C(金刚石,s)

(1)请写出石墨转化为金刚石的热化学方程式________ 。
(2)已知物质的能量越低越稳定,请根据热化学方程式比较金刚石与石墨的稳定性________ 。
C(石墨,s)

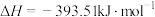
C(金刚石,s)


(1)请写出石墨转化为金刚石的热化学方程式
(2)已知物质的能量越低越稳定,请根据热化学方程式比较金刚石与石墨的稳定性
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:
(i)直接氯化: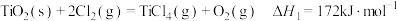 ,
,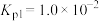 。
。
(ii)碳氯化: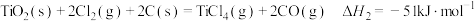 ,
,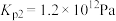 。则反应
。则反应 的
的 为
为____________  ,
,
________  ;对于碳氯化反应,温度升高,平衡转化率
;对于碳氯化反应,温度升高,平衡转化率____________ (填“变大”“变小”或“不变”)。
 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:(i)直接氯化:
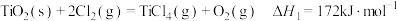 ,
,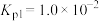 。
。(ii)碳氯化:
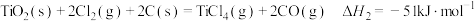 ,
,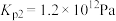 。则反应
。则反应 的
的 为
为 ,
,
 ;对于碳氯化反应,温度升高,平衡转化率
;对于碳氯化反应,温度升高,平衡转化率
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】I.某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为____ 。
(2)反应开始至2min,用Y表示的平均反应速率为____ 。
(3)对于反应A(g)+3B(g)=2C(g)+D(g),在四种不同情况下的反应速率分别为:①v(A)=9mol·L-1·min-1②v(B)=0.6mol·L-1·s-1③v(C)=0.5mol·L-1·min-1④v(D)=27mol·L-1·min-1,则反应进行由快到慢的顺序为____ 。
II.已知在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l) △H1=-571.6kJ·mol-1;
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=-890.3kJ·mol-1;
C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1。
根据上面的热化学方程式完成下列问题:
(4)等质量的H2、C、CH4完全燃烧时放出热量最多的是____ (填化学式)。
(5)根据以上反应,得C(s)+2H2(g)=CH4(g)焓变△H=____ (用含有△H1、△H2、△H3的式子表示)。
(6)已知H2O(l)=H2O(g) △H4=+44.0kJ·mol-1,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:____ 。

(1)该反应的化学方程式为
(2)反应开始至2min,用Y表示的平均反应速率为
(3)对于反应A(g)+3B(g)=2C(g)+D(g),在四种不同情况下的反应速率分别为:①v(A)=9mol·L-1·min-1②v(B)=0.6mol·L-1·s-1③v(C)=0.5mol·L-1·min-1④v(D)=27mol·L-1·min-1,则反应进行由快到慢的顺序为
II.已知在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l) △H1=-571.6kJ·mol-1;
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=-890.3kJ·mol-1;
C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1。
根据上面的热化学方程式完成下列问题:
(4)等质量的H2、C、CH4完全燃烧时放出热量最多的是
(5)根据以上反应,得C(s)+2H2(g)=CH4(g)焓变△H=
(6)已知H2O(l)=H2O(g) △H4=+44.0kJ·mol-1,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】[2017北京]TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH2=−220.9 kJ·mol−1
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________ 。

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | −69 | −25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH2=−220.9 kJ·mol−1
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)甲烷—氧气燃料电池是一种清洁能源,该电池用金属铂片插入氢氧化钾溶液中作电极,在两极上分别通甲烷和氧气。其电极反应式分别为:负极_______________ ,正极______________ 。电池在放电过程中溶液的PH将___________ (填“降低”、“升高”或“不变”)。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206.2kJ·mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g);△H=+247.4kJ·mol-1
写出CH4(g)与H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为________________ 。
(1)甲烷—氧气燃料电池是一种清洁能源,该电池用金属铂片插入氢氧化钾溶液中作电极,在两极上分别通甲烷和氧气。其电极反应式分别为:负极
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206.2kJ·mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g);△H=+247.4kJ·mol-1
写出CH4(g)与H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
(1)H2的燃烧热ΔH=_________ 。
(2)一定量的H2完全燃烧生成H2O(l)放出热量Q=1 143.36 kJ,则H2的质量为_________ g。
(3)在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为__________ 。
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ·mol-1
H2(g)+
 O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1(1)H2的燃烧热ΔH=
(2)一定量的H2完全燃烧生成H2O(l)放出热量Q=1 143.36 kJ,则H2的质量为
(3)在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
您最近一年使用:0次



