(化学-物质结构与性质)
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显_____ 价,A的电负性________ B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因__________________________________________________________________________ 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是________________ 。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),
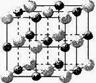
其中3种离子晶体的晶格能数据如下表:
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:_________________ 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有_______ 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是_____________ 。
(5)某配合物的分子结构如右图所示,其分子内不含有____ (填序号)。
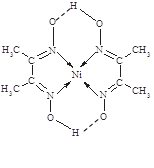
A.离子键 B.极性键
C.金属键 D.配位键
E.氢键 F.非极性键
(6)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
若有1mol CH4生成,则有______ molσ键和______ molπ键断裂。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A通常显
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),

其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(5)某配合物的分子结构如右图所示,其分子内不含有

A.离子键 B.极性键
C.金属键 D.配位键
E.氢键 F.非极性键
(6)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
若有1mol CH4生成,则有
2012·福建漳州·一模 查看更多[2]
更新时间:2016-12-09 03:14:23
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌原子的价电子排布图:___________
(2)硫和碲位于同主族,H2Te的空间结构为___________ 。H2S的分解温度高于H2Te,其主要原因是___________ 。
(3)Cd2+与NH3等配体形成配离子。1 mol [Cd(NH3)4]2+含___________ molσ键。该配离子中三种元素的电负性大小关系是:___________ 。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为___________
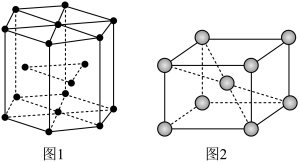
(5)锆晶胞如图1所示,这种堆积方式称为___________ ,镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为d g·cm-3.在该晶胞中两个镉原子最近核间距为___________ nm(用含NA、d的代数式表示)。
(1)锌原子的价电子排布图:
(2)硫和碲位于同主族,H2Te的空间结构为
(3)Cd2+与NH3等配体形成配离子。1 mol [Cd(NH3)4]2+含
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为
(5)锆晶胞如图1所示,这种堆积方式称为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1) 原子的原子结构示意图为
原子的原子结构示意图为___ ,基态S原子电子占据最高能级的电子云轮廓图为____ 形。
(2)根据价层电子对互斥理论, 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是____ ,该分子的空间结构为___ 。
(3)图(a)为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_______ 。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为___ 形;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为___ 。
(5) 晶体的晶胞如图(c)所示。晶胞边长为
晶体的晶胞如图(c)所示。晶胞边长为 、
、 相对式量为M,阿伏加德罗常数的值为
相对式量为M,阿伏加德罗常数的值为 ,其晶体密度的计算表达式为
,其晶体密度的计算表达式为___  ;晶胞中每个
;晶胞中每个 周围与它最近且距离相等的
周围与它最近且距离相等的 有
有_ 个,形成___ 形。
 |  |  |  |  |  | |
| 熔点/℃ |  | 115.2 |  (分解) (分解) | 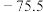 | 16.8 | 10.3 |
| 沸点/℃ |  | 444.6 |  | 45.0 | 337.0 |
回答下列问题:
(1)
 原子的原子结构示意图为
原子的原子结构示意图为(2)根据价层电子对互斥理论,
 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是(3)图(a)为
 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
(5)
 晶体的晶胞如图(c)所示。晶胞边长为
晶体的晶胞如图(c)所示。晶胞边长为 、
、 相对式量为M,阿伏加德罗常数的值为
相对式量为M,阿伏加德罗常数的值为 ,其晶体密度的计算表达式为
,其晶体密度的计算表达式为 ;晶胞中每个
;晶胞中每个 周围与它最近且距离相等的
周围与它最近且距离相等的 有
有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】磷及其化合物用途广泛。回答下列问题:
(1)基态P原子核外电子的运动状态有___________ 种,其最高能级的电子云轮廓图为___________ 形。
(2)氟磷酸钙也称氟磷灰石,它的化学式为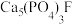 ,是牙釉的主要成分。
,是牙釉的主要成分。
①基态F原子价层电子的轨道表达式为___________ 。
②组成该化合物的四种元素电负性从大到小的顺序为___________ 。
(3) 在常温常压下为无色无味的有毒气体,在空气中相当稳定,常用作氟化剂,其与
在常温常压下为无色无味的有毒气体,在空气中相当稳定,常用作氟化剂,其与 的空间结构及相应的键角如图一所示。
的空间结构及相应的键角如图一所示。

① 分子中中心原子的杂化方式为
分子中中心原子的杂化方式为___________ 杂化,其空间构型为___________ 。
②稳定性:
___________ (填“>”“<”或“=”) ;键角:
;键角: <
< 的原因是
的原因是___________ 。
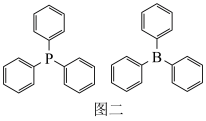
(4)三苯基磷与三苯基硼的结构简式如图二所示。下列说法正确的是___________(填字母)。
(5)磷锗锌晶体是一种红外非线性晶体,其晶胞结构如图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,图中A点Zn原子的分数坐标为(0,0,0),B点P原子的坐标为(0.25,0.25,0.125)。
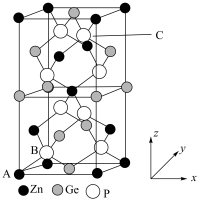
①C点P原子的坐标为___________ 。
②磷锗锌晶体的化学式为___________ 。
(1)基态P原子核外电子的运动状态有
(2)氟磷酸钙也称氟磷灰石,它的化学式为
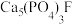 ,是牙釉的主要成分。
,是牙釉的主要成分。①基态F原子价层电子的轨道表达式为
②组成该化合物的四种元素电负性从大到小的顺序为
(3)
 在常温常压下为无色无味的有毒气体,在空气中相当稳定,常用作氟化剂,其与
在常温常压下为无色无味的有毒气体,在空气中相当稳定,常用作氟化剂,其与 的空间结构及相应的键角如图一所示。
的空间结构及相应的键角如图一所示。
①
 分子中中心原子的杂化方式为
分子中中心原子的杂化方式为②稳定性:

 ;键角:
;键角: <
< 的原因是
的原因是(4)三苯基磷与三苯基硼的结构简式如图二所示。下列说法正确的是___________(填字母)。

| A.均为极性分子 | B.B、P的杂化方式相同 |
| C.两种分子中所有原子均可共面 | D.三苯基磷的沸点比三苯基硼的高 |
(5)磷锗锌晶体是一种红外非线性晶体,其晶胞结构如图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,图中A点Zn原子的分数坐标为(0,0,0),B点P原子的坐标为(0.25,0.25,0.125)。

①C点P原子的坐标为
②磷锗锌晶体的化学式为
您最近一年使用:0次
【推荐1】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)单质铜及镍都是由________ 键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1958 kJ/mol、INi=1753 kJ/mol,ICu>INi的原因是_____________________ 。
(2)某镍白铜合金的立方晶胞结构如图所示。
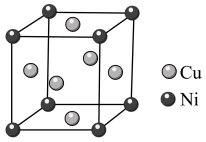
①晶胞中铜原子与镍原子的数量比为________ 。
②合金的密度为d g/cm3,晶胞参数a=________ nm。
(1)单质铜及镍都是由
(2)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为
②合金的密度为d g/cm3,晶胞参数a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E为前四周期元素,且原子序数依次增大。气体AB遇空气变红棕色,C原子内层电子数是最外层电子数的5倍,D在同周期元素中电负性最大,E的硫酸盐溶液呈蓝色。回答下列问题:
(1)A原子有________ 种能量不同的电子;D原子的M能层电子的运动状态有________ 种。
(2)元素A的第一电离能________ (填“大于”“小于”或“等于”)元素B的第一电离能;AB2-的立体构型是________ ;气体AB中含有的σ键和π键个数之比为________ 。
(3)元素C与D所形成的化合物的某种晶胞结构如图所示,则晶胞中阴离子与阳离子的个数比是________ .

(4)E基态原子的核外电子排布式为________ ,将E单质的粉末加入A的简单气态氢化物的浓溶液中,并不断鼓入空气充分反应,得到深蓝色的溶液,该反应的离子方程式是________ 。
(1)A原子有
(2)元素A的第一电离能
(3)元素C与D所形成的化合物的某种晶胞结构如图所示,则晶胞中阴离子与阳离子的个数比是

(4)E基态原子的核外电子排布式为
您最近一年使用:0次
【推荐3】已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①元素:A、___________ ,B、___________ ,C、___________ ,D、___________ ,E、___________ ,F、___________ 。
②B、C、D、E四种元素的第一电离能从大到小的顺序:___________ 。
(2)下表是A~F元素中某种元素的部分电离能,由此可判断该元素是___________ 。
(3)F元素位于周期表的___________ 区,此区元素的价电子层结构特点是___________ 。
(1)请用元素符号完成下列空白:
①元素:A、
②B、C、D、E四种元素的第一电离能从大到小的顺序:
(2)下表是A~F元素中某种元素的部分电离能,由此可判断该元素是
| 元素 | 电离能/(kJ·mol-1) | ||||
| I1 | I2 | I3 | I4 | I5 | |
| 某种元素 | 578 | 1817 | 2745 | 11575 | 14830 |
您最近一年使用:0次
【推荐1】掺杂 Ni2+的 KZnF3纳米复合玻璃陶瓷能够获得超宽带发光,成为新型发光玻璃陶瓷。KZnF3可由 K2CO3、ZnF2、NH4HF2制备。回答下列问题:
(1)N 元素在周期表中的位置___________ ,位于周期表___________ 区。
(2)Ni2+能与 NH3形成配离子[Ni(NH3)6]2+,NH3的空间构型是___________ ,与 NH3互为等电子体的阳离子是___________ 。
(3)基态 Ni 原子的外围电子排布式为___________ ;其核外电子占据的最高能层符号为___________ 。
(4)KZnF3中 K 与 Zn 属于同一周期,第一电离能 K___________ Zn(填“大于”或“小于”),原因是___________ 。
(5)如图为 KZnF3的晶胞结构示意图。 KZnF3晶胞中原子坐标参数 A 为(0,0,0); B 为(1,0,0);C 为(0,1,0),则 D 的原子坐标参数为___________ 。
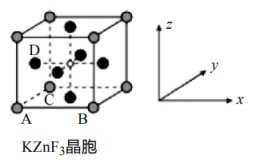
(1)N 元素在周期表中的位置
(2)Ni2+能与 NH3形成配离子[Ni(NH3)6]2+,NH3的空间构型是
(3)基态 Ni 原子的外围电子排布式为
(4)KZnF3中 K 与 Zn 属于同一周期,第一电离能 K
(5)如图为 KZnF3的晶胞结构示意图。 KZnF3晶胞中原子坐标参数 A 为(0,0,0); B 为(1,0,0);C 为(0,1,0),则 D 的原子坐标参数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物。按要求回答下列问题:
(1)铁能与CO形成配合物Fe(CO)5,其熔点为-20.50C,沸点为1020C,易溶于CCl4,据此判断Fe(CO)5晶体属于___________ (填晶体类型)。
(2)铁在元素周期表中位置是________________ ,亚铁离子具有强还原性,从电子排布的角度解释,其原因是______________________ 。
(3)南海海底蕴藏着大量的天然气水化合物,俗称“可燃冰”。可燃冰是一种晶体,晶体中平均每46个H2O分子通过氢键构成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充。可燃冰的平均组成可表示为_______________ 。
(4)亚磷酸(H3PO3与过量NaOH反应充分反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸氢二钠属于_______ 盐(填“正”、“酸式”)。
(5)金刚石晶胞结构模型如右图,立方BN结构与金刚石相似,硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键的数目比为__________ ;每个N原子周围最近且等距离的N原子数为_______ ;如果阿伏加德罗常数近似取6×1023/mol,立方BN的密度为a g·cm-3,摩尔质量为b g·mol-1,计算晶体中最近的两个N原子间距离是__________ nm(用含a、b代数式表示)。

(1)铁能与CO形成配合物Fe(CO)5,其熔点为-20.50C,沸点为1020C,易溶于CCl4,据此判断Fe(CO)5晶体属于
(2)铁在元素周期表中位置是
(3)南海海底蕴藏着大量的天然气水化合物,俗称“可燃冰”。可燃冰是一种晶体,晶体中平均每46个H2O分子通过氢键构成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充。可燃冰的平均组成可表示为
(4)亚磷酸(H3PO3与过量NaOH反应充分反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸氢二钠属于
(5)金刚石晶胞结构模型如右图,立方BN结构与金刚石相似,硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键的数目比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
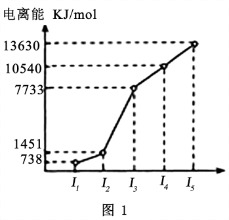
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___________ 种不同运动状态的电子。
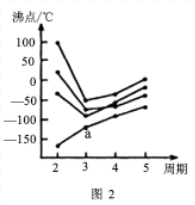
(2)如图2所示,每条折线表示周期表ⅣA ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ 。
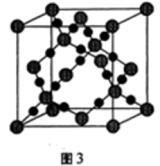
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示,则该晶体的类型属于___________ 晶体,碳原子的配位数为___________ 。
(4)第一电离能介于Al、P之间的第三周期元素有___________ 种。 中心原子的杂化方式为
中心原子的杂化方式为___________ ,写出与 结构相同的一种等电子体
结构相同的一种等电子体___________ 。
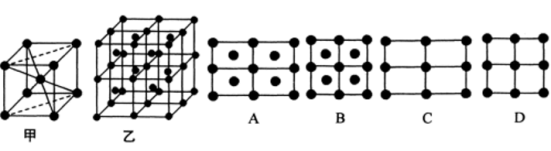
(5) 的一种晶体如图中甲、乙所示,若按甲虚线方向切乙得到的
的一种晶体如图中甲、乙所示,若按甲虚线方向切乙得到的 图中正确的是
图中正确的是___________ (填字母标号 。
。
(6)利用新制的Cu(OH)2检验醛基时,生成砖红色的Cu2O,其晶胞结构如图所示。晶胞有两个基本要素:
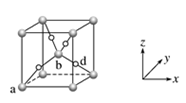
①原子坐标参数,表示晶胞内部各原子的相对位置。晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、( ,
, ,
, ),则d的坐标参数为
),则d的坐标参数为___________ ,它代表___________ 原子。
②晶胞参数,描述晶胞的大小和形状。已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值,则晶胞参数为___________ nm。
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有

(2)如图2所示,每条折线表示周期表ⅣA
 ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示,则该晶体的类型属于
(4)第一电离能介于Al、P之间的第三周期元素有
 中心原子的杂化方式为
中心原子的杂化方式为 结构相同的一种等电子体
结构相同的一种等电子体(5)
 的一种晶体如图中甲、乙所示,若按甲虚线方向切乙得到的
的一种晶体如图中甲、乙所示,若按甲虚线方向切乙得到的 图中正确的是
图中正确的是 。
。
(6)利用新制的Cu(OH)2检验醛基时,生成砖红色的Cu2O,其晶胞结构如图所示。晶胞有两个基本要素:

①原子坐标参数,表示晶胞内部各原子的相对位置。晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(
 ,
, ,
, ),则d的坐标参数为
),则d的坐标参数为②晶胞参数,描述晶胞的大小和形状。已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值,则晶胞参数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

(1)Y分别与D、E形成的化合物中熔点较高是_________ (用具体物质的化学式表示)。
(2)LX2分子的电子式是_________ ,MY3分子是_________ (填“极性分子”或“非极性分子”)。
(3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则基态J原子的核外电子排布式是_________ ; J(LR)4固态时属于_________ 晶体(填晶体类型)。
(4)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高记录。右图中所示的是该化合物的晶体结构单元。图中上,下底面中心“Δ”处的原子是_______ (填元素符号)。


(1)Y分别与D、E形成的化合物中熔点较高是
(2)LX2分子的电子式是
(3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则基态J原子的核外电子排布式是
(4)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高记录。右图中所示的是该化合物的晶体结构单元。图中上,下底面中心“Δ”处的原子是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为______________ ,其原子核外未成对电子有_____ 个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为____ 堆积(填堆积方式),其中钛原子的配位数为________ 。
(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为______ 晶体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
解释KCl晶格能小于CaO的原因_________________________ 。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________ 。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为___________ 。

晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________ 。
(1)基态钛原子的价电子排布式为

(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是
(4)钙钛矿晶体的结构如图所示。晶体的化学式为

晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰三位科学家,以表彰他们对锂离子电池的研究。
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______ ,中心原子的杂化形式为___ ,与阴离子互为等电子体的一种分子为_________
(2)Li2O是离子晶体,其晶格能可通过下图的Born-Haber循环计算得到。
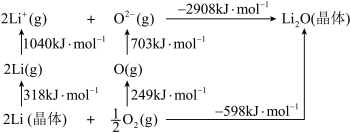
可知Li原子的第一电离能为____ kJ·mol-1,O=O键键能为_____ kJ·mol-1,Li2O晶格能为_____ kJ·mol-1
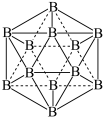
(3)硼和锂同周期,B原子核外有__ 种不同运动状态的电子。基态B原子中,能量最高的电子所占据的原子轨道的形状为____ 。晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(如下图),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由___ 个硼原子构成;若该结构单元中有2个原子为10B(其余为11B),那么该结构单元有____ 种不同类型
(4)锰的化合物也广泛应用于电池,基态锰原子的核外电子排布式为____ ,MnO的熔点(1650 ℃)比MnS的熔点(1610 ℃)高的原因是_________ ,含锰的一种磁性材料的单晶胞结构如图:
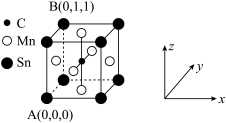
该晶胞中碳原子的原子坐标为_________
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是
(2)Li2O是离子晶体,其晶格能可通过下图的Born-Haber循环计算得到。
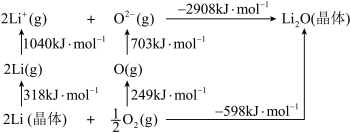
可知Li原子的第一电离能为
(3)硼和锂同周期,B原子核外有

(4)锰的化合物也广泛应用于电池,基态锰原子的核外电子排布式为

该晶胞中碳原子的原子坐标为
您最近一年使用:0次



