现有部分短周期元素的性质或原子结构如表:
(1)元素X在元素周期表中的位置为________ ,X与Q按原子个数比为1:2形成的化合物的电子式为________ 。
(2)元素Y的原子结构示意图为________ ,其与氢元素形成一种分子YH3,写出实验室制备该物质的化学方程式________ 。
(3)元素Z与元素T相比,非金属性较强的是________ (用元素符号表示),下列表述中能证明这一事实的是________ 。
a.Z离子的还原性小于T离子的还原性
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的含氧酸的酸性强于T
(4)在碱性溶液中,X的简单氢化物与Q2组成燃料电池,其负极的电极反应式为________ 。
| 元素编号 | 元素性质或原子结构 |
| Q | 地壳中含量最高的元素 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y的原子结构示意图为
(3)元素Z与元素T相比,非金属性较强的是
a.Z离子的还原性小于T离子的还原性
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的含氧酸的酸性强于T
(4)在碱性溶液中,X的简单氢化物与Q2组成燃料电池,其负极的电极反应式为
更新时间:2020/10/07 08:42:18
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】氢能是一种非常清洁的能源,氨分解制备氢气是一种技术先进和经济可行的工艺。恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下 的浓度随时间的变化如下表所示:
的浓度随时间的变化如下表所示:
回答下列问题:
(1)已知 、
、 、
、 的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则
的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则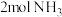 完全分解吸收的能量为
完全分解吸收的能量为_______ kJ。
(2)实验①中20~40min,
_______ 。
(3)实验③达到平衡后, 的体积分数约为
的体积分数约为_______ (保留三位有效数字)。
(4)下列能说明该反应达到平衡状态的是_______ (填序号)
a.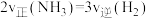 b.
b. 保持不变
保持不变
c. 保持不变 d.容器内混合气体密度保持不变
保持不变 d.容器内混合气体密度保持不变
e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是_______ (填序号)
a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
(6)有人设想以 和
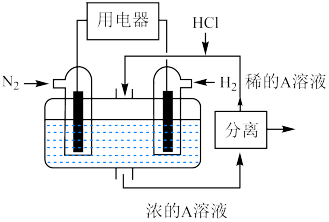
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为_______ ,A为_______ (填化学式)。
 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下 的浓度随时间的变化如下表所示:
的浓度随时间的变化如下表所示:| 编号 | 时间min 表面积/  | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
(1)已知
 、
、 、
、 的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则
的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则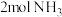 完全分解吸收的能量为
完全分解吸收的能量为(2)实验①中20~40min,

(3)实验③达到平衡后,
 的体积分数约为
的体积分数约为(4)下列能说明该反应达到平衡状态的是
a.
 b.
b. 保持不变
保持不变c.
 保持不变 d.容器内混合气体密度保持不变
保持不变 d.容器内混合气体密度保持不变e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是
a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
(6)有人设想以
 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】依据如图所示三套实验装置,分别回答下列问题。
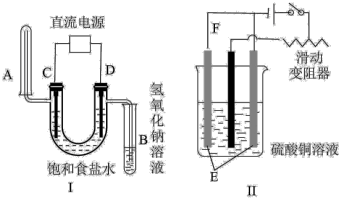
(1)装置I的实验目的是用惰性电极电解饱和食盐水,C电极连接电源的___ 极,B管吸收的气体是___ ,电解食盐水总反应的离子方程式为___ 。
(2)装置II的实验目的是在铁棒上镀铜,铁棒为___ (填“E”或“F”)。另一电极用于及时补充消耗的镀层物质,结合化学用语说明其原理:___ 。
(3)装置III利用Fe3+与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图,写出电池工作一段时间后的现象____ 。

(1)装置I的实验目的是用惰性电极电解饱和食盐水,C电极连接电源的
(2)装置II的实验目的是在铁棒上镀铜,铁棒为
(3)装置III利用Fe3+与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图,写出电池工作一段时间后的现象
| 供选择的实验用品:KCl溶液,FeCl2溶液,FeCl3溶液,CuSO4溶液,铜棒,锌棒,铁棒,石墨棒,氯化钾盐桥。 |

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。

回答下列问题:
(I)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和 ,放出225kJ热量,该反应的热化学方程式为
,放出225kJ热量,该反应的热化学方程式为________________________ 。 的电子式为
的电子式为__________________ 。
(II)将 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g)△H1>0
SiHCl3(g)+HCl(g)△H1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) △H2>0
4SiHCl3(g) △H2>0
③3SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3△H3
3SiHCl3△H3
反应③的
______ (用△H1,△H2表示)。温度升高,反应③的平衡常数K______ (填“增大”、“减小”或“不变”)。
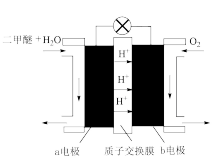
(III)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是________ 极。请写出负极的电极反应方程式:__________________

回答下列问题:
(I)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和
 ,放出225kJ热量,该反应的热化学方程式为
,放出225kJ热量,该反应的热化学方程式为 的电子式为
的电子式为(II)将
 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:①SiCl4(g)+H2(g)
 SiHCl3(g)+HCl(g)△H1>0
SiHCl3(g)+HCl(g)△H1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) △H2>0
4SiHCl3(g) △H2>0 ③3SiCl4(g)+H2(g)+Si(s)+HCl(g)
 3SiHCl3△H3
3SiHCl3△H3反应③的

(III)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】X、Y、Z、M、W、Q、R是7种短周期元素,其性质如下:
完成下列填空:
(1)上述元素中,X在周期表中的位置是__ ,由Y、Q形成的简单离子半径大小关系是Y___ Q(填“>”或“<”)。
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为___ ,是18e-分子的有__ 种。
(3)写出证明Z、M非金属性强弱的化学方程式为__ 。
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为___ 。(填选项)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
| 元素代号 | X | Y | Z | M | W | Q | R |
| 原子半径/nm | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | ||
| 主要化合价 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | ||
| 其它 | 焰色为黄色 | 形成气体单质密度最小 |
(1)上述元素中,X在周期表中的位置是
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为
(3)写出证明Z、M非金属性强弱的化学方程式为
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】元素周期表揭示了元素间的内在联系,使元素构成了一个较为系统的体系。下图为人们在研究元素间关系的过程中构建的一种表现形式,请你根据图中信息回答下列问题:
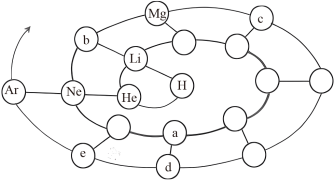
(1)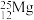 中含有的中子数为
中含有的中子数为_______ 。
(2)元素e的名称为_______ 。
(3)元素a和元素b的原子半径较大的为_______ (填元素符号)。
(4)元素a、d分别形成的简单氢化物中,稳定性较强的为_______ (填氢化物的化学式)。化合物 中化学键类型为
中化学键类型为_______ 。
(5)c单质与元素b的最高价氧化物对应的水化物的溶液反应的化学方程式为_______ 。

(1)
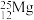 中含有的中子数为
中含有的中子数为(2)元素e的名称为
(3)元素a和元素b的原子半径较大的为
(4)元素a、d分别形成的简单氢化物中,稳定性较强的为
 中化学键类型为
中化学键类型为(5)c单质与元素b的最高价氧化物对应的水化物的溶液反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐3】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M层电子数的三倍。回答下列问题:
(1)Y元素在元素周期表中的位置为_______ 。X、Y、W三种元素原子半径由大到小的顺序为_______ (用元素符号表示)。
(2)X、Q可形成一种化合物,该化合物中两元素最外层均满足8电子稳定结构,写出该化合物的电子式:_______ 。
(3)X、W、Q的最高价氧化物对应水化物的酸性由强到弱的顺序为_______ (用化学式表示)。
(4)写出工业制取Z的化学方程式:_______ 。
(5)W、Q形成的一种化合物可以发生水解反应,并且水解生成一种最高价含氧酸和一种无氧酸,写出该水解反应的化学方程式:_______ 。
| X | Y | |||
| Z | W | Q |
(2)X、Q可形成一种化合物,该化合物中两元素最外层均满足8电子稳定结构,写出该化合物的电子式:
(3)X、W、Q的最高价氧化物对应水化物的酸性由强到弱的顺序为
(4)写出工业制取Z的化学方程式:
(5)W、Q形成的一种化合物可以发生水解反应,并且水解生成一种最高价含氧酸和一种无氧酸,写出该水解反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐1】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)在这些元素中,化学性质最不活泼的是:________ (填具体元素符号,下同),其原子结构示意图为_________ 。元素K名称为_______ 在周期表中的位置______ 。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是:_______ 。
(3)某元素二价阳离子的核外有10个电子,该元素是______ (填元素名称)。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序_________ 。
(5)F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序_________ 。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是_________ 。
(7)元素I的氢化物的结构式为________ ;该氢化物常温下和元素K的单质反应的化学方程式为__________ 。
(除特别注明外,其它一律用化学式表示)

(1)在这些元素中,化学性质最不活泼的是:
(2)最高价氧化物水化物中碱性最强的化合物的电子式是:
(3)某元素二价阳离子的核外有10个电子,该元素是
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序
(5)F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是
(7)元素I的氢化物的结构式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐2】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A___________ ,B___________ ,C___________ ,D___________ ,E___________
(2)写出A与B、B与E两元素最高价氧化物的水化物之间反应的离子方程式:
A与B:___________
B与E:___________
(3)比较C、D的最高价氧化物的水化物的酸性:___________ (用化学式表示)。
(1)写出下列元素符号:A
(2)写出A与B、B与E两元素最高价氧化物的水化物之间反应的离子方程式:
A与B:
B与E:
(3)比较C、D的最高价氧化物的水化物的酸性:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】有7种短周期元素,其原子半径及主要化合价如下:完成下列填空:
(1)A在元素周期表中的位置是_______ ,当配制150mL实验所需的0.1 mol∙L−1 A最高价氧化物的水合物的溶液,用到的玻璃仪器有_______ ,下列操作可能造成此次配制溶液浓度偏低的有_______ 。
A.用蒸馏水洗净容量瓶未干燥,直接配制新溶液
B.量筒未干燥
C.溶解后将溶液未冷却直接进行后续操作
D.溶解后洗涤烧杯和玻璃棒的洗涤液未全部转移至容量瓶中
E.定容时俯视液面
F.定容时不小心加蒸馏水超过刻度线,用胶头滴管迅速吸出多余的水
(2)上述7种元素形成的简单离子中,离子半径最大是_______ (用离子符号表示)
(3)写出B单质与烧碱溶液反应的离子方程式,并用单线桥法表示出电子转移_______ 。
(4)甲是由G、H两种元素组成的18e-分子,甲中滴入E单质的水溶液,有无色气体产生,写出反应离子方程式:_______ 。
(5)用一个化学方程式表示E元素的非金属性比D强_______ 。
| 元素代号 | A | B | D | E | F | G | H |
| 原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
| 主要化合价 | +1 | +3 | +6,−2 | +7,−1 | +5,−3 | −2 | +1 |
A.用蒸馏水洗净容量瓶未干燥,直接配制新溶液
B.量筒未干燥
C.溶解后将溶液未冷却直接进行后续操作
D.溶解后洗涤烧杯和玻璃棒的洗涤液未全部转移至容量瓶中
E.定容时俯视液面
F.定容时不小心加蒸馏水超过刻度线,用胶头滴管迅速吸出多余的水
(2)上述7种元素形成的简单离子中,离子半径最大是
(3)写出B单质与烧碱溶液反应的离子方程式,并用单线桥法表示出电子转移
(4)甲是由G、H两种元素组成的18e-分子,甲中滴入E单质的水溶液,有无色气体产生,写出反应离子方程式:
(5)用一个化学方程式表示E元素的非金属性比D强
您最近一年使用:0次



