(1)对反应③进行配平,用单线桥法分析反应④的电子转移的方向和数目。_____
①MnO2+H2O2+H2SO4=MnSO4+O2+2H2O
②2H2O2=2H2O+O2
③MnO +SO
+SO +H+ =SO
+H+ =SO +Mn2++H2O
+Mn2++H2O
④ 2MnO +SO
+SO +2OH-=SO
+2OH-=SO +2MnO
+2MnO +2H2O
+2H2O
(2)分析以下 3 个化学方程式,找出相应物质,将它们的化学式填入表格中
⑤NaClO+2HCl=Cl2+NaCl+H2O
⑥Cl2+2NaOH(稀)=NaClO+NaCl+H2O
⑦3Cl2+6NaOH(浓) NaClO3+5NaCl+3H2O
NaClO3+5NaCl+3H2O
(3)对比上述 7 个方程式,可以得出一些结论,填写表格空处:
①MnO2+H2O2+H2SO4=MnSO4+O2+2H2O
②2H2O2=2H2O+O2
③MnO
 +SO
+SO +H+ =SO
+H+ =SO +Mn2++H2O
+Mn2++H2O④ 2MnO
 +SO
+SO +2OH-=SO
+2OH-=SO +2MnO
+2MnO +2H2O
+2H2O(2)分析以下 3 个化学方程式,找出相应物质,将它们的化学式填入表格中
⑤NaClO+2HCl=Cl2+NaCl+H2O
⑥Cl2+2NaOH(稀)=NaClO+NaCl+H2O
⑦3Cl2+6NaOH(浓)
 NaClO3+5NaCl+3H2O
NaClO3+5NaCl+3H2O| 反应序号 | 氧化剂 | 还原剂 | 氧化产物 | 还原产物 |
| ⑤ | Cl2 | Cl2 | ||
| ⑥ | Cl2 | Cl2 |
| 对比方程式组 | 结论 |
| 相同的氧化剂,还原剂,在不同的酸碱性环境下反应,可能得到不同的产物 | |
| ⑥⑦ | 相同的氧化剂,还原剂, |
| 在不同的酸碱性环境下,氧化还原反应方向可能不同 |
20-21高二上·浙江宁波·阶段练习 查看更多[3]
浙江省余姚中学2020-2021学年高二上学期10月质量检测化学试题浙江省宁波市余姚中学2020-2021学年高一上学期10月质量检测化学试题(已下线)第一章 物质及其变化(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
更新时间:2020-10-24 22:21:56
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】镁与稀硝酸的反应为:4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
(1)用“双线桥法”表示该反应中电子转移的方向和数目__________ 。
(2)该反应中,Mg发生了__________ 反应,氧化剂与还原剂的物质的量之比为__________________ 。
(3)还原产物是_________ ,HNO3表现了__________________ 。
(4)若反应过程中转移的电子数为1.505×1023,则参加反应的Mg的质量为________ 。
(1)用“双线桥法”表示该反应中电子转移的方向和数目
(2)该反应中,Mg发生了
(3)还原产物是
(4)若反应过程中转移的电子数为1.505×1023,则参加反应的Mg的质量为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
I.氯气常用于自来水的杀菌消毒,但用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效安全的消毒剂。
工业上制备 的反应为:
的反应为: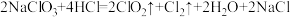 。
。
(1)该反应中的还原产物是___________ (写化学式),反应中每生成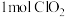 分子,转移电子的数目为
分子,转移电子的数目为___________ 。
(2) 在杀菌消毒后转化为
在杀菌消毒后转化为 ,可能会生成副产物亚氯酸盐(
,可能会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是________ (填序号)。
A. B.
B. C.
C.
(3)含氰废水中的 有剧毒。在碱性环境下
有剧毒。在碱性环境下 能被
能被 氧化成
氧化成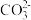 和
和 ,该反应氧化产物与还原产物物质的量之比为
,该反应氧化产物与还原产物物质的量之比为___________ 。
Ⅱ.高铁酸钾( )是一种新型绿色消毒剂,其在消毒后可形成胶体,可用于处理饮用水。
)是一种新型绿色消毒剂,其在消毒后可形成胶体,可用于处理饮用水。
(4) 胶体具有良好的净水效果,其分散质微粒大小范围为
胶体具有良好的净水效果,其分散质微粒大小范围为___________ ,其净水原理是胶体粒子具有___________ 性。
(5)工业上有干法与湿法两种制备高铁酸钾( )的方法。
)的方法。
①干法制备高铁酸钾时,一般先制备得到 ,当制
,当制 发生如下反应:
发生如下反应: ,该反应每生成
,该反应每生成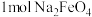 转移
转移___________  电子。
电子。
②湿法制备高铁酸钾的反应体系中主要有以下几种微粒: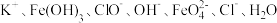 ,写出并配平湿法制高铁酸钾的离子反应方程式
,写出并配平湿法制高铁酸钾的离子反应方程式___________ 。
I.氯气常用于自来水的杀菌消毒,但用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效安全的消毒剂。
工业上制备
 的反应为:
的反应为: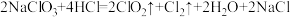 。
。(1)该反应中的还原产物是
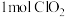 分子,转移电子的数目为
分子,转移电子的数目为(2)
 在杀菌消毒后转化为
在杀菌消毒后转化为 ,可能会生成副产物亚氯酸盐(
,可能会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.
C.
(3)含氰废水中的
 有剧毒。在碱性环境下
有剧毒。在碱性环境下 能被
能被 氧化成
氧化成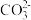 和
和 ,该反应氧化产物与还原产物物质的量之比为
,该反应氧化产物与还原产物物质的量之比为Ⅱ.高铁酸钾(
 )是一种新型绿色消毒剂,其在消毒后可形成胶体,可用于处理饮用水。
)是一种新型绿色消毒剂,其在消毒后可形成胶体,可用于处理饮用水。(4)
 胶体具有良好的净水效果,其分散质微粒大小范围为
胶体具有良好的净水效果,其分散质微粒大小范围为(5)工业上有干法与湿法两种制备高铁酸钾(
 )的方法。
)的方法。①干法制备高铁酸钾时,一般先制备得到
 ,当制
,当制 发生如下反应:
发生如下反应: ,该反应每生成
,该反应每生成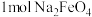 转移
转移 电子。
电子。②湿法制备高铁酸钾的反应体系中主要有以下几种微粒:
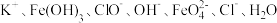 ,写出并配平湿法制高铁酸钾的离子反应方程式
,写出并配平湿法制高铁酸钾的离子反应方程式
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。
⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式________ ,反应中的还原剂是___ ,每摩NaBH4反应时电子转移数为______ mol。
⑵NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:BH4-+Au3++OH-→Au+BO2-+H2O,请写出配平的离子方程式____________________________ 。
⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式
⑵NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:BH4-+Au3++OH-→Au+BO2-+H2O,请写出配平的离子方程式
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】回答下列问题:
(1)下列每组物质中都有一种物质与其他物质在分类上不同,试分析每组物质的组成和性质规律,将这种不同于其他物质的物质找出来。
①AgCl、BaSO4、CaCO3、KCl:___________ ,
②H3PO4、HNO3、H2SO4、HCl:___________ (按酸性强弱分析),
③CuSO4、FeCl3、KMnO4、K2CO3:___________ ,
④空气、N2、HCl、CuSO4·5H2O:___________ ,
(2)实验室制取氯气的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
请分别用双线桥法和单线桥法分析该反应中电子转移的方向和数目:
双线桥:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。___________ 。
单线桥:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。___________ 。
(1)下列每组物质中都有一种物质与其他物质在分类上不同,试分析每组物质的组成和性质规律,将这种不同于其他物质的物质找出来。
①AgCl、BaSO4、CaCO3、KCl:
②H3PO4、HNO3、H2SO4、HCl:
③CuSO4、FeCl3、KMnO4、K2CO3:
④空气、N2、HCl、CuSO4·5H2O:
(2)实验室制取氯气的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。请分别用双线桥法和单线桥法分析该反应中电子转移的方向和数目:
双线桥:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。单线桥:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】①SO3+H2O=H2SO4 ②Cl2+H2O=HCl+HClO③2F2+2H2O=4HF+O2 ④2K+2H2O=2KOH+H2↑⑤CO2+2NaOH=Na2CO3+H2O
(1)上述反应中不属于氧化还原反应的有_____________________ (填序号,下同);
(2)H2O只做氧化剂的是________________ ,H2O只做还原剂的是__________ ;
(3)根据所学,写出一个H2O既做氧化剂,又做还原剂的化学反应方程式_______ 。
(4)④的离子方程式为____________________________ 。
(5)请用单线桥表示出反应③的电子转移方向和数目__________________ 。
(1)上述反应中不属于氧化还原反应的有
(2)H2O只做氧化剂的是
(3)根据所学,写出一个H2O既做氧化剂,又做还原剂的化学反应方程式
(4)④的离子方程式为
(5)请用单线桥表示出反应③的电子转移方向和数目
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】根据题干信息,按要求回答问题:
(1)钠与氢气在加热条件下反应生成氢化钠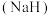 ,
, 在熔融状态下能导电。取少量氢化钠溶于水剧烈反应,生成碱性溶液和一种可燃性气体。写出钠与氢气反应的化学方程式
在熔融状态下能导电。取少量氢化钠溶于水剧烈反应,生成碱性溶液和一种可燃性气体。写出钠与氢气反应的化学方程式__________ 。写出 与
与 的反应的化学方程式
的反应的化学方程式___________ 。反应中 作
作__________ 剂。
(2)从元素化合价角度分析 的性质
的性质
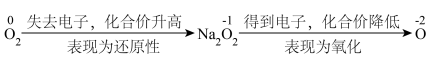
① 吸收
吸收 气体,生成
气体,生成 ,其化学方程式为
,其化学方程式为__________ 。
②在酸性高锰酸钾溶液中加入适量 粉末,溶液褪色,并产生无色气体,
粉末,溶液褪色,并产生无色气体, 表现出
表现出__________ 性,氧化产物是__________ 。
(1)钠与氢气在加热条件下反应生成氢化钠
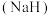 ,
, 在熔融状态下能导电。取少量氢化钠溶于水剧烈反应,生成碱性溶液和一种可燃性气体。写出钠与氢气反应的化学方程式
在熔融状态下能导电。取少量氢化钠溶于水剧烈反应,生成碱性溶液和一种可燃性气体。写出钠与氢气反应的化学方程式 与
与 的反应的化学方程式
的反应的化学方程式 作
作(2)从元素化合价角度分析
 的性质
的性质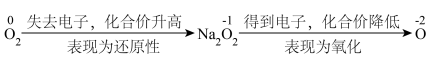
①
 吸收
吸收 气体,生成
气体,生成 ,其化学方程式为
,其化学方程式为②在酸性高锰酸钾溶液中加入适量
 粉末,溶液褪色,并产生无色气体,
粉末,溶液褪色,并产生无色气体, 表现出
表现出
您最近一年使用:0次

 )是一种黄绿色气体,在水处理等方面有广泛应用的高效安全消毒剂。
)是一种黄绿色气体,在水处理等方面有广泛应用的高效安全消毒剂。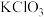 与
与 在
在 存在下制得
存在下制得



