如下图所示是中学化学中常用于混合物分离和提纯的装置,请根据装置回答问题:
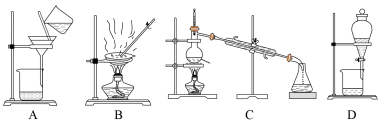
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是__________ ,装置B中玻璃棒的作用是__________ 。
(2)装置C中仪器①的名称是__________ ,冷却水的方向是__________ 。装置D在分液时为使液体顺利滴下,应进行的具体操作是____________________ 。
(3)从氯化钠溶液中得到氯化钠固体,选择装置__________ (填代表装置图的字母,下同);除去自来水中的 等杂质,选择装置
等杂质,选择装置__________ ;从碘水中分离出 ,选择装置
,选择装置__________ ,该分离方法的名称是__________ 。

(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是
(2)装置C中仪器①的名称是
(3)从氯化钠溶液中得到氯化钠固体,选择装置
 等杂质,选择装置
等杂质,选择装置 ,选择装置
,选择装置
更新时间:2020-10-08 18:25:31
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】氰化钠(NaCN)是一种基本化工原料,同时也是一种有毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠( )溶液来处理,以轻其对环境的污染。
)溶液来处理,以轻其对环境的污染。
工业制备过硫酸钠的反应原理如下所示
主反应:
副反应:
某化学小组利用上述原理制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如图所示装置制备 。
。

(1)装置中盛放 溶液的仪器的名称是
溶液的仪器的名称是___________ 。
(2)检查装置a气密性的方法:用止水夹夹住a、b之间的橡皮管,向分液漏斗中加水,___________ ,证明装置a气密性良好。
(3)装置a中反应产生的气体需要持续通入装置c的原因是___________ 。
(4)上述装置中还需补充的实验仪器或装置有___________(填字母代号)。
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知;①废水中氰化钠的最高排放标准为0.5mg/L
② ,
, ,AgI呈黄色,
,AgI呈黄色, 优先与
优先与 发生反应。
发生反应。
实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用 的标准
的标准 溶液滴定,消耗
溶液滴定,消耗 溶液的体积为5.00mL。
溶液的体积为5.00mL。
(5)滴定终点的现象是___________ 。
(6)处理后的废水中氰化钠的含量为___________ mg/L。
(7)NaCN用30%的双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是___________ 。
 )溶液来处理,以轻其对环境的污染。
)溶液来处理,以轻其对环境的污染。工业制备过硫酸钠的反应原理如下所示
主反应:

副反应:

某化学小组利用上述原理制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如图所示装置制备
 。
。
(1)装置中盛放
 溶液的仪器的名称是
溶液的仪器的名称是(2)检查装置a气密性的方法:用止水夹夹住a、b之间的橡皮管,向分液漏斗中加水,
(3)装置a中反应产生的气体需要持续通入装置c的原因是
(4)上述装置中还需补充的实验仪器或装置有___________(填字母代号)。
| A.温度计 | B.水浴加热装置 | C.洗气瓶 | D.环形玻璃搅拌棒 |
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知;①废水中氰化钠的最高排放标准为0.5mg/L
②
 ,
, ,AgI呈黄色,
,AgI呈黄色, 优先与
优先与 发生反应。
发生反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用
 的标准
的标准 溶液滴定,消耗
溶液滴定,消耗 溶液的体积为5.00mL。
溶液的体积为5.00mL。(5)滴定终点的现象是
(6)处理后的废水中氰化钠的含量为
(7)NaCN用30%的双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图。

已知:
25℃时,相关物质的Ksp见表。
②氢氧化氧锰(MnOOH)难溶于水和碱性解液。
(1)MnOOH中Mn的化合价为____ 价。
(2)向“沉淀池Ⅰ”中加入MnO2,MnO2的作用是____ ;“滤渣2”的主要成分是____ (填化学式)。
(3)MnSO4转化为MnOOH的离子方程式为____ 。
(4)MnSO4转化为MnOOH中“Ⅲ.实验操作”包含过滤、洗涤、干燥。
①过滤时,需要用到的玻璃仪器有____ 。
②检验MnOOH是否洗涤干净,具体操作为____ 。
(5)高纯度的MnOOH转化为Mn2O3的化学方程式为____ 。
(6)在“沉淀池Ⅰ”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为____ (当溶液中某离子浓度c≤1.0×10-5mol·L-1时。可认为该离子沉淀完全)。

已知:
25℃时,相关物质的Ksp见表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
②氢氧化氧锰(MnOOH)难溶于水和碱性解液。
(1)MnOOH中Mn的化合价为
(2)向“沉淀池Ⅰ”中加入MnO2,MnO2的作用是
(3)MnSO4转化为MnOOH的离子方程式为
(4)MnSO4转化为MnOOH中“Ⅲ.实验操作”包含过滤、洗涤、干燥。
①过滤时,需要用到的玻璃仪器有
②检验MnOOH是否洗涤干净,具体操作为
(5)高纯度的MnOOH转化为Mn2O3的化学方程式为
(6)在“沉淀池Ⅰ”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
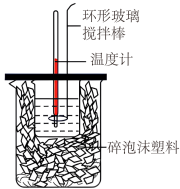
(1)环形玻璃搅拌棒_____ (填能或不能)改为环形金属棒。其原因是________ 。
(2)大烧杯内填满碎泡沫塑料的作用______ 。
(3)实验中将氢氧化钠溶液分多次加入盐酸中,对求得中和热数值的影响是________ (偏高或偏低或无影响)。
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放出的热量_______ (增加、减少或不变),所求中和热数值____ (增加、 减少或 不变)。

(1)环形玻璃搅拌棒
(2)大烧杯内填满碎泡沫塑料的作用
(3)实验中将氢氧化钠溶液分多次加入盐酸中,对求得中和热数值的影响是
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放出的热量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】观察下列实验装置图,试回答下列问题:
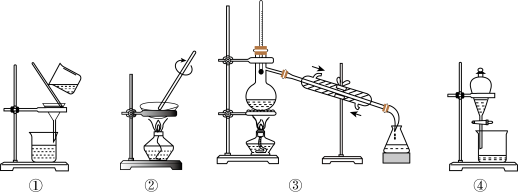
(1)写出图中③实验操作的名称是______
(2)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______ ; b.分离氯化钠和水:______ ;
c.分离碳酸钙和水:______ ; d.分离植物油和水:______ ;
(3)装置②中玻璃棒搅拌的目的是_________________________ 。

(1)写出图中③实验操作的名称是
(2)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:
c.分离碳酸钙和水:
(3)装置②中玻璃棒搅拌的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
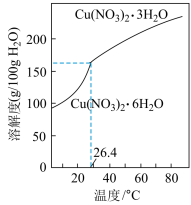
【推荐2】工业上由含铜废料(含有Cu、CuS、 等)制备硝酸铜晶体的流程如下:
等)制备硝酸铜晶体的流程如下:
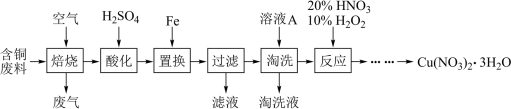
(1)“焙烧”在600℃时进行,写出CuS转化为CuO和 的化学方程式:
的化学方程式:______________ 。
(2)写出“酸化”时发生的离子反应方程式_______ 。
(3)“淘洗”所用的溶液A可以是_______(填字母)。
(4)“反应”这一步所用的试剂是20% 和10%
和10% ,反应过程中无红棕色气体生成,该反应的化学方程式:
,反应过程中无红棕色气体生成,该反应的化学方程式:__________________________________________ 。
(5)根据题图分析从“反应”所得溶液中析出 的方法是
的方法是_____________________ 。
 等)制备硝酸铜晶体的流程如下:
等)制备硝酸铜晶体的流程如下:
(1)“焙烧”在600℃时进行,写出CuS转化为CuO和
 的化学方程式:
的化学方程式:(2)写出“酸化”时发生的离子反应方程式
(3)“淘洗”所用的溶液A可以是_______(填字母)。
| A.稀硫酸 | B.浓硫酸 | C.稀硝酸 | D.浓硝酸 |
 和10%
和10% ,反应过程中无红棕色气体生成,该反应的化学方程式:
,反应过程中无红棕色气体生成,该反应的化学方程式:(5)根据题图分析从“反应”所得溶液中析出
 的方法是
的方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】已知硝酸银与氯化钾反应生成硝酸钾和不溶于水的氯化银,化学方程式为AgNO3+KCl=AgCl↓+KNO3。将含有少量氯化钾 的硝酸钾固体提纯,某学生如图所示的实验操作。回答下列问题:
的硝酸钾固体提纯,某学生如图所示的实验操作。回答下列问题:

(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是___________ 。
(2)向溶液中加入适量的________ 溶液,使氯化钾转化为沉淀。
(3)将混合液进行过滤,过滤装置和操作如图所示,指出图中的两处错误:①__________________ ;②______________________ 。
(4)为了从液体中得到硝酸钾晶体,可选用的两种结晶方法是:①__________________________ ;②______________________ 。
 的硝酸钾固体提纯,某学生如图所示的实验操作。回答下列问题:
的硝酸钾固体提纯,某学生如图所示的实验操作。回答下列问题:
(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是
(2)向溶液中加入适量的
(3)将混合液进行过滤,过滤装置和操作如图所示,指出图中的两处错误:①
(4)为了从液体中得到硝酸钾晶体,可选用的两种结晶方法是:①
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Ⅰ.下图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:
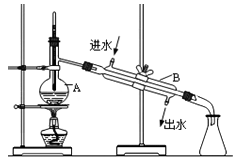
(1)装置中仪器A的名称是___________ ,仪器B 的名称是_____________ 。
(2)请指出上图中的三处明显错误中的两处:__________ 、__________ 。
Ⅱ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.蒸馏 B.过滤 C.结晶 D.分液
(1)分离水和煤油的混合物__________ 。
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾__________ 。
(3)从加热氯酸钾制氧气后的剩余固体中获得MnO2。溶解、__________ 。
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物____________ 。

(1)装置中仪器A的名称是
(2)请指出上图中的三处明显错误中的两处:
Ⅱ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.蒸馏 B.过滤 C.结晶 D.分液
(1)分离水和煤油的混合物
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾
(3)从加热氯酸钾制氧气后的剩余固体中获得MnO2。溶解、
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】苯乙酮既可用于制香皂和香烟,也可用作纤维素脂和树脂等的溶剂。实验室以苯和乙酐为原料制备苯乙酮: ,制备过程中还有
,制备过程中还有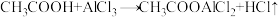 等副反应发生,实验装置见下图,相关物质的沸点见下表。
等副反应发生,实验装置见下图,相关物质的沸点见下表。
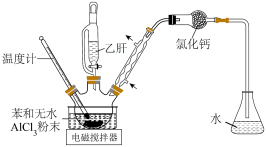
实验步骤如下:
步骤1:在三颈烧瓶中按一定配比将苯和研碎的无水氯化铝粉末充分混合后,在搅拌下缓慢滴加乙酐。乙酐滴加完后,升温至70~80℃,保温反应一段时间,冷却。
步骤2:冷却后将反应物倒入含盐酸的冰水中,然后分出苯层。苯层依次用水、5%氢氧化钠溶液和水洗涤。
步骤3:向洗涤后的有机相中加入适量无水MgSO4固体,放置一段时间后进行分离。
步骤4:常压蒸馏有机相,且收集相应馏分。
回答下列问题:
(1)步骤1中乙酐滴加完后,升温至70~80℃的目的是___________ 。
(2)步骤2中用5%氢氧化钠溶液洗涤的目的是洗去___________ 。
(3)步骤3中加入无水MgSO4固体后分离操作的名称是___________ 。
(4)装置中盛CaCl2干燥管的作用是___________ ,锥形瓶中的导管不插入液面以下的原因是___________ 。
(5)蒸馏有机相,为得到产品应收集温度为___________ 馏分。
 ,制备过程中还有
,制备过程中还有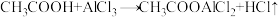 等副反应发生,实验装置见下图,相关物质的沸点见下表。
等副反应发生,实验装置见下图,相关物质的沸点见下表。
| 物质 | 苯 | 苯乙酮 | 乙酸 | 乙酐 |
| 沸点/℃ | 80.1 | 202 | 117.9 | 139.8 |
步骤1:在三颈烧瓶中按一定配比将苯和研碎的无水氯化铝粉末充分混合后,在搅拌下缓慢滴加乙酐。乙酐滴加完后,升温至70~80℃,保温反应一段时间,冷却。
步骤2:冷却后将反应物倒入含盐酸的冰水中,然后分出苯层。苯层依次用水、5%氢氧化钠溶液和水洗涤。
步骤3:向洗涤后的有机相中加入适量无水MgSO4固体,放置一段时间后进行分离。
步骤4:常压蒸馏有机相,且收集相应馏分。
回答下列问题:
(1)步骤1中乙酐滴加完后,升温至70~80℃的目的是
(2)步骤2中用5%氢氧化钠溶液洗涤的目的是洗去
(3)步骤3中加入无水MgSO4固体后分离操作的名称是
(4)装置中盛CaCl2干燥管的作用是
(5)蒸馏有机相,为得到产品应收集温度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】我国青蒿素专家屠呦呦获得2016年度国家科学技术奖最高奖。青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35 ℃。从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

(1)操作I需要的玻璃仪器主要有:烧杯、________ 。
(2)在操作Ⅱ的蒸馏操作中,仪器选择及安装都正确的是________ (填标号)。

(3)操作Ⅲ的主要过程可能是________ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶 B.加95%的乙醇,浓缩、结晶、过滤 C.加入乙醚进行萃取分液
(4)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2 g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置A、E、F中盛放的物质分别是________ 、________ 、________ 。
a.浓硫酸 b.无水硫酸铜 c.无水CaCl2 d.碱石灰 e.NaOH溶液
②G的作用是________ 。
③测得青蒿素的最简式(即:实验式)是________ 。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与________(填字母)具有相同的性质。

(1)操作I需要的玻璃仪器主要有:烧杯、
(2)在操作Ⅱ的蒸馏操作中,仪器选择及安装都正确的是

(3)操作Ⅲ的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结晶 B.加95%的乙醇,浓缩、结晶、过滤 C.加入乙醚进行萃取分液
(4)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2 g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置A、E、F中盛放的物质分别是
a.浓硫酸 b.无水硫酸铜 c.无水CaCl2 d.碱石灰 e.NaOH溶液
②G的作用是
③测得青蒿素的最简式(即:实验式)是
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
| A.乙醇 | B.乙酸 | C.乙酸乙酯 | D.葡萄糖 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】从海带中提取碘,有以下甲、乙两种实验方案如下:
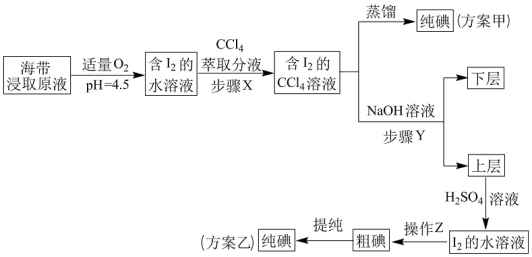
已知:3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O。请回答:
(1)步骤X为萃取分液,分液时需要用到分液漏斗,分液漏斗在使用前需要___________ 。
(2)方案甲进行蒸馏操作时,通常需要水浴加热,其优点是___________ 。
(3)方案乙在上层溶液中加入硫酸得到I2的水溶液,发生反应的离子方程式___________ 。
(4)操作Z的名称是___________ 。

已知:3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O。请回答:
(1)步骤X为萃取分液,分液时需要用到分液漏斗,分液漏斗在使用前需要
(2)方案甲进行蒸馏操作时,通常需要水浴加热,其优点是
(3)方案乙在上层溶液中加入硫酸得到I2的水溶液,发生反应的离子方程式
(4)操作Z的名称是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】从海水中提取食盐和溴的过程如下:

(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用_______ 的办法除去其中的泥沙等不溶物。
(2)①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为_______ 。
(3)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的_______。
(4)步骤Ⅱ用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为____
(5)下图是实验室传统蒸馏装置,回答下列问题。
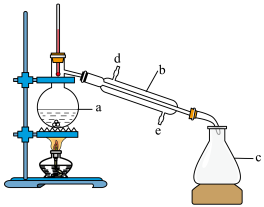
指出图中a、b、c三种仪器的名称:a_______ 、b_______ 、c_______ ;实验中在a仪器中应加入几片碎瓷片,其作用是_______ ;冷却水从_______ 端进入。

(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用
(2)①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为
(3)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的_______。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(5)下图是实验室传统蒸馏装置,回答下列问题。

指出图中a、b、c三种仪器的名称:a
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带 为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中), 得到海带灰悬浊液,然后按以下实验流程提取单质碘:
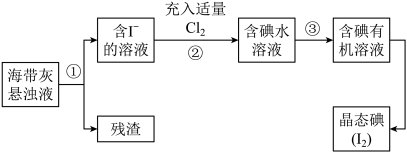
(1)指出提取碘的过程中有关的实验操作名称:①_______ ,③_______ 。
(2)操作③中所用的有机试剂可以是________ (填序号)A.四氯化碳 B.乙醇,简述选择其理由________ 。
(3)操作过程③可以分解为如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液;
B.把50mL碘水和15mL 有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.静置、分层。
F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
G.旋开活塞,用烧杯接收下层溶液;
H.从分液漏斗上口倒出上层液体;
①上述F步操作的目的是:____ ;
②最后碘的有机溶液是通过_____ 获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出其错误之处并加以改正_____ 。
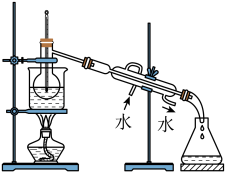
(5)进行上述蒸馏操作时,使用水浴的原因是_______ ,最后晶态碘在________ 里聚集。

(1)指出提取碘的过程中有关的实验操作名称:①
(2)操作③中所用的有机试剂可以是
(3)操作过程③可以分解为如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液;
B.把50mL碘水和15mL 有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.静置、分层。
F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
G.旋开活塞,用烧杯接收下层溶液;
H.从分液漏斗上口倒出上层液体;
①上述F步操作的目的是:
②最后碘的有机溶液是通过
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出其错误之处并加以改正

(5)进行上述蒸馏操作时,使用水浴的原因是
您最近一年使用:0次



