工业上H2O2是一种重要的绿色氧化还原试剂,某小组对H2O2的催化分解实验进行探究。回答下列问题:
(1)在同浓度Fe3+的催化下,探究外界条件对H2O2分解反应速率的影响。实验装置如图所示:
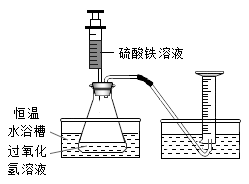
①H2O2溶液在Fe3+催化下分解的反应历程如下:
第一步反应历程为:2Fe3+ + H2O2 = 2Fe2+ +O2 +2H+
第二步反应历程为:________ ;
除了图中所示仪器之外,该实验还必需的仪器是________ 。
②请完成下面表格中I、II、III的实验记录内容或数据:
V1=________ ,V2=________ ;根据所学的知识判断,当三个实验中均产生10ml气体时,所需反应时间最长的是___________ (填“t1”、“t2”或“t3”)
(2)该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。

①由图中信息可知________ 法制取得到的催化剂活性更高。
②推测Co2+、Ni2+两种离子中催化效果更好的是________ 。
(1)在同浓度Fe3+的催化下,探究外界条件对H2O2分解反应速率的影响。实验装置如图所示:

①H2O2溶液在Fe3+催化下分解的反应历程如下:
第一步反应历程为:2Fe3+ + H2O2 = 2Fe2+ +O2 +2H+
第二步反应历程为:
除了图中所示仪器之外,该实验还必需的仪器是
②请完成下面表格中I、II、III的实验记录内容或数据:
| 实验编号 | 0.1mol•L﹣1Fe2(SO4)3 | 0.1mol•L﹣1H2O2溶液 | 蒸馏水(mL) | 反应温度/℃ | 反应时间(秒) |
| Ⅰ | 2mL | 20mL | 0 | 20 | t1 |
| Ⅱ | 2mL | V1mL | 2mL | 20 | t2 |
| Ⅲ | V2 mL | 20mL | 0 | 50 | t3 |
(2)该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。

①由图中信息可知
②推测Co2+、Ni2+两种离子中催化效果更好的是
更新时间:2020-11-16 19:32:09
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
(1)写出高锰酸钾与草酸反应的离子方程式:_______ 。
(2)由实验Ⅰ、Ⅱ可得出的结论是_______ 。
(3)关于实验Ⅱ中3 min后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验Ⅲ,验证猜想。
提供的试剂:0.01 mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
补全实验Ⅲ的操作:向试管中先加入1 mL0.01 mol/L酸性KMnO4溶液,再加10滴3mol/L硫酸,_______ ,最后加入1 mL0.1 mol/L草酸溶液。
(4)该小组拟采用如下图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。经测定乙试管溶液褪色的时间比甲试管长,得出结论:浓度越大,反应速率越慢。你认为他们的实验方案_______ (填“合理”或“不合理”),理由是_______ 。

| 编号 | 实验操作 | 实验现象 |
| Ⅰ | 向一支试管中先加入1 mL0.01 mol/L酸性KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色 |
| Ⅱ | 向另一支试管中先加入1 mL0.01 mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入1 mL0.1 mol/L草酸溶液 | 1 min内溶液紫色无明显变化,后颜色迅速变浅,约3 min后几乎变为无色 |
(2)由实验Ⅰ、Ⅱ可得出的结论是
(3)关于实验Ⅱ中3 min后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验Ⅲ,验证猜想。
提供的试剂:0.01 mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
补全实验Ⅲ的操作:向试管中先加入1 mL0.01 mol/L酸性KMnO4溶液,再加10滴3mol/L硫酸,
(4)该小组拟采用如下图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。经测定乙试管溶液褪色的时间比甲试管长,得出结论:浓度越大,反应速率越慢。你认为他们的实验方案

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。该反应的化学方程式为:H2O2+S2O +2H+=S4O
+2H+=S4O +2H2O查阅资料知体系中存在两个主要反应:
+2H2O查阅资料知体系中存在两个主要反应:
反应ⅰ:_________
反应ⅱ:I2+2S2O =2I-+S4O
=2I-+S4O
(1)写出反应I的离子方程式___________
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均0.01mol/L)。
a.向酸化的H2O2溶液中加入___________ 溶液,溶液几秒后变为蓝色。
b.___________ ,溶液立即褪色。
(3)探究 对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为
对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为 )
)
①将b实验补充完整____________ 、____________ 。
②对比实验Ⅰ和实验Ⅱ,
__________  (填“>”或“<”)。
(填“>”或“<”)。
③结合(1)中现象解释溶液混合后一段时间才变蓝的原因___________ 。
④利用实验Ⅰ的数据,计算反应ii在 时间内平均反应速率(用
时间内平均反应速率(用 浓度的变化表示)
浓度的变化表示)___________ 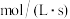 。
。
 +2H+=S4O
+2H+=S4O +2H2O查阅资料知体系中存在两个主要反应:
+2H2O查阅资料知体系中存在两个主要反应:反应ⅰ:_________
反应ⅱ:I2+2S2O
 =2I-+S4O
=2I-+S4O
(1)写出反应I的离子方程式
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均0.01mol/L)。
a.向酸化的H2O2溶液中加入
b.
(3)探究
 对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为
对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为 )
)| 实验序号 | Ⅰ | Ⅱ | |
| 试剂 | 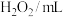 | 5 | ① |
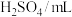 | 4 | 2 | |
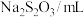 | 8 | 8 | |
 (含淀粉) (含淀粉) | 3 | 3 | |
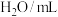 | 0 | ② | |
| 将上述溶液迅速混合观察现象 | 溶液变蓝所需时间为t1秒 | 溶液变蓝所需时间为t2秒 | |
②对比实验Ⅰ和实验Ⅱ,

 (填“>”或“<”)。
(填“>”或“<”)。③结合(1)中现象解释溶液混合后一段时间才变蓝的原因
④利用实验Ⅰ的数据,计算反应ii在
 时间内平均反应速率(用
时间内平均反应速率(用 浓度的变化表示)
浓度的变化表示)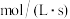 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】金属钴( )在国防工业中有着重要应用。某矿石中含钴的氧化物(
)在国防工业中有着重要应用。某矿石中含钴的氧化物( 、
、 )研究人员在实验室用硫酸酸没的方法提取钴元素,制备高纯度的钴的氧化物。研究人员查阅资料如下:
)研究人员在实验室用硫酸酸没的方法提取钴元素,制备高纯度的钴的氧化物。研究人员查阅资料如下:
钴 为灰色金属,有强磁性。钴元素化合物中常见价态有+2、+3价。钴元素能与氧元素组成化合物,包括
为灰色金属,有强磁性。钴元素化合物中常见价态有+2、+3价。钴元素能与氧元素组成化合物,包括 、
、 和
和 。+3价的钴盐通常不稳定,
。+3价的钴盐通常不稳定, 可以将
可以将 氧化,致使其在水溶液中不能稳定存在。
氧化,致使其在水溶液中不能稳定存在。
(1) 不能在水溶液中稳定存在的原因是
不能在水溶液中稳定存在的原因是 具有
具有___________ 性,在该反应中得到的氧化产物是___________ 。
(2)酸浸时某矿石(含 、
、 )会发生如下反应,请将反应方程式补充完整:
)会发生如下反应,请将反应方程式补充完整:
反应Ⅰ:___________ 
反应Ⅱ:___________ 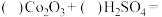
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
①本实验研究了哪些因素对钴元素浸出率的影响___________ ;
②根据上表数据,其他条件不变,温度升高,钻元素的浸出率___________ (填“增大”、“减小”或“不变”);
③酸浸时,加入 固体的作用是
固体的作用是___________
(4)酸浸后的溶液经沉钴得到草酸钴晶体 (相对分子质量为183),煅烧草酸钴晶体可以得到高纯度钴的氧化物,其分解过程分为三个阶段,对应温度和失重率(失重率=对应温度下样品失重的质量÷初始样品的质量×100%)如下表所示:
(相对分子质量为183),煅烧草酸钴晶体可以得到高纯度钴的氧化物,其分解过程分为三个阶段,对应温度和失重率(失重率=对应温度下样品失重的质量÷初始样品的质量×100%)如下表所示:
阶段Ⅱ生成的固体氧化物仅有一种,该固体氧化物的化学式___________ (填化学式)。
 )在国防工业中有着重要应用。某矿石中含钴的氧化物(
)在国防工业中有着重要应用。某矿石中含钴的氧化物( 、
、 )研究人员在实验室用硫酸酸没的方法提取钴元素,制备高纯度的钴的氧化物。研究人员查阅资料如下:
)研究人员在实验室用硫酸酸没的方法提取钴元素,制备高纯度的钴的氧化物。研究人员查阅资料如下:钴
 为灰色金属,有强磁性。钴元素化合物中常见价态有+2、+3价。钴元素能与氧元素组成化合物,包括
为灰色金属,有强磁性。钴元素化合物中常见价态有+2、+3价。钴元素能与氧元素组成化合物,包括 、
、 和
和 。+3价的钴盐通常不稳定,
。+3价的钴盐通常不稳定, 可以将
可以将 氧化,致使其在水溶液中不能稳定存在。
氧化,致使其在水溶液中不能稳定存在。(1)
 不能在水溶液中稳定存在的原因是
不能在水溶液中稳定存在的原因是 具有
具有(2)酸浸时某矿石(含
 、
、 )会发生如下反应,请将反应方程式补充完整:
)会发生如下反应,请将反应方程式补充完整:反应Ⅰ:

反应Ⅱ:
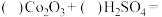
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
| 编号 | 矿石用量/g | 硫酸用量/g |  用量/g 用量/g | 温度/℃ | 钴元素浸出率/% |
| 1 | 85.71 | 12.62 | 0 | 85 | 56.39 |
| 2 | 85.71 | 6.31 | 0 | 85 | 49.98 |
| 3 | 85.71 | 6.31 | 0 | 65 | 43.33 |
| 4 | 85.71 | 6.31 | 0.43 | 65 | 73.95 |
| 5 | 85.71 | 6.31 | 0.86 | 65 | 74.77 |
②根据上表数据,其他条件不变,温度升高,钻元素的浸出率
③酸浸时,加入
 固体的作用是
固体的作用是(4)酸浸后的溶液经沉钴得到草酸钴晶体
 (相对分子质量为183),煅烧草酸钴晶体可以得到高纯度钴的氧化物,其分解过程分为三个阶段,对应温度和失重率(失重率=对应温度下样品失重的质量÷初始样品的质量×100%)如下表所示:
(相对分子质量为183),煅烧草酸钴晶体可以得到高纯度钴的氧化物,其分解过程分为三个阶段,对应温度和失重率(失重率=对应温度下样品失重的质量÷初始样品的质量×100%)如下表所示:| 热分解阶段 | Ⅰ | Ⅱ | Ⅲ |
| 热分解温度/℃ | 150-210 | 290-320 | 890-920 |
| 失重率/% | 19.67 | 36.43 | 2.91 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,某实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):

(1)试写出酸性KMnO4和H2C2O4的离子反应方程式为:___________ 。
(2)该实验探究的是___________ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是:___________>___________,___________ (填实验序号)。
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),用CO2表示2min内的反应速率为___________ ,则在2min末c(MnO )=
)=___________ (假设混合液体积为50mL)。
(4)实验小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:产物Mn2+(或MnSO4)是反应的催化剂;②___________ 。
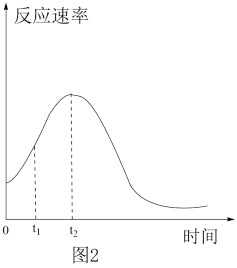

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20mL0.2mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),用CO2表示2min内的反应速率为
 )=
)=(4)实验小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:产物Mn2+(或MnSO4)是反应的催化剂;②

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】一种可以同时制备 HClO4和NaClO2的实验过程如图:
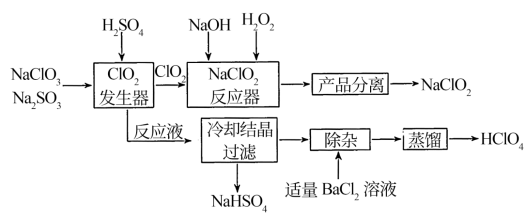
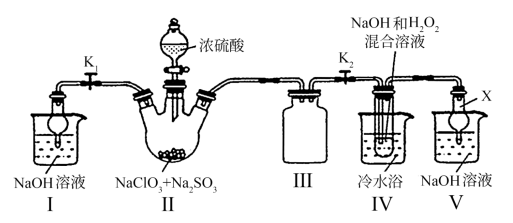
其中制备NaClO2的实验装置如图所示:
(1)NaClO2的制备
①仪器X的名称是_______ 。NaClO2的水溶液呈碱性, 其原因为(用离子方程式表示)_______ 。
②写出装置IV中反应的化学方程式:_______ 。
③向ClO2发生器中滴加90%的浓硫酸后,向分液漏斗中加入少量的蒸馏水,滴入反应装置内,滴加少量水的目的是_______ 。
(2)“除杂”时,加入BaCl2溶液除去的是_______ (写离子符号)。

其中制备NaClO2的实验装置如图所示:

(1)NaClO2的制备
①仪器X的名称是
②写出装置IV中反应的化学方程式:
③向ClO2发生器中滴加90%的浓硫酸后,向分液漏斗中加入少量的蒸馏水,滴入反应装置内,滴加少量水的目的是
(2)“除杂”时,加入BaCl2溶液除去的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥__ 。
(2)试验编号②和③探究的内容是____ 。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=___ mol·L-1·min-1。
实验编号 | H2C2O4溶液 | 酸性KMnO4 | 温度 | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
0.10 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 50 | |
(2)试验编号②和③探究的内容是
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=
您最近一年使用:0次
【推荐1】氨的用途十分广泛,是制造硝酸和氮肥的重要原料。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于___________ kJ
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
(3)已知合成氨反应的速率方程为:ν=kcα(N2)cβ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为___________ 。
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是___________ (填标号)。
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g) NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/mol
b.NH2COONH4(1) CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是___________ (填“第一步”或“第二步”)。
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
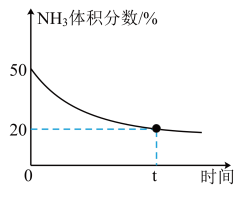
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=___________ MPa-2(已知:分压=总压×体积分数)。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
| A.容器内压强不变 | B.N2的体积分数不变 |
| C.气体的密度不再改变 | D.V正(N2)=3V逆(H2) |
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。①为进一步提高NH3的平衡转化率,下列措施能达到目的的是
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)
 NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/molb.NH2COONH4(1)
 CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】汽车尾气中含有CO、NOx等有害气体。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:___________ 。
(2)汽车尾气中NO生成过程的能量变化示意图如下:
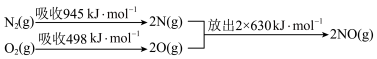
该条件下,N2和O2完全反应生成2molNO时需要_______ (吸收或释放)________ kJ的能量。
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:

①NiO电极上发生的是___________ 反应(填“氧化”或“还原”)。
②外电路中,电子的流动方向是从___________ 电极流出(填NiO或Pt);Pt电极上的电极反应式为___________ 。
(4)一种新型催化剂能使NO和CO发生反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
①请将表中数据补充完整:A___________ ;B___________ 。
②能验证温度对化学反应速率影响规律的实验是___________ (填实验编号)。
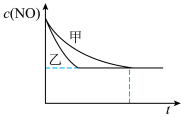
③实验Ⅰ和实验Ⅱ中,c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的曲线是___________ (填“甲”或“乙”)。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)汽车尾气中NO生成过程的能量变化示意图如下:

该条件下,N2和O2完全反应生成2molNO时需要
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:

①NiO电极上发生的是
②外电路中,电子的流动方向是从
(4)一种新型催化剂能使NO和CO发生反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
| 实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | B | 124 |
| Ⅲ | 350 | A | 5.80×10-3 | 82 |
②能验证温度对化学反应速率影响规律的实验是
③实验Ⅰ和实验Ⅱ中,c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的曲线是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某实验小组探究浓度、温度及催化剂对H2O2分解速率的影响。
(1)实验室可用固体Na2O2与稀硫酸反应(温度不高于15℃)制取少量5%H2O2,写出该反应的化学方程式:___ 。
(2)将上述制得的H2O2进行实验:其中实验Ⅰ与实验Ⅱ是为了探究浓度对H2O2分解反应速率的影响,实验Ⅰ与实验Ⅲ是为了探究温度对H2O2分解反应速率的影响。
填写表中缺少的内容:①___ ,②____ ,③____ 。
(3)为探究Fe3+和Cu2+对H2O2分解反应速率的影响,设计如图所示装置进行实验(保持相同温度)。
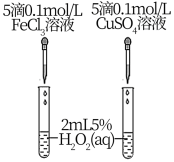
有同学对该实验设计提出疑问,认为不能比较Fe3+、Cu2+对H2O2分解反应速率的影响,提出的疑问是___ ,改进办法是___ ,改进后,判断Fe3+、Cu2+对H2O2分解反应速率影响的现象是___ 。
(1)实验室可用固体Na2O2与稀硫酸反应(温度不高于15℃)制取少量5%H2O2,写出该反应的化学方程式:
(2)将上述制得的H2O2进行实验:其中实验Ⅰ与实验Ⅱ是为了探究浓度对H2O2分解反应速率的影响,实验Ⅰ与实验Ⅲ是为了探究温度对H2O2分解反应速率的影响。
| 实验编号 | H2O2溶液 | 温度/℃ | 水的体积/mL | |
| 质量分数 | 体积/mL | |||
| Ⅰ | 5% | 5.0 | 常温 | 10.0 |
| Ⅱ | 5% | ① | 常温 | 5.0 |
| Ⅲ | ② | ③ | 60 | 10.0 |
(3)为探究Fe3+和Cu2+对H2O2分解反应速率的影响,设计如图所示装置进行实验(保持相同温度)。

有同学对该实验设计提出疑问,认为不能比较Fe3+、Cu2+对H2O2分解反应速率的影响,提出的疑问是
您最近一年使用:0次



