按要求回答下列问题
(1)已知下列热化学方程式:
①2H2(g)+O2(g)= 2H2O(l) △H = -571.6kJ·mol-1
②C(s)+ O2(g)= CO2(g) △H = -393.5kJ·mol-1
③C(s)+ H2O(g) = CO(g)+ H2(g) △H = +131.5kJ·mol-1
上述反应中属于放热反应的是____ (填序号,下同),属于吸热反应的是____ 。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1275.6kJ·mol-1
②H2O(l)=H2O(g) ∆H=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_______ 。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)适量O2(g)反应生成NO(g),需吸收68 kJ的热量,该反应的热化学方程式为_______ 。
②在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为______ 。
(1)已知下列热化学方程式:
①2H2(g)+O2(g)= 2H2O(l) △H = -571.6kJ·mol-1
②C(s)+ O2(g)= CO2(g) △H = -393.5kJ·mol-1
③C(s)+ H2O(g) = CO(g)+ H2(g) △H = +131.5kJ·mol-1
上述反应中属于放热反应的是
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1275.6kJ·mol-1
②H2O(l)=H2O(g) ∆H=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)适量O2(g)反应生成NO(g),需吸收68 kJ的热量,该反应的热化学方程式为
②在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
更新时间:2020-12-12 15:12:25
|
相似题推荐
【推荐1】近年来将氯化氢转化为氯气的技术成为科学研究的热点。
(1)迪肯发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为密闭容器中, 进料浓度比 c(HCl) ∶c(O2)分别等于 1∶1、4∶1、7∶1 时 HCl 平衡转化率随温度 变化的关系:
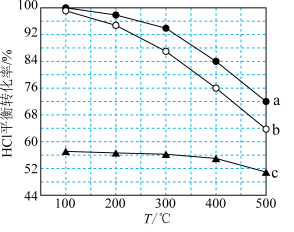
①据图象可知反应平衡常数 K(300℃)______ K(400℃),(填“>”或“<”)。判 断理由是:________________________________________________ ;
②若进料浓度比 c(HCl) ∶c(O2)等于 1∶1,400℃时,O2的转化率是______ 。
(2)Deacon 直接氧化法可按下列催化过程进行:CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1,4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,还需要利用__________ 反应的ΔH。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计 了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
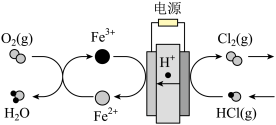
阴极区发生的反应有Fe3+ + e- = Fe2+和___________________ (写反应方程式)。
电路中转移1 mol电子,可生成氯气__________ L(标准状况)。
(1)迪肯发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为密闭容器中, 进料浓度比 c(HCl) ∶c(O2)分别等于 1∶1、4∶1、7∶1 时 HCl 平衡转化率随温度 变化的关系:

①据图象可知反应平衡常数 K(300℃)
②若进料浓度比 c(HCl) ∶c(O2)等于 1∶1,400℃时,O2的转化率是
(2)Deacon 直接氧化法可按下列催化过程进行:CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1,4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,还需要利用
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计 了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:

阴极区发生的反应有Fe3+ + e- = Fe2+和
电路中转移1 mol电子,可生成氯气
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:
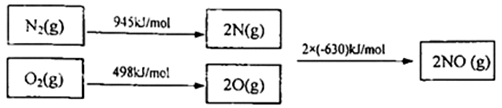
则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=_________ 。
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g) N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
①0~2 s 内用N2表示的化学反应速率为______ 该温度下,反应的平衡常数K1________ 。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1___ K2 (填“>”、“<”或“=”),原因是____________________ 。
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
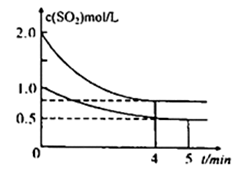
下列说法正确的是_________ (填标号)。
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。
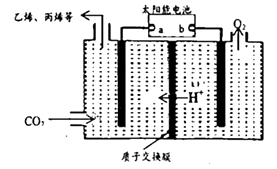
①该工艺中能量转化方式主要有___________________ 。
②电解时,生成乙烯的电极反应式是__________________________ 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:

则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g)
 N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g)
 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
下列说法正确的是
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。

①该工艺中能量转化方式主要有
②电解时,生成乙烯的电极反应式是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醛一定条件下直接脱氢可制甲醛,反应方程式:CH3OH(g) HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
实验测得随温度升高,平衡常数如下表所示。
(1)甲醛分子中所有原子都达到稳定结构,甲醛的电子式为_____________ 。
(2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是_______________ 。
A.混合气体的密度不变
B.CH3OH、HCHO的物质的量浓度之比为1:1
C.H2的体积分数不再改变
D.单位时间内甲醛的生成量与氢气的消耗量相等
(3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数___________ 20% (填“>”、“ =”、“ <”)。
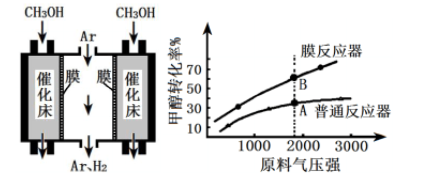
(4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。
①A点:v正______ v逆(填“>”、“ =”、“ <”),理由是____________ ;
②B点比A点转化率高的原因是_______________ 。
(5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应:
CH3OH(g)+1/2O2(g) HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
H2(g)+12O2(g) H2O(g) △H3
H2O(g) △H3
则△H2、△H3的大小关系是△H2________ △H3(填“>”、“ =”、“ <”)。
 HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1实验测得随温度升高,平衡常数如下表所示。
温度(K) | 500 | 700 | T1 | T2 | T3 |
平衡常数 | 7.13×10-4 | 3.30×10-1 | 2.00 | 9.00 | 10.00 |
(2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是
A.混合气体的密度不变
B.CH3OH、HCHO的物质的量浓度之比为1:1
C.H2的体积分数不再改变
D.单位时间内甲醛的生成量与氢气的消耗量相等
(3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数
(4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。
①A点:v正
②B点比A点转化率高的原因是

(5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应:
CH3OH(g)+1/2O2(g)
 HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2H2(g)+12O2(g)
 H2O(g) △H3
H2O(g) △H3则△H2、△H3的大小关系是△H2
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_______________ 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___________ ,氧化性最弱的简单阳离子是_________ 。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
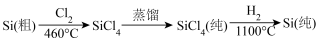
写出SiCl4的电子式:____________ ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为___________
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___________________________ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式:
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】化学反应的过程,既有物质的转化过程,也是化学能与热等其他形式能量的转化过程。
Ⅰ.已知某反应 过程中的能量变化如图所示,回答问题。
过程中的能量变化如图所示,回答问题。
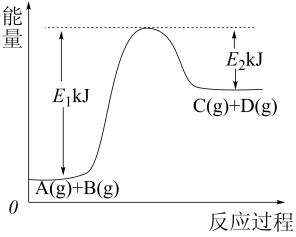
(1)该反应是___________ (填“吸热”或“放热”)反应,该反应的 =
=___________ kJ/mol(用含E1、E2的代数式表示)。
(2)1mol气体A和1mol气体B具有的总能量___________ (填“>”“<”或“=”)1mol气体C和1mol气体D具有的总能量。
Ⅱ.发射卫星时可用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,两者反应生成氮气和气态水。
已知: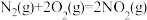
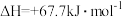

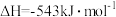
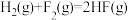
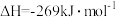
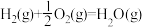
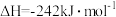
(3)N2H4 (g)和NO2(g)反应的热化学方程式为___________ ;
(4)有人认为若用氟单质代替二氧化氮作为氧化剂,则反应释放能量更多,N2H4 (g)和F2(g)反应的热化学方程式为___________ 。
Ⅲ.有机物通常能发生燃烧,对应的反应往往都有重要用途。
(5)在25℃、101k Pa条件下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程为___________ 。
(6)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则该反应的热化学方程式为___________ 。
Ⅰ.已知某反应
 过程中的能量变化如图所示,回答问题。
过程中的能量变化如图所示,回答问题。
(1)该反应是
 =
=(2)1mol气体A和1mol气体B具有的总能量
Ⅱ.发射卫星时可用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,两者反应生成氮气和气态水。
已知:
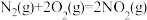
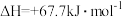

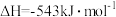
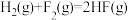
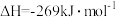
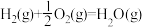
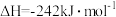
(3)N2H4 (g)和NO2(g)反应的热化学方程式为
(4)有人认为若用氟单质代替二氧化氮作为氧化剂,则反应释放能量更多,N2H4 (g)和F2(g)反应的热化学方程式为
Ⅲ.有机物通常能发生燃烧,对应的反应往往都有重要用途。
(5)在25℃、101k Pa条件下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程为
(6)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则该反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】某温度时,向某VL的密闭容器中充入3molH2(g)和3molI2(g),发生反应:H2(g)+I2(g) 2HI(g) △H=-26.5kJ•mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
2HI(g) △H=-26.5kJ•mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
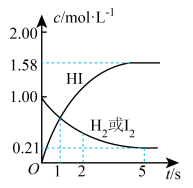
(1)0-5秒内平均反应速率v(HI)=___ mol/(L•s)。
(2)该反应达到平衡状态时,放出的热量为___ kJ。
(3)判断该反应达到平衡的依据是___ (填序号)。
①H2消耗的速率和I2消耗的速率相等
②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化
④该条件下正、逆反应速率都为零
⑤混合气体的平均分子量不再发生变化
⑥气体的颜色不再发生变化
 2HI(g) △H=-26.5kJ•mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
2HI(g) △H=-26.5kJ•mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
(1)0-5秒内平均反应速率v(HI)=
(2)该反应达到平衡状态时,放出的热量为
(3)判断该反应达到平衡的依据是
①H2消耗的速率和I2消耗的速率相等
②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化
④该条件下正、逆反应速率都为零
⑤混合气体的平均分子量不再发生变化
⑥气体的颜色不再发生变化
您最近一年使用:0次



