据所学知识完成以下题目:
(1)在下列反应中,HCl做还原剂的是_______ ,HCl做氧化剂的是_______ 。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,_______ 。
②Mn2++ +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,_______ 。
(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,_______ 。
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是____ ;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂_____ mol,有_____ mol电子发生转移,相当于测出含钙元素的质量是_____ g。
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____ 。
(1)在下列反应中,HCl做还原剂的是
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓)
 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O④KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,
②Mn2++
 +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
20-21高一上·福建龙岩·阶段练习 查看更多[5]
福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题05 氧化还原反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练 (已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)
更新时间:2020-12-24 10:24:50
|
相似题推荐
填空题
|
较难
(0.4)
解题方法
【推荐1】I由FeO、Fe2O3、 Fe3O4 组成的混合物,测得其中铁元素与氧元素的质量比为21:8 ,则这种混合物中FeO、Fe2O3、 Fe3O4 的物质的之比可能为_______ 。
A.1:2:1 B.1:1:1 C.2:1:1 D.1:1:2
II常温下KMnO4氧化浓HCI的反应方程式如下: 2KMnO4 +16HCl (浓) =2KCI+ 2MnCl2十5CI2↑+8H20
(1)用“双线桥法”标明反应中电子转移的方向和数目_______ 。
(2)又已知MnO2 + 4HCI(浓) MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:
MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:______ 。
(3)若有63.2g高锰酸钾参加反应,则被氧化的HCI的物质的量为______ mol,产
生的Cl2在标准状况下的体积______ L。
A.1:2:1 B.1:1:1 C.2:1:1 D.1:1:2
II常温下KMnO4氧化浓HCI的反应方程式如下: 2KMnO4 +16HCl (浓) =2KCI+ 2MnCl2十5CI2↑+8H20
(1)用“双线桥法”标明反应中电子转移的方向和数目
(2)又已知MnO2 + 4HCI(浓)
 MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:
MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:(3)若有63.2g高锰酸钾参加反应,则被氧化的HCI的物质的量为
生的Cl2在标准状况下的体积
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】某无色透明溶液中只可能大量存在NH4+、Na+、Ag+、Ba2+、MnO4-、Fe3+、CO32-、SO42-、NO3-中的几种离子。从其中取两份各100mL,进行如下实验:
(1)不做任何实验就可以肯定原溶液中不存在的两种离子是_______ 、_______ 。
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体0.06mol。另取其中的一份加入过量Ba(NO3)2溶液,生成白色沉淀4.30 g,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33 g。综上所述说明原溶液中肯定存在的各离子浓度分别是(下面填写要求:例如c(Na+)=0.1 mol/L)
_____________ 、____________ 、____________ 、_____________ (此空可以不填完)
(3)题干中的MnO4-是化学中的典型强氧化剂,另外生活中常用到的草酸(H2C2O4)是二元弱酸且具有还原性,二者在酸性条件下反应:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+ K2SO4+8H2O,该反应中氧化产物是___________ (填名称),请写出该离子方程式并用双线桥标出电子转移的方向与数目:________________________________________________________ 。
(1)不做任何实验就可以肯定原溶液中不存在的两种离子是
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体0.06mol。另取其中的一份加入过量Ba(NO3)2溶液,生成白色沉淀4.30 g,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33 g。综上所述说明原溶液中肯定存在的各离子浓度分别是(下面填写要求:例如c(Na+)=0.1 mol/L)
(3)题干中的MnO4-是化学中的典型强氧化剂,另外生活中常用到的草酸(H2C2O4)是二元弱酸且具有还原性,二者在酸性条件下反应:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+ K2SO4+8H2O,该反应中氧化产物是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】(一)2011年,内蒙古、新疆、浙江等地都要陆续召开各具特色的农博会,到时“生态农业”将成为农会人员关注的热门话题。生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是________ 。
(2)原混合气体中氮气的体积分数为________ 。
(二)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为___________________
(三)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
已知0.2 mol KBrO3在反应中得到1 mol电子生成X,请将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_________________
 +
+
(四) 在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)、过氧化钠为原料制取氧气,当制得同温、同压下相同体积的O2时,四个反应中转移的电子数之比为_____________
 CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。(1)原混合气体中甲烷的物质的量是
(2)原混合气体中氮气的体积分数为
(二)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为
(三)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
已知0.2 mol KBrO3在反应中得到1 mol电子生成X,请将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。
 +
+
(四) 在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)、过氧化钠为原料制取氧气,当制得同温、同压下相同体积的O2时,四个反应中转移的电子数之比为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3→ 3O2↑+ 2Cl2↑+ 4HClO4+ 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:_________ →___________ (填化学式)。
该反应的氧化产物是____________ (填化学式);所得混合气体的平均式量为_______ 。
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子。反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,该离子反应方程式为____________________________ 。若将该反应设计成原电池,则在正极生成的离子是___________ (填离子名称)
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是_________ (填序号)。
a. KMnO4> Cl2 b. Cl2> O2 c. HIO4> HClO3 d. HIO4> Cl2
8HClO3→ 3O2↑+ 2Cl2↑+ 4HClO4+ 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:
该反应的氧化产物是
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子。反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,该离子反应方程式为
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是
a. KMnO4> Cl2 b. Cl2> O2 c. HIO4> HClO3 d. HIO4> Cl2
您最近一年使用:0次
【推荐2】写出下列反应的离子方程式(已知还原性: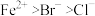 ):
):
(1)向 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 ):
):_________ ;
(2)向 溶液中通入足量
溶液中通入足量 :
:______ ;
(3)向 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:______ 。
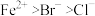 ):
):(1)向
 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 ):
):(2)向
 溶液中通入足量
溶液中通入足量 :
:(3)向
 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】目前我国锅炉烟气脱硝技术有新发现,科学家对O3氧化烟气脱硝同时制硝酸进行了实验研究,其生产硝酸的机理如下:
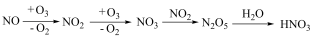
回答下列问题:
(1)NO3分子内存在两个过氧键,且氧均满足8电子稳定结构,请写出NO3中N的化合价______ ;NO3极不稳定,常温下即可爆炸分解,试从电子成键角度解释NO3不稳定的原因:______ 。
(2)N2O5与O3作用也能生成NO3与氧气,根据反应前后同种元素,价态相同,不参与氧化还原反应的原则,请分析反应N2O5+O3=2NO3+O2中,N2O5的作用是______ (填“氧化剂”“还原剂”或“既是氧化剂,又是还原剂”)。
(3)请写出在有水存在时,O3与NO以物质的量之比为3∶2完全反应的总化学方程式______ 。
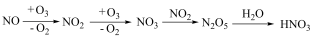
回答下列问题:
(1)NO3分子内存在两个过氧键,且氧均满足8电子稳定结构,请写出NO3中N的化合价
(2)N2O5与O3作用也能生成NO3与氧气,根据反应前后同种元素,价态相同,不参与氧化还原反应的原则,请分析反应N2O5+O3=2NO3+O2中,N2O5的作用是
(3)请写出在有水存在时,O3与NO以物质的量之比为3∶2完全反应的总化学方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,由此说明ClO2具有___________ 性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2====2ClO2+____________ 。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O+I2===S4O+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
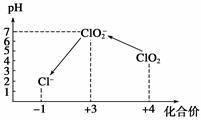
操作时,不同pH环境中粒子种类如图所示:
请回答:
①操作Ⅰ中反应的离子方程式是__________________ 。
②确定操作Ⅱ完全反应的现象是___________________ 。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_______________________ 。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是__________ mg·L-1。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,由此说明ClO2具有
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2====2ClO2+
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O+I2===S4O+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:

请回答:
①操作Ⅰ中反应的离子方程式是
②确定操作Ⅱ完全反应的现象是
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】按要求填空:
(1)现有以下物质:①NaHCO3;②O2;③CH3COOH溶液;④Ca(OH)2;⑤蔗糖;⑥H2O;⑦NaCl;⑧CO2;⑨氨水,
i.其中能导电的是(填编号,下同):_______ ;属于电解质的是_______ ;属于非电解质的是:_______ ;写出与②互为同素异形体的物质_______ ;
ii.请写出③和⑨的离子反应_______
iii.过量的①和少量的④在水溶液中的离子反应_______
(2)实验室制备Fe(OH)3胶体的化学方程式为_______ 。检验胶体制备是否成功的方法是_______ ,若制备成功,利用所制得的Fe(OH)3胶体进行下列实验:将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带_______ 电荷(填“正”或“负”);
(3)在反应3BrF3+5H2O=9HF+Br2+HBrO3+O2↑中,若有10分子 H2O参加反应,被水还原的溴离子个数为_______
(1)现有以下物质:①NaHCO3;②O2;③CH3COOH溶液;④Ca(OH)2;⑤蔗糖;⑥H2O;⑦NaCl;⑧CO2;⑨氨水,
i.其中能导电的是(填编号,下同):
ii.请写出③和⑨的离子反应
iii.过量的①和少量的④在水溶液中的离子反应
(2)实验室制备Fe(OH)3胶体的化学方程式为
(3)在反应3BrF3+5H2O=9HF+Br2+HBrO3+O2↑中,若有10分子 H2O参加反应,被水还原的溴离子个数为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】 (1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知:H2S(g) H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
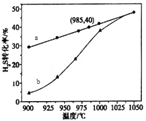
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。ΔH_____0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因:________________________。
②电化学法:该法制氢过程的示意图如图。

反应池中反应的离子方程式是_____________________________;
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式__________________。②电池总反应的化学方程式__________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KMnO4溶液进行滴定,实验所得数据如下表所示;
①滴入最后一滴酸性KMnO4溶液,溶液___________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗;
B.锥形瓶洗净后未干燥;
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
①高温热分解法:已知:H2S(g)
 H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。ΔH_____0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因:________________________。
②电化学法:该法制氢过程的示意图如图。

反应池中反应的离子方程式是_____________________________;
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式__________________。②电池总反应的化学方程式__________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KMnO4溶液进行滴定,实验所得数据如下表所示;
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液的体积/ml | 20.60 | 20.02 | 20.00 | 19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液___________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗;
B.锥形瓶洗净后未干燥;
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
您最近一年使用:0次
【推荐1】高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
② MnO +CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是___________ (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:___________
___________MnO +___________Fe2++___________H+=___________Mn2++___________Fe3++___________ H2O
+___________Fe2++___________H+=___________Mn2++___________Fe3++___________ H2O
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为___________ g。需要的玻璃仪器有___________
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(4)用软锰矿制备K2MnO4的化学方程式是:___________ 。
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为___________ 。
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO
 +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)② MnO
 +CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
___________MnO
 +___________Fe2++___________H+=___________Mn2++___________Fe3++___________ H2O
+___________Fe2++___________H+=___________Mn2++___________Fe3++___________ H2O(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(4)用软锰矿制备K2MnO4的化学方程式是:
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】“低碳循环”引起各国的高度重视,而如何降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ 
___ 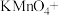
_____ 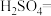
_____ 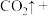
____  +
+___ 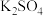 +
+___ 
(2)将不同量的 (g)和
(g)和 (g)分别通入到体积为 2L的恒容密闭容器中,进行反应
(g)分别通入到体积为 2L的恒容密闭容器中,进行反应
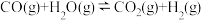 ,得到如下二组数据:
,得到如下二组数据:
①实验1中以 表示的反应速率为
表示的反应速率为________ (保留二位小数,下同)。
②实验2条件下平衡常数K=__________ ,该反应为_________ (填“吸”或“放”)热反应。
(3)已知在常温常压下:
①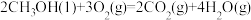
 kJ/mol
kJ/mol
②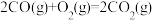
 kJ/mol
kJ/mol
③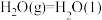
 kJ/mol
kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式______________
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
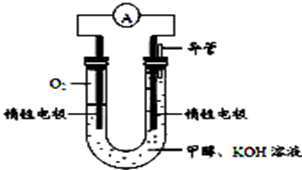
①该电池正极的电极反应为_____________ 。
②该电池工作时,溶液中的 向
向____________ 极移动。
 的含量及有效地开发利用
的含量及有效地开发利用 ,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:

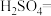
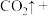
 +
+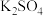 +
+
(2)将不同量的
 (g)和
(g)和 (g)分别通入到体积为 2L的恒容密闭容器中,进行反应
(g)分别通入到体积为 2L的恒容密闭容器中,进行反应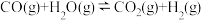 ,得到如下二组数据:
,得到如下二组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
 |  |  |  | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以
 表示的反应速率为
表示的反应速率为②实验2条件下平衡常数K=
(3)已知在常温常压下:
①
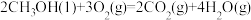
 kJ/mol
kJ/mol②
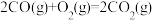
 kJ/mol
kJ/mol③
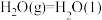
 kJ/mol
kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极的电极反应为
②该电池工作时,溶液中的
 向
向
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】根据英国地质调查局的报告,我国是世界上锑产量最大的国家,产量占全球的84%。锑在自然界中主要存在于辉锑矿(Sb2S3)中,湖南省冷水江市的锡矿山是世界最大锑矿,估计储量为210万吨。
(1)写出锑原子的核外电子排布,并以此判断其最常见的三个化合价:_______ 。
(2)在一些安全火柴的火柴头中使用了三硫化二锑。写出其燃烧时的化学反应方程式:_______ 。
(3)锑有两种常见氟化物。取其高价态的氟化物,在它的HF溶液中慢慢加入H2O2,得锑含量为44.97%的白色离子化合物A,其阴离子呈八面体结构。A的结构简式为_______ ,A不稳定,易缓慢分解为B和某种气体,写出生成B的化学方程式:_______ 。
(1)写出锑原子的核外电子排布,并以此判断其最常见的三个化合价:
(2)在一些安全火柴的火柴头中使用了三硫化二锑。写出其燃烧时的化学反应方程式:
(3)锑有两种常见氟化物。取其高价态的氟化物,在它的HF溶液中慢慢加入H2O2,得锑含量为44.97%的白色离子化合物A,其阴离子呈八面体结构。A的结构简式为
您最近一年使用:0次



