某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)
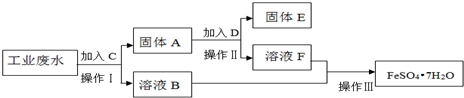
(1)操作Ⅰ的名称为_______ ,所需要的玻璃仪器有_______ ;
(2)固体A的成分为_______ (填化学式),溶液B中含有的离子有_______
(3)加入试剂C发生的化学方程式为_______ ;
(4)加入的试剂D为_______ ,发生的离子方程式为_______ ;
(5)操作Ⅲ包括_______ 过滤、洗涤和干燥。

(1)操作Ⅰ的名称为
(2)固体A的成分为
(3)加入试剂C发生的化学方程式为
(4)加入的试剂D为
(5)操作Ⅲ包括
更新时间:2021-02-22 19:49:30
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3

(1)“酸浸”过程中发生的主要反应的离子方程式为_______________ 。
(2)“氧化”的目的是_____________ 。检验Fe3+的方法是______________ 。
(3)滤渣I的主要成分________ 。溶于酸的反应方程式______________ 。
(4)②“转化”时主要反应的离子方程式为_________________________________ 。

(1)“酸浸”过程中发生的主要反应的离子方程式为
(2)“氧化”的目的是
(3)滤渣I的主要成分
(4)②“转化”时主要反应的离子方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
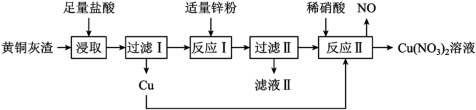
【推荐2】模拟工业上用黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe3O4、Fe2O3)生产Cu(NO3)2溶液的流程如下图所示。
回答下列问题:
(1)写出“浸取”时Fe3O4反应的离子方程式:_______ 。
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由_______ 。
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是_______ 。
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。若要获得100mL1.4mol·L-1的稀硝酸,需要用_____ 量取浓硝酸的体积为________ mL。
(5)金属材料的使用见证了人类文明发展过程,铝合金是目前用途广泛的合金之一、例如,硬铝(一种铝合金)中含Cu 4%、Mg 0.5%、______ 0.5%、Si 0.7%,它的密度小、强度高、具有较强的抗腐蚀能力。(填元素符号)
(6)工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mL FeCl3溶液中使铜全部溶解得到浸泡液(电路板上其他物质均不发生反应),测得电路板质量减少了6.4g,在浸泡液中加足量的铁粉并使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了4.8g,请回答下列问题:
①浸泡液中的溶质是________ (写化学式)。
②参与反应的铁粉的质量是______ g。
③假设溶液的体积不变,最后所得溶液c(Fe2+)=_____ mol·L-1。

回答下列问题:
(1)写出“浸取”时Fe3O4反应的离子方程式:
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。若要获得100mL1.4mol·L-1的稀硝酸,需要用
(5)金属材料的使用见证了人类文明发展过程,铝合金是目前用途广泛的合金之一、例如,硬铝(一种铝合金)中含Cu 4%、Mg 0.5%、
(6)工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mL FeCl3溶液中使铜全部溶解得到浸泡液(电路板上其他物质均不发生反应),测得电路板质量减少了6.4g,在浸泡液中加足量的铁粉并使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了4.8g,请回答下列问题:
①浸泡液中的溶质是
②参与反应的铁粉的质量是
③假设溶液的体积不变,最后所得溶液c(Fe2+)=
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:(已知:FeS2+H2SO4(稀)=FeSO4+H2S↑+S↓)
(1)操作I中为了提高硫酸渣的溶解速度,可采取的措施有____________ ,_________ (任写两种)。
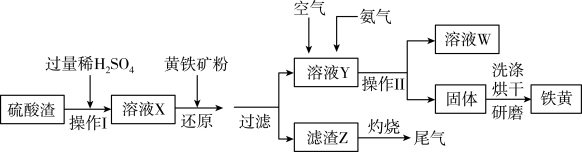
(2)滤液X中加入黄铁矿粉后,发生的还原反应离子方程式为_______________________ ;
(3)操作II中除用到玻璃棒外,还需要的玻璃仪器是____________ ;
(4)在溶液Y中通入空气的目的是____________ ;通入NH3发生的离子反应为___________ 。
(5)验证滤渣Z灼烧的尾气中含有SO2的方法____________________ ;
(6)为了测定制备铁黄中结晶水的含量,进行下列实验。
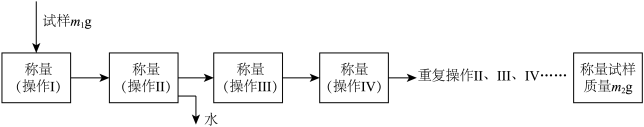
用分析天平准确称量m1g样品置于坩埚中加热、冷却;经过重复操作,当样品质量恒重时,测得质量为m2g,用算式表示出铁黄中结晶水的个数x=_________ 。
(7)拟用酸性高锰酸钾标准溶液滴定某亚铁盐溶液中Fe2+离子的浓度,请写出该反应的离子方程式_______ ,并叙述滴定终点的判断方法____________ 。
(1)操作I中为了提高硫酸渣的溶解速度,可采取的措施有

(2)滤液X中加入黄铁矿粉后,发生的还原反应离子方程式为
(3)操作II中除用到玻璃棒外,还需要的玻璃仪器是
(4)在溶液Y中通入空气的目的是
(5)验证滤渣Z灼烧的尾气中含有SO2的方法
(6)为了测定制备铁黄中结晶水的含量,进行下列实验。

用分析天平准确称量m1g样品置于坩埚中加热、冷却;经过重复操作,当样品质量恒重时,测得质量为m2g,用算式表示出铁黄中结晶水的个数x=
(7)拟用酸性高锰酸钾标准溶液滴定某亚铁盐溶液中Fe2+离子的浓度,请写出该反应的离子方程式
您最近半年使用:0次
【推荐1】某含镍废催化剂中主要含有 ,还含有Al、Al2O3、Fe及其他不溶于酸、碱的杂质。现用含镍废催化剂制备NiSO4·7H2O,其流程图如图所示:
,还含有Al、Al2O3、Fe及其他不溶于酸、碱的杂质。现用含镍废催化剂制备NiSO4·7H2O,其流程图如图所示:
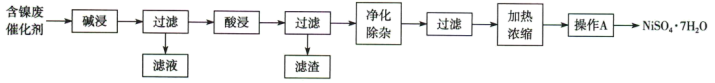
部分金属化合物的Ksp近似值如表所示:
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为______ 。
(2)“酸浸”所使用的酸为______ 。
(3)“操作A”为______ 、过滤、洗涤、干燥,即得产品。
 ,还含有Al、Al2O3、Fe及其他不溶于酸、碱的杂质。现用含镍废催化剂制备NiSO4·7H2O,其流程图如图所示:
,还含有Al、Al2O3、Fe及其他不溶于酸、碱的杂质。现用含镍废催化剂制备NiSO4·7H2O,其流程图如图所示:
部分金属化合物的Ksp近似值如表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | NiCO3 |
| Ksp近似值 | 1.0×10-17 | 1.0×10-38 | 1.0×10-34 | 1.0×10-15 | 1.0×10-5 |
(1)“碱浸”时发生反应的离子方程式为
(2)“酸浸”所使用的酸为
(3)“操作A”为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:

(1)步骤①反应的离子方程式是___________________ 。
(2)步骤③反应的化学方程式是___________________ ,从理论上考虑,下列也能吸收Br2的是___________________ 。
A.FeCl2 B.Na2SO3 C.H2O
(3)步骤①中已获得Br2,步骤③中又将Br2还原为Br-,步骤④又生成Br2,这样做的目的为___________________ 。
(4)已知海水中Br-含量为64mg/L,依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为___________________ L(忽略Cl2的溶解)。

(1)步骤①反应的离子方程式是
(2)步骤③反应的化学方程式是
A.FeCl2 B.Na2SO3 C.H2O
(3)步骤①中已获得Br2,步骤③中又将Br2还原为Br-,步骤④又生成Br2,这样做的目的为
(4)已知海水中Br-含量为64mg/L,依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】[2012·南通二调]碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的________ 沉淀,该工艺中“搅拌”的作用是_________ 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作_______ 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为__________ 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为________________ 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________ 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
您最近半年使用:0次



